ANABELA A. ANGELERI., LILI B. DÍAZ., GISELA COLIVA., FERNANDO GUERRA.,
LUIS A. PALAORO., ADRIANA E. ROCHER.
1Departamento de Bioquímica Clínica, Laboratorio de Citología, Hospital de Clínicas, INFIBIOC, Universidad de
Buenos Aires, 2Departamento de Patología, Hospital de Clínicas José de San Martín, Buenos Aires, Argentina
Resumen La citología cérvico-vaginal, test de Papanicolaou (PAP), es la técnica diagnóstica de cribado más
efectiva para la detección de lesiones precancerosas y la prevención del cáncer de cuello uterino. La sensibilidad de la prueba varía en las diferentes estadísticas entre el 50% y el 98%; la causa de esta amplitud depende de la toma de muestra. Para que la toma se considere satisfactoria es necesario que se realice de la zona escamocolumnar, zona de transformación, y según el sistema Bethesda en el extendido se deben observar células metaplásicas y/o endocervicales. El PAP convencional incluye la toma exo-endocervical con espátula de Ayre; sin embargo, solo el 50% aproximadamente de las muestras son representativas de la zona de transformación. Para ejemplificar esta situación se presenta el caso de una mujer de 40 años que, a pesar de tener citologías negativas durante cinco años, ninguna con células endocervicales o metaplásicas, una toma adecuada mostró un carcinoma in situ (HSIL: lesión intraepitelial escamosa de alto grado). Recalcamos la importancia de la correcta toma exo-endocervical para poder detectar todas las lesiones premalignas y prevenir este tipo de cáncer que aún tiene alta tasa de mortalidad en todo el mundo.
Palabras clave: endocervix, cáncer de cuello uterino, Papanicolaou
Abstract Quality of the exo-endocervical sampling in the prevention of uterine cervix cancer. Cervical
and vaginal cytology, Papanicolaou test (PAP), is the most effective test for screening of preneoplastic lesions, and cervical cancer prevention. Its sensitivity goes from 50 to 98%, according to different statistics, and this variation is related to the sampling procedure. A satisfactory smear should be taken from the transformation zone, the junction between endocervix and exocervix. According to Bethesda, metaplastic and/or endocervical cells should be observed under the microscope. The traditional PAP smear includes an exo-endocervical sampling using the Ayre spatula; however, only near 50% of the smears are representative of the transformation zone. In this case report, we present the case of a 40-year-old woman who had negative cytology in five consecutive annual PAP smears, none of which showed metaplastic or endocervical cells. A new sample evidenced a carcinoma in situ (HSIL: high-grade squamous intraepithelial lesion). We emphasize the importance of performing a correct exo-endocervical sampling to allow prompt detection of all premalignant lesions and to prevent cervical cancer, which still persists with high mortality worldwide.
Key words: endocervix, uterine cervical neoplasm, Papanicolaou test
Recibido: 29-III-2017 Aceptado: 21-VI-2017
Dirección postal: Dra. Anabela Angeleri, Adela Celia Burgos 41, 1613 Ingeniero Pablo Nogués, Buenos Aires, Argentina
e-mail: anabela.angeleri@gmail.com
La citología cérvico-vaginal, el test de Papanicolaou (PAP), es la técnica diagnóstica de cribado más efectiva para detectar las lesiones precancerosas y prevenir el cáncer de cuello uterino.. Este tipo de cáncer es considerado una neoplasia potencialmente curable, prevenible y, como su desarrollo es gradual, es posible detectar lesiones precursoras y así disminuir su incidencia. Comienza con cambios neoplásicos intraepiteliales que pueden transformarse en un proceso invasor en un período promedio de 10 a 20 años².
El principal factor involucrado en la neoplasia de cuello de útero es el virus del papiloma humano (HPV), pero son necesarios también otros factores para que se desarrolle el cáncer.. El HPV genital infecta una o varias áreas de los genitales femeninos: vulva, cérvix, perineo, región perianal y vagina. Los tipos virales 16 y 18 son considerados de alto riesgo porque son los identificados con mayor frecuencia en las lesiones cervicales que progresan4. La infección por HPV se inicia en la zona de unión escamocolumnar del epitelio pavimentoso estratificado del cuello uterino; el virus penetra en la célula de reserva del endocérvix o en las células basales del epitelio pavimentoso, y puede llegar por microabrasiones producidas en el epitelio5.
El Papanicolaou tiene una sensibilidad de 80% y una especificidad de 99%. La sensibilidad del PAP varía en las diferentes estadísticas; la causa de esta amplitud depende principalmente de la calidad de la toma de muestra6. Para que la toma se considere satisfactoria, es necesario que se realice de la zona escamocolumnar denominada zona de transformación y, según el sistema Bethesda, en el extendido citológico se deben observar células metaplásicas y/o endocervicales7.
El PAP incluye la toma exo-endocervical con espátula de Ayre. Sin embargo, aproximadamente solo la mitad de las muestras que se analizan diariamente tienen células metaplásicas y/o células endocervicales. Las lesiones premalignas y malignas se localizan en la zona exocervical o endocervical, si la lesión se encuentra dentro del canal endocervical la espátula de Ayre no tomará células de la lesión y por error de muestreo se diagnosticará un resultado falso negativo8. Este caso es un ejemplo.
Caso clínico
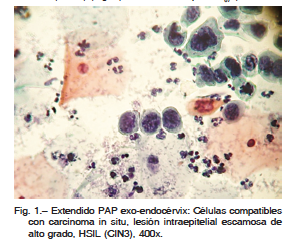
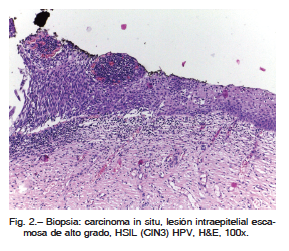
Mujer de 40 años que remitió al laboratorio de citología un extendido cérvico-vaginal para su evaluación. En el extendido se observó una lesión intraepitelial escamosa de bajo grado (LSIL), y ausencia de células endocervicales. Se evaluaron las muestras de controles anteriores, hechos durante cinco años (uno por año), y en todos esos extendidos faltaban las células endocervicales. Consultó a su ginecólogo quien realizó colposcopía confirmando el diagnóstico de LSIL y control en seis meses. Debido a la ausencia de células endocervicales en este control y en los anteriores, el citólogo sugirió un cepillado endocervical. Se realizó entonces la toma exocervical y el cepillado endocervical. En ambas muestras se observaron células compatibles con lesión intraepitelial escamosa de alto grado (HSIL: CIN3-Carcinoma in situ) (Fig. 1). Con este diagnóstico fue evaluada por el ginecólogo quien realizó toma exocervical, endocervical y legrado, y colposcopia que mostró una lesión en hora 7 y otra en hora 12, ambas fueron biopsiadas. Las muestras dieron los siguientes resultados: Toma exocervical: LSIL; toma endocervical: ASCUS (células atípicas de significado indeterminado); Legrado: LSIL; biopsia en hora 7: LSIL; biopsia en hora 12; CIN 2 (neoplasia intraepitelial cervical). En base a este diagnóstico se realizó un procedimiento de escisión electro-quirúrgica con asa cuya biopsia evidenció un HSIL (CIN 3) (Fig. 2). La marcación para Ki67 (> 90% de núcleos positivos) y de p16 (positividad en todo el espesor del epitelio) confirmó el resultado de la técnica corriente (Hematoxilina y Eosina). El control ginecológico realizado al tercer mes del procedimiento incluyó toma exo-endocervical, cepillado y colposcopía con resultados negativos.
Discusión
En Argentina, cada año se diagnostican alrededor de 3000 casos nuevos de cáncer de cuello de útero y mueren aproximadamente 1600 mujeres a causa de la enfermedad. El 82% de las muertes ocurre en mujeres mayores de 40 años. Es el segundo cáncer más frecuente después del cáncer de mama, con una tasa de incidencia de 7.5 cada 100 000 mujeres. Si se pone el acento en mujeres cuya edad se encuentra entre los 35 y 64 años, los tumores malignos son la primera causa de muerte y el cáncer cervical ocupa el segundo lugar como causa de defunción9, 10.
La citología exo-endocervical tiene un porcentaje de falsos negativos que varía ampliamente. Las publicaciones indican que en laboratorios acreditados la proporción de falsos negativos es de 5% al 10%¹¹. El 70% de estos falsos negativos son producidos por errores de muestreo y el resto por errores de detección (células anormales que no son detectadas durante el cribado) y por errores de interpretación¹² (las células son detectadas pero informadas en forma incorrecta). Se puede disminuir el 30% de error implementando programas internos y externos de control para asegurar la calidad de los resultados emitidos¹³.
Respecto a los errores de muestreo, la mayor tasa de falsos negativos se debe a problemas en la toma de muestra. Para disminuirlos es preciso tener en cuenta las recomendaciones del sistema Bethesda que considera que la muestra es adecuada para su evaluación solo si contiene células endocervicales y/o metaplásicas. Al menos se requieren 10 células de algunos de los dos tipos, solas o agrupadas, representativas de la zona de transformación7.
La efectividad de la citología cervical para detectar lesiones premalignas y malignas depende de la adecuada toma de muestra de la zona de transformación. La tasa de detección de anormalidades epiteliales es menor en los frotis que carecen de células endocervicales. Se ha comunicado un número estadísticamente significativo de extendidos negativos que no tenían células endocervicales en mujeres con cáncer cervical invasor8.
La obtención de células endocervicales en el PAP está influenciada por varios factores entre los que se destacan la experiencia de quien toma la muestra y el instrumento usado; el cepillo endocervical es el más efectivo11.
Este caso ejemplifica el problema de la inadecuada toma de muestra. Luego de cinco exámenes anuales consecutivos con citologías negativas pero sin células endocervicales o metaplásicas en el frotis, con una toma adecuada se detectó un carcinoma in situ. Por ello, a partir de la reunión de Bethesda, se recomienda realizar siempre doble toma (exo-endocervix) y complementarla con colposcopía para alcanzar un valor predictivo negativo cercano al 100%. La correcta toma de muestra contribuye a prevenir este tipo de cáncer que continúa con alta tasa de mortalidad en todo el mundo14, 15.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Tsikouras P, Zervoudis S, Manav B, et al. Cervical cancer: screening, diagnosis and staging. J BUON 2016; 21: 320-5.
2. Matos Berroa S, De los Santos Berrido E, Reolid Martínez R, et al. ¿Debemos redefinir la población diana en el cribado de cáncer cervical con la técnica de Papanicolaou? Clin Invest Gin Obst 2015; 42:150-6.
3. Baseman JG, Koutsky LA. The epidemiology of human papillomavirus infections. J Clin Virol 2005; 32 Suppl 1: S16-24.
4. Stanley M. Immune responses to human papillomavirus. Vaccine 2006; 24 Suppl 1: S16-22.
5. Palaoro LA, Rocher AE, de Torres R. Respuesta inflamatoria genital en la detección de alteraciones por virus del papiloma humano. Acta Bioquím Clín Latinoam 2013; 47: 551-60.
6. Abulafia O, Pezzullo JC, Sherer DM. Performance of ThinPrep liquid-based cervical cytology in comparison with conventionally prepared Papanicolaou smears: a quantitative survey. Ginecol Oncol 2003; 90: 137-44.
7. The Bethesda system for reporting cervical cytology. Nayar R, Wilbur DC, eds. 3rd ed. New York Dordrecht London: Springer Cham Heidelberg Springer International Publishing, Switzerland 2015. (eBook). DOI 10.1007/978-3-319-11074-5.
8. Celasun B. Presence of endocervical cells and number of slides in cervicovaginal smears. Differences in performance between gynecologists. Acta Cytol 2001; 45: 730-4.
9. Programa Nacional de Prevención de Cáncer Cervicouterino. En: www.msal.gov.ar; consultado febrero 2017.
10. World Health Organization. Control Integral del Cáncer Cervicouterino. Guía de Prácticas esenciales. OMS: 2007. En: www.who.int/cancer; consultado febrero 2017.
11. Zambrano Araque S, González Blanco M. Citología en base líquida: parámetros de eficacia. Rev Obstet Ginecol Venez 2015; 75: 187-99.
12. Gupta N, John D, Dudding N, Crossley J, Smith JH. Factors contributing to false-negative and potential false-negative cytology reports in SurePath™ liquid-based cervical cytology. Cytopathology 2013; 24: 39-43.
13. Herbert A, Bergeron C, Wiener H, et al. European guidelines for quality assurance in cervical cancer screening: recommendations for cervical cytology terminology. Cytopathology 2007; 18: 213-9.
14. Blumenthal PD, Gaffikin L, Chirenje ZM, McGrath J, Womack S, Shah K. Adjunctive testing for cervical cancer in low resource settings with visual inspection, HPV, and the Pap smear. Int J Gynecol Obst 2001; 72: 47-53.
15. Castellsagué X, Rémy V, Puig-Tintoré LM, de la Cuesta RS, González-Rojas N, Cohet C. Epidemiology and costs of screening and management of precancerous lesions of the cervix in Spain. J Low Genit Tract Dis 2009; 13: 38-45.
