FRANCISCO R. SPIVACOW, ELISA E. DEL VALLE, VALERIA S. PRUÑONOSA, AUDRI LIZCANO, YIRA SUÁREZ, VANINA PAZ WASIUCHNIK
Instituto de Investigaciones Metabólicas, Universidad del Salvador, Buenos Aires, Argentina
Resumen Múltiples estudios muestran la importancia de mantener niveles su cientes de vitamina D para prevenir varias enfermedades crónicas. Sin embargo, la suplementación de vitamina D sobre la calciuria es controvertida. El objetivo de este trabajo prospectivo, intervencionista, fue evaluar la respuesta de la calciuria en mujeres con hipercalciuria y normocalciuria, luego de conseguir niveles adecuados de 25 OH D. Se estudiaron 63 mujeres con hipercalciuria idiopática (9 con litiasis renal) y 50 mujeres normocalciúricas. Ambos grupos presentaron dé cit/insu ciencia de 25 OH D y fueron suplementadas con vitamina D2 o D3 semanales o vitamina D3 en dosis de 100 000 UI mensuales. A todas se les midió la calciuria basal y nal al alcanzar el valor de 25 OH D deseado (> 30 ng/dl). No observamos cambios signi cativos en los valores de la calciuria inicial y nal en las que recibieron vitamina D2 o D3 semanal ni en las que recibieron dosis mensuales. Sin embargo, un subgrupo de mujeres: 19% (n = 12) de las hipercalciúricas y 12% (n = 6) de las normocalciúricas (con vitamina D semanal) aumentaron la calciuria en forma signi cativa. Mientras que, con dosis mensuales, un 40% (n = 4/10) de las hipercalciúricas y 44% (n = 4/9) de las hipercalciúricas con litiasis renal aumentaron la calciuria. En conclusión, niveles adecuados de 25 OH D son seguros en la mayoría de las pacientes. En aquellas que requieren dosis de carga mensuales podrían observarse aumentos de la calciuria en forma signi cativa con riesgo de formar cálculos renales o perder masa ósea, cuando están genéticamente predispuestas.
Palabras clave: suplementos de vitamina D, calciuria
Abstract Calcium response to vitamin D supplementation. Several studies show the importance of serum vitamin D suf cient levels to prevent multiple chronic diseases. However, vitamin D supplementation and its effects on urine calcium excretion remain controversial. The objective of this prospective and interventional study was to evaluate urine calcium excretion in women with normal calciuria or hypercalciuria, once serum vitamin D suf ciency was achieved. We studied 63 women with idiopathic hypercalciuria, (9 with renal lithiasis) and 50 normocalciuric women. Both groups had serum vitamin D levels low (de ciency or insuf ciency). Baseline urine calcium excretion was measured before being supplemented with vitamin D2 or D3 weekly or vitamin D3 100.000 IU monthly. Once serum vitamin D levels were corrected achieving at least 30 ng/ml, a second urine calcium excretion was obtained. Although in the whole sample we did not observe signi cant changes in urine calcium excretion according to the way of supplementation, some of those with weekly supplementation had signi cant higher urine calcium excretion, 19% (n = 12) of hypercalciuric women and 12% (n = 6) of the normocalciuric group. Monthly doses, also showed higher urine calcium excretion in 40% of hypercalciuric women (n = 4/10) and in 44% (n = 4/9) of the renal lithiasis hypercalciuric patients. In conclusion, different ways of vitamin D supplementation and adequate serum levels are safe in most patients, although it should be taken into account a subgroup, mainly with monthly loading doses, that could increase the calciuria signi cantly eventually rising renal lithiasis risk or bone mass loss, if genetically predisposed.
Key words: vitamin D supplements, calciuria
Recibido: 23-VI-2017 Aceptado: 25-XI-2017
Dirección postal: Dr. Francisco R. Spivacow, Instituto de Investigacio- nes Metabólicas, Libertad 836, 1012 Buenos Aires, Argentina
e-mail: spiva@idim.com.ar
Valores de 25-hidroxivitamina D (25 OH D) entre 30 y 44 ng/dl serían convenientes para evitar distintas enferme- dades sin provocar efectos adversos1. Múltiples estudios, con niveles adecuados de 25 OH D, coinciden en la pre- vención de diferentes enfermedades crónicas1-3. Estudios epidemiológicos muestran una menor incidencia de caídas, pérdida de masa ósea, fracturas4-6, y un rol importante en la preservación de enfermedades vasculares y en el cáncer7-8. En un consenso reciente sobre la prevención de la litiasis renal, se menciona como un factor de riesgo el exceso de vitamina D9. Se observó un incremento en la incidencia de nefrolitiasis en el estudio Women’s Health Initiative (WHI) con dosis de 400 UI de vitamina D y 1000 mg de calcio por día10. Otros estudios, utilizando dosis mayores de vitamina D, no observaron aumento de la litiasis renal ni cambios en la calciuria11, 12. Leaf y col., en pacientes con litiasis renal y dé cit de vitamina D, no encontraron cambios en la calciuria, al corregir la hipovitaminosis D con 50 000 UI/ semana de ergocalciferol (durante 8 semanas), aunque un 37.9% presentó un aumento de la calciuria ≥ 20 mg/24 h13. El objetivo de nuestro trabajo fue evaluar la respuesta de la calciuria, en pacientes con hipercalciuria idiopática y normocalciuria, luego de corregir el dé cit de vitamina D.
Materiales y métodos
El presente es un estudio prospectivo, intervencionista, reali- zado en mujeres que concurrieron a nuestra institución entre 2009 y 2016 para evaluar su estado óseo y la presencia de litiasis renal. Como criterios de inclusión todas debían presen- tar función renal normal (FG > 60 ml/min), ser mayores de 18 años y no recibir medicación que modi que el metabolismo mineral y de vitamina D. Como criterios de exclusión no se incorporaron hombres, debido al per l de nuestra institución, tampoco mujeres con trastornos intestinales que produzcan algún grado de malabsorción, enfermedades hepáticas o hipercalciuria de otro origen, como las relacionadas al hiper- paratiroidismo primario, sarcoidosis o tirotoxicosis entre otras, ni tampoco pacientes con hipercalciuria idiopática y valores normales de 25 OH D. La presencia de litiasis renal fue de – nida cómo la eliminación de un cálculo en forma espontánea, por extracción urológica o bien por estar presente en una radiografía del árbol urinario, ecografía renal o tomografía computarizada. De nimos hipercalciuria idiopática a la excre- ción de calcio > 220 mg/24 h, o > 4 mg/kg en el promedio de dos orinas de 24 h, siguiendo su dieta e ingesta de líquidos habituales. Consideramos aumento signi cativo de la calciuria con respecto al basal, a valores que superaron los 30 mg/24 h.
Se seleccionaron 63 mujeres con hipercalciuria idiopática (grupo 1), 9 (14.3%) con litiasis renal, 15 (23.8%) con osteopo- rosis, 32 (50.8%) con osteopenia de columna lumbar o cadera y 6 (9.5%) con hipercalciuria, sin litiasis renal ni compromiso óseo. Como control, se incluyó un grupo de 50 mujeres nor- mocalciúricas (grupo 2), 17 (34%) con osteoporosis y 25 (50%) con osteopenia. No tuvimos en cuenta la exposición al sol (que fue aleatoria en ambos grupos) ni la estación del año en que fue medida la 25 OH D. Para disminuir la variabilidad de la calciuria se consideró el promedio de 2 orinas de 24 h tanto en la condición basal como en el control posterior. Consideramos dé cit/insu ciencia a valores de 25 OH D < 30 ng/dl, sin tener en cuenta el grado del dé cit de cada una de las pacientes. A todas se les administró vitamina D en dosis variables, con el objetivo de alcanzar niveles de 25 OH D > 30 ng/dl. La forma más utilizada de vitamina D fue ergocalciferol entre 16 800-24 000 UI/semana, y colecalciferol entre 7000-10 000 UI/semana, dependiendo la dosis de los valores basales encontrados. Un pequeño grupo (n = 15), 8 del grupo 1 y 7 del grupo 2, reci- bieron vitamina D3 en dosis mayores [DMM] (100 000 UI por mes, en frasco ampolla), dado que presentaban los valores de 25 OH D más bajos (< 12 ng/dl). En éstas, con DMM de vitamina D, la medición control de la calciuria y 25 OH D se realizó a las 8.5 ± 4 semanas, mientras que en aquéllas que recibieron vitamina D2 o D3 en forma semanal, el tiempo de control para el estudio fue de 10 ± 3 semanas. En todos los casos las dosis referidas fueron mantenidas hasta el control bioquímico que se utilizó para el análisis del presente estudio
A todas se les midió, en condiciones basales y durante el seguimiento, calcemia (Ca), calcio iónico (Cai), fósforo (P), parathormona intacta (PTHi), creatinina plasmática (Crea), clearance de creatinina (ClCr) y 25 OH D. En orina: calciu- ria, natriuria y creatininuria de 24 h. La densidad mineral ósea fue medida en todas las pacientes en columna lumbar y cuello de fémur izquierdo. Los equipos utilizados fueron un Lunar DPX IQ y Lunar Prodigy (Lunar Corp.of Madison. WI). Los criterios diagnósticos de masa ósea fueron: normal,
osteopenia, osteoporosis y osteoporosis grave, basados en la clasi cación densitométrica establecida en 1994 por la Organización Mundial de la Salud (OMS), referida al número de desvíos estándar en que se aleja la DMO de la media de una población joven normal (T-score) tomada como referen- cia. Consideramos osteopenia u osteoporosis,de acuerdo al T-score, en una o ambas regiones medidas
Los métodos y valores normales de laboratorio fueron: creatinina: método cinético de Jaffe, VN: 0.60-1.20 mg/dl en sangre, calcio (Ca) en sangre y orina: método ISE, VN: 8.8- 10.5 mg/dl en plasma y < 220 mg en orina de 24 h, fósforo (P): método cinético, VN: 2.7-4.5 mg/dl sérico, parathormona intacta: PTHi electro quimioluminiscencia, VN: 10-65 pg/ ml; 25 (OH) D por quimioluminiscencia (equipo Liaison XL, Diasorin),VN: > 40 ng/dl. Se calcularon en orina: el calcio/kg/ peso y el clearance de creatinina. Este último fue corregido por super cie corporal. No se midieron en el presente estudio los niveles de 1,25 (OH)2 D.
Todas las pacientes rmaron un consentimiento informado para el uso de sus datos en forma anónima.
Los valores fueron volcados en una base de datos y luego analizados empleando el software estadístico SPSS versión 23. Los resultados fueron expresados como media y desviación estándar (DS) y los porcentajes, con sus res- pectivos intervalos de con anza del 95%, siendo el nivel de signi cancia establecido en p < 0.05. Cuando fue necesario, dependiendo del tipo de variable, se utilizaron el test de Stu- dent, con evaluación de normalidad y de homogeneidad de varianzas, U de Mann Whitney y test de Fisher.
Resultados
En la Tabla 1 se observan las características demográ – cas y clínicas de ambos grupos. Las pacientes hipercal- ciúricas eran más jóvenes y tuvieron menos presencia de osteoporosis que las normocalciúricas, mientras la osteopenia fue similar en ambos grupos. En mujeres normocalciúricas no encontramos casos de litiasis renal.
La Tabla 2 muestra parámetros bioquímicos basales de ambos grupos. Además de la diferencia en los valores de la calciuria, la 25 OH D fue de citaria en forma similar en los dos grupos. El resto de los parámetros medidos no mostraron cambios signi cativos. En las 63 pacientes hipercalciúricas del grupo 1, la 25 OH D basal de 19.7 ± 6.2 ng/dl pasó a 31.6 ± 11.3 ng/dl, p< 0.001, la calciuria basal de 251 ± 42 mg/24 h pasó a 255 ± 63.2 mg/24 h, p = NS y la natriuresis de 141.4 ± 42 mEq/24 h pasó a 130 ± 55 mEq/24 h, p = NS, y en las 50 pacientes nor- mocalciúricas del grupo 2, la 25 OH D basal de 19.2 ± 6.2 ng/dl pasó a 30.6 ± 7.7 ng/dl, p< 0.001, la calciuria de 134 ± 61 mg/24 h pasó a 130 ± 73 mg/24 h, p = NS y la natriuresis de 116 ± 33 mEq/24 h pasó a 113 ± 55 mEq/24 h, p = NS. Quince pacientes de ambos grupos recibieron vitamina D3 en DMM. En 10 normocalciúricas, la calciuria basal de 129.6 ± 36 mg/24h pasó a: 101.2 ± 17 mg/24h, p = NS. La natriuria basal: 138.4 ± 36 mEq/24h, nal: 126.4 ± 11 mEq/24, p = NS. La 25 OH D basal fue: 19.2 ± 6.2 ng/dl y nal: 30 ± 7,7 ng/dl, p > 0.05. En las hipercalciúricas, la calciuria inicial fue: 251 ± 15 mg/24 h y nal: 264.2 ± 67 mg/24 h, p = NS. La natriuria basal fue
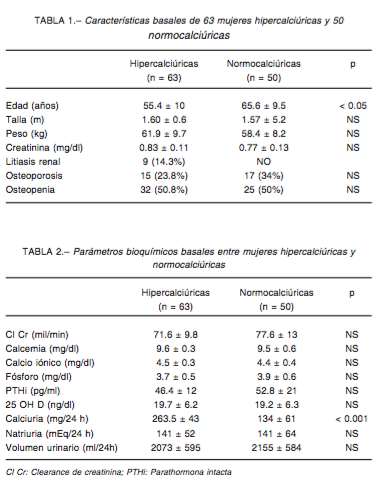
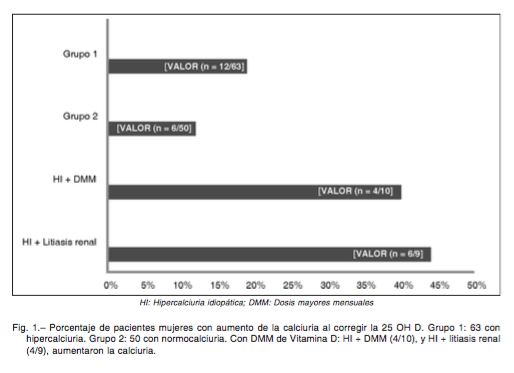
141.6 ± 41 mEq/24, nal: 132.5 ± 56 mEq/24 h, p = NS, y la25OHDbasalfue:10.8±3.4ng/dly nal:30±5.5 ng/ dl, p < 0.01. En 12 de las 63 pacientes hipercalciúricas, la calciuria basal pasó de 256 ± 55 mg/24 h a 333.5 ± 88 mg/24 h al nal del seguimiento, p < 0.01; en 6/50 pacientes normocalciúricas la calciuria basal pasó de 138±60mg/24ha245±86mg/24h,p<0.05.Enlas hipercalciúricas (4/10) que recibieron dosis mayores de vitamina D, la calciuria subió de 252 ± 44 mg/24 h a 320 ± 46 mg/24 h, y nalmente en 4 de 9 pacientes con hipercal- ciuria y litiasis renal, con dosis mayores de vitamina D, la calciuria de 265 ± 76 mg/24 h pasó a 384 ± 121 mg/24 h. (Fig. 1). En estos últimos subgrupos el pequeño número de pacientes incluido impidió alcanzar conclusiones de signi cación. En dos pacientes del Grupo 2 la calciuria pasó a valores de hipercalciuria.
Discusión
La corrección de los niveles de 25 OH D ha demostrado una reducción del 45% del riesgo de fracturas no trau- máticas14, de la mortalidad15, 16, del riesgo de caídas en mujeres añosas17 entre otros bene cios descriptos. El rol de la vitamina D en nefrolitiasis cálcica idiopática es controvertido18. Algunos estudios sugieren un aumento del riesgo19, vinculado a una mayor excreción de calcio urinario provocado por la acción de la 1.25 (OH)2 D20, 21, mientras otros sostienen que el aumento del aporte de 25 OH D, está estrictamente controlado por down regulation de la enzima 1 α hidroxilasa, o bien por un descenso de la PTH con menor producción de 1.25 (OH)2 D22. Sin embargo, concentraciones mayores de 25 OH D, precursor y marca- dor del estado de vitamina D, parecerían estar asociadas
a litiasis cálcica hipercalciúrica23. Dado lo controvertido del tema, decidimos estudiar a 63 pacientes hipercalciúricas (9 con litiasis renal) y 50 mujeres normocalciúricas y evaluar la calciuria luego de corregido el nivel de 25 OH D en un corto período de seguimiento, teniendo en cuenta el pico de acción de la corrección de la 25 OH D. Los valores basales de 25 OH D no mostraron diferencias entre las hipercalciúricas y normocalciúricas, tal cual lo observado en The National Health and Nutrition Examination Survey III, 1988-94, evaluando la asociación entre 25 OH D y ne- frolitiasis24 o en el trabajo de Eisner y col.25 relacionando los niveles de 25 OH D y calciuria en pacientes con litiasis renal. En nuestro estudio, a diferencia de los previos, los valores basales de 25 OH D fueron similares, pero de ci- tarios en ambos grupos. Estos hallazgos fueron referidos por Elkoushy y col.26 en 80% de 101 sujetos con diferentes tipos de litiasis renal y fundamentalmente por Ticinesi y col.27 quienes encontraron dé cit de 25 OH D (< 20 ng/dl) en 884 pacientes con litiasis cálcica idiopática (56%), com- parando con 967 controles, en donde se observaron valores menores de 20 ng/dl de vitamina D en el 44%, p < 0.001.
No observamos diferencias signi cativas en la calciuria inicial y nal, luego de corregido el valor de 25 OH D, tanto en las pacientes hipercalciúricas como en las normocal- ciúricas. Sin embargo, encontramos en un 19% de las 63 pacientes hipercalciúricas un aumento signi cativo de la calciuria luego de corregida la 25 OH D y un 12% en las 50 normocalciúricas de las cuales dos incluso presentaron
valores compatibles con hipercalciuria. Un trabajo similar al nuestro fue realizado por Leaf y col.13 en 29 pacientes (70% varones) con nefrolitiasis, a los que se les realizó repleción de vitamina D y se evaluaron los cambios en la excreción de calcio urinario. En este trabajo se utilizó vita- mina D, como ergocalciferol en dosis de 50 000 UI/semana y control a las 8 semanas. La 25 OH D aumentó de 17 ± 6 ng/dl a 35 ± 10 ng/dl, p < 0.001, similar a nuestros 113 pacientes considerando los Grupos 1 y 2. La calciuria basal y nal no varió signi cativamente, al igual que en nuestros resultados, pero encontraron un subconjunto de pacientes 11/29 (38%) que aumentaron la calciuria ≥ 20 mg/d, con un aumento en la excreción de sodio urinario, que podría explicar la hipercalciuria. Nuestros porcentajes son simila- res, dado que con dosis mayores de vitamina D3 (100 000 UI mensuales) un 40% de las hipercalciúricas y un 44% de las hipercalciúricas con litiasis renal aumentaron la calciuria en forma signi cativa. Una diferencia sustancial fue que la excreción de sodio, en nuestra serie, no se modi có en ninguno de los grupos del valor basal.
Limitaciones del trabajo: no se incluyeron varones, dado el escaso número que pudimos seleccionar. No hubo una evaluación nutricional durante el desarrollo del trabajo. Tampoco se tuvo en cuenta la exposición al sol ni se aleatorizó el estudio de acuerdo a los niveles de vitamina D, sino que consideramos dé cit y/o insu ciencia a valores de 25 OH D < 30 ng/dl, a diferencia del artículo de Ferraro y col., en donde consideraron diferentes dosis e vitamina D y su relación con la aparición de litiasis renal25. Tampoco se administraron en todos los casos dosis similares de vitamina D, sino que el objetivo fue conseguir niveles de 25 OHD > 30 ng/dl. En el grupo de 63 hipercalciúricas solo 9 presentaron litiasis renal. En las pacientes que utilizaron dosis altas de vitamina D3, el escaso número di cultó hallar diferencias mayores.
En conclusión, nuestros resultados sugieren que la vitamina D, tanto ergocalciferol como colecalciferol, pue- den ser indicadas en pacientes normocalciúricas como hipercalciúricas con o sin litiasis renal, sin causar un aumento signi cativo de la calciuria luego de corregir el dé cit de 25 OH D. Sin embargo, es preciso destacar un subgrupo de individuos que pueden presentar aumentos signi cativos de la calciuria (≥ 30 mg/24 h), tanto en hipercalciúricas como normocalciúricas y especialmente en litiasis hipercalciúrica utilizando DMM de vitamina D, sin que se observen modi caciones en la excreción de sodio urinario. Los bene cios que implican conseguir un valor de 25 OH D > 30 ng/dl sobre la salud ósea, el aparato cardiovascular, la función musculo esquelética, la autoinmunidad y los riesgos neoplásicos, hacen que esta corrección sea indispensable. En de nitiva, es necesario vigilar estrictamente la calciuria al corregir el dé cit de vitamina D, especialmente con dosis mensuales, para no provocar aumentos de la misma que puedan favorecer la aparición de litiasis renal o afectar la masa ósea, en personas con predisposición genética.
Conflicto de intereses: Ninguno para declarar
Bibliografía
- Bischoff-Ferrari HA, Shao A, Dawson-Hughes B, Hathcock J, Giovannucci E, WillettWC. Bene t-risk assessment of vitamin D supplementation. Osteoporos Int 2010; 21: 1121-32.
- Soo Lim, Hayley Shin, Min Ju Kim, et al. Vitamin D inad- equacy is associated with signi cant coronary artery ste- nosis in a community-based elderly cohort: The Korean Longitudinal Study on Health and Aging. J Clin Endocrinol Metab 2012; 97: 169-78.
- Bouillon R, Bischoff-Ferrari H, Willett W. Vitamin D and health: perspectives from mice and man. J Bone Miner Res 2008; 23: 974-9.
- Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomized controlled trials. BMJ 2009; 339: b3692.
- Dawson-Hughes B, Harris SS, Krall EA, Dallal GE. Effect of calcium and vitamin D supplementation on bone density in men and women 65 years of age or older. N Engl J Med 1997; 337: 670-6.
- LeBoff MS, Kohlmeier L, Hurwitz S, Franklin J, Wright J, Glowacki J. Occult vitamin D de ciency in postmeno- pausal US women with acute hip fracture. JAMA 1999; 281: 1505-11.
- Pilz S, Dobnig H, Nijpels G, et al. Vitamin D and mortality in older men and women. Clin Endocrinol (Oxf) 2009; 71: 666-72.
- Giovannucci E, Liu Y, Rimm EB, et al. Prospective study of
predictors of vitamin D status and cancer incidence and
mortality in men. J Natl Cancer Inst 2006; 98: 451-9.
9. Gambaro G, Croppi E, Coe F, et al. Metabolic diagnosis and medical prevention of calcium nephrolithiasis and its systemic manifestations: a consensus statement. J
Nephrol 2016; 29: 715-34.
10. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus
vitamin D supplementation and the risk of fractures. N
Engl J Med 2006; 354: 669-83.
11. Taylor EN, Stampfer MJ, Curhan GC. Dietary factors and
the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol 2004; 15: 3225-32.
12. Penniston KL, Jones AN, Nakada SY, Hansen KE. Vitamin D repletion Does not alter urinary calcium excretion in healthy postmenopausal women. BJU Int 2009; 104: 1512-6.
13. Leaf DE, Korets R, Taylor RE, et al. Effect of vitamin D repletion on urinary calcium excretion among kidney stone formers. Clin J Am Soc Nephrol 2012; 7: 829-34.
14. Holick MF, Biancuzzo RM, Chen TC, et al. Vitamin D2 is as effective as vitamin D3 in maintaining circulating concentrations of 25-hydroxyvitamin D. J Clin Endocrinol Metab 2008; 93: 677-81.
15. Heath AK, Williamson EJ, Kvaskoff D, et al. 25-hydroxyvi- tamin D concentration and all-cause mortality: the Mel- bourne Collaborative Cohort Study. Public Health Nutr 2016; 29: 1-10.
16. Sempos CT, Durazo-Arvizu RA, Dawson-Hughes B, et al. Is there a reverse J-haped association between 25-hy- droxyvitaminD and all-cause mortality? Results from the US nationally representative NHANES. J Clin Endocrinol Metab 2013; 98: 3001-9.
17. Uusi-Rasi K, Patil R, Karinkanta S, et al. Exercise and vitamin D in fall prevention among older women: a randomized clinical trial. JAMA Intern Med 2015; 175: 703-11.
18. Tang J, Chonchol MB. Vitamin D and kidney stone disease. Curr Opin Nephrol Hypertens 2013; 22: 383-9.
19. Worcester EM, Coe FL. Clinical practice. Calcium kidney stones. N Engl J Med 2010; 363: 954-63.
20. Jarrar K, Amasheh RA, Graef V, Weidner W. Relationship between 1,25-dihydroxyvitamin- D, calcium and uric acid in urinary stone formers. Urol Int 1996; 56: 16-20.
21. Broadus AE, Insogna KL, Lang R, Ellison AF, Dreyer BE. Evidence for disordered control of 1,25-dihydroxyvitamin D production in absorptive hypercalciuria. N Engl J Med 1984; 311:73-80.
22. Ferraro PM, Taylor EN, Gambaro G, Curhan GC. Vitamin D intake and the risk of Incident kidney stones. J Urol 2017; 197: 405-10.
23. Netelenbos JC, Jongen MJM, van der Vijgh WJF, Lips P, van Ginkel FC. Vitamin D status in urinary calcium stone formers. Arch Intern Med 1985; 145: 681-4.
24.Tang J, McFann KK, Chonchol MB. Association between serum 25-hydroxyvitamin D and nephrolithiasis: The National Health and Nutrition Examination Survey III, 1988-94. Nephrol Dial Transplant 2012; 27: 4385-9.
- Eisner BH, Thavaseelan S, Sheth S, Haleblian G, Pareek G. Relationship between serum vitamin D and 24-hour urine calcium in patients with nephrolithiasis. Urology 2012; 80: 1007-10.
- Elkoushy MA, Sabbagh R, Unikowsky B, Andonian S. Prevalence and metabolic abnormalities of vitamin D- inadequate patients presenting with urolithiasis to a ter- tiarystone clinic. Urology 2012; 79: 781-5.
- Ticinesi A, Nouvenne A, Ferraro PM, et al. Idiopathic calcium nephrolithiasis and hypovitaminosis D: a case- control study. Urology 2016; 87: 40-5.
