ALEJANDRO ARAGONA, ALEJANDRO SODERINI, HORACIO MOSCHEN, EVANGELINA BONAVIA, ROSA GARRIDO, NICASIO CUNEO
Servicio de Ginecología Oncológica, Hospital Municipal de Oncología María Curie, Sede de la Carrera de
Especialista en Ginecología Oncológica, Facultad de Medicina, Universidad de Buenos Aires, Argentina
Resumen El cáncer cérvico-uterino, fiel indicador de inequidad social, sigue siendo un grave problema de salud pública en la República Argentina. Se suele afirmar que su frecuencia en mujeres jóvenes es baja y que las más expuestas son aquellas mayores de 35 años. Sin embargo, como ginecólogos oncólogos, con frecuencia acompañamos a morir a mujeres jóvenes que no han tenido acceso a tamizaje ni a tratamiento oportuno y adecuado del cáncer invasor. Esto ha motivado el presente análisis de frecuencia y supervivencia del cáncer cérvico-uterino en el contexto demográfico de las mujeres asistidas en el hospital de referencia en cáncer ginecológico de Buenos Aires. De los 748 casos analizados retrospectivamente (2007-2011), el 84.0% (n = 627) residía en el Área Metropolitana de Buenos Aires y el 76.9% (n = 576) fue admitido en estadios loco-regionalmente avanzados. El 53.6% (n = 401) presentó un diámetro tumoral > 4 cm y el 24.2% (n = 181) > 6 cm. Las tasas más bajas de supervivencia se observaron en tumores > 6 cm y en el subgrupo etario < 35 años. Tanto el tamaño tumoral como la edad conservaron su valor pronóstico tras ser ajustados en el análisis multivariado. En el subgrupo < 35 años, el 48% (n = 70) murió durante los 5 años siguientes al diagnóstico y la probabilidad de sobrevivir otros 5 años fue < 50%. Estos resultados representan una alerta sanitaria sobre la situación de mujeres jóvenes con cáncer cérvico-uterino en el Área Metropolitana de Buenos Aires, la cual concentra casi un tercio de la población del país.
Palabras clave: cáncer cérvico-uterino, tamaño tumoral, pronóstico, alerta sanitaria, HPV
Abstract High mortality for cervical cancer in young women from the Metropolitan Area of Buenos Aires. he cervical cancer, which is a reliable indicator of social inequality, remains a major public health issue in Argentina. It is generally accepted that its frequency among young women is low, being the most exposed those over 35 years old. Nevertheless, as gynecologic oncologists, we have been accompanying young patients to their death, mostly women with neither access to screening strategies nor timely or suitable treatment. Such a situation motivated the present analysis of our data on frequency, survival, and demography of cervical cancer collected at the referral cancer hospital of Buenos Aires City. Of 748 cases retrospectively assessed (2007-2011), 84.0% (n = 627) resided in the Metropolitan Area of Buenos Aires; 76.9% (n = 576) were admitted at a locoregionally advanced stage. Regarding tumor size, 53.6% (n = 401) had tumors > 4 cm diameter and 24.2% (n = 181) > 6 cm. The lowest rates of disease-free survival and cause-specific survival were observed for tumor sizes > 6 cm and the age subgroup < 35 years old. Both tumor size and age retained their prognostic value after multivariate analysis adjustment. When focusing in patients under 35 years old, 48% (n = 70) died within 5 years following diagnosis and their probability of surviving 5 years more was < 50%. These figures raise a public health alert on young women with cervical cancer living in the Metropolitan Area of Buenos Aires, which concentrates almost one third of the country population.
Key words: cervical cancer, tumor size, prognosis, public health alert, HPV
Recibido: 16-IV-2018 Aceptado: 19-VII-2018
Dirección postal: Dr. Alejandro Aragona, Hospital Oncológico María Curie, Av. Patricias Argentinas 750, 1405 Buenos Aires, Argentina
e-mail: contacto@alejandroaragona.com
Históricamente asociado a pobreza y bajo nivel socio-cultural, el cáncer cérvico-uterino (CCU) es la neoplasia que refleja con mayor precisión la inequidad en materia de salud. En la actualidad, el alto riesgo de CCU se ha extendido a la clase media debido a cambios de hábitos sociales y sexuales, persistencia de barreras culturales y la preocupante diseminación del virus del papiloma humano (HPV)1. Cualquiera sea el estrato social involucrado, el CCU refleja el fracaso de la salud pública y la inacción del Estado en el control de una enfermedad de transmisión sexual que es prevenible y en teoría erradicable. Lamentablemente, la posibilidad de la erradicación resulta remota en el contexto actual de nuestra región.
Se ha afirmado, incluso en publicaciones oficiales de nuestro país, que la frecuencia de CCU en mujeres jóvenes es baja y que son las ≥ 35 años las más expuestas a la enfermedad2-4. De hecho, las infecciones por HPV son transitorias y de regresión espontánea en > 90% de los casos debido a la respuesta inmune del huésped4, 5. Esto, sumado a la lenta progresión natural de la infección hacia el cáncer (10-20 años) en el porcentaje restante4, 6, son los principales argumentos que justifican dicha aseveración. Sin embargo, no se ha hecho referencia alguna al pronóstico de aquellas mujeres < 35 años cuando el CCU ya está instalado. Como ginecólogos oncólogos, con frecuencia hemos acompañado a morir a mujeres jóvenes sin acceso a programas de prevención secundaria y tratamiento oportuno del cáncer. El objetivo del presente estudio es el análisis de frecuencia y supervivencia de diferentes presentaciones clínicas del CCU, en el contexto demográfico de la población asistida en el hospital de referencia en cáncer ginecológico de la Ciudad Autónoma de Buenos Aires (CABA).
Materiales y métodos
Se recurrió al registro de mujeres con diagnóstico de CCU invasor efectuado entre el 01/01/2007 y el 31/12/2011, admitidas en la Sección Ginecología del Hospital Oncológico María Curie, dependiente del Gobierno de la CABA. A tal efecto, fueron revisados los registros internos de la Sección, las historias clínicas, la base de datos de admisión y los registros de anatomía patológica. El proyecto contó con el aval del comité de docencia e investigación y el comité de ética en investigación del hospital. La población objeto de estudio fue dividida con criterio demográfico, de acuerdo al domicilio de residencia a partir del cual la paciente había consultado, ya fuera en forma primaria o luego de ser admitida en otro centro de salud. Esta última situación pudo deberse a derivaciones formales efectuadas desde hospitales de menor nivel de complejidad o por propia voluntad de la paciente. Se destaca que fue tenido en cuenta el domicilio de residencia real surgido del interrogatorio durante la consulta. Esto obedece a que, en no pocas ocasiones, personas domiciliadas fuera de la CABA, al momento de la apertura de la historia clínica declaran un domicilio falso o perteneciente a otra persona. Si residía en la Provincia de Buenos Aires, se consignó el municipio o partido de procedencia, diferenciando los comprendidos en la denominada Región Metropolitana de Buenos Aires (RMBA). Esta última comprende la zona urbana común que conforman la CABA junto con 40 municipios de la Provincia de Buenos Aires (Almirante Brown, Avellaneda, Berazategui, Berisso, Brandsen, Campana, Cañuelas, Ensenada, Escobar, Esteban Echeverría, Exaltación de la Cruz, Ezeiza, Florencio Varela, General Las Heras, General Rodríguez, General San Martín, Hurlingham, Ituzaingó, José C. Paz, La Matanza, Lanús, La Plata, Lomas de Zamora, Luján, Marcos Paz, Malvinas Argentinas, Moreno, Merlo, Morón, Pilar, Presidente Perón, Quilmes, San Fernando, San Isidro, San Miguel, San Vicente, Tigre, Tres de Febrero, Vicente López y Zárate)7. Por Área Metropolitana de Buenos Aires (AMBA) o Gran Buenos Aires (GBA) se entiende a la CABA y los 24 partidos del GBA que la rodean (también denominados Conurbano Bonaerense)8, 9. Las definiciones antes detalladas se mantendrán a lo largo del texto.
Las siguientes variables clínicas fueron consideradas en el análisis estadístico: (i) edad: la muestra fue dividida en grupos quinquenales (15-19; 20-24; 25-29… >80) para el análisis de frecuencias y en 3 grupos (< 35, 35-59 y ≥ 60) para comparaciones estadísticas; (ii) tipo y grado histológico: por tratarse de un hospital monovalente en oncología, todos los diagnósticos efectuados fuera del mismo fueron sometidos a revisión de preparados histológicos según ordenanza municipal 286/83 y se aplicó la última clasificación de la Organización Mundial de la Salud y la Agencia Internacional de Investigación sobre el Cáncer (IARC, del inglés International Agency for Research on Cancer)10; (iii) examen pelviano recto-vaginal realizado sistemáticamente por al menos dos ginecólogos oncólogos del servicio a fin de establecer el tamaño tumoral clínico, la existencia o no de compromiso parametrial/vaginal y el estadio clínico de la enfermedad. La estadificación clínica se realizó según la clasificación vigente de la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) establecida en 2009, con la metodología recomendada para países con alta prevalencia de la enfermedad11. Los casos diagnosticados antes de 2009 fueron re-estadificados de acuerdo a esta clasificación. Fueron clasificados en estadios iniciales (IA-IB1-IIA1), loco-regionalmente avanzados (IB2-IIA2-IIB-III-IVA) y avanzados a distancia (IVB). La asociación con estado grávido-puerperal fue definida como el diagnóstico de CCU efectuado durante el embarazo o dentro de los 12 meses a partir del nacimiento/aborto. La evolución clínica se expresó como supervivencia por causa específica y supervivencia libre de enfermedad, ambas calculadas a los 5 años y definidas como el tiempo en meses transcurrido desde la fecha del diagnóstico (tiempo 0) hasta el óbito o la recidiva/progresión de la enfermedad. La fecha del diagnóstico es aquella en la cual se obtuvo certeza histológica de CCU invasor. Con excepción de las enfermas que presentaron en sus historias clínicas el evento definido como “progresión/recidiva” o el evento “óbito”, así como también aquellas perdidas del seguimiento y por lo tanto interpretadas estadísticamente como “datos censurados”, todas las pacientes presentaron 5 años completos de seguimiento, momento a partir del cual fueron desestimadas del análisis. Las muertes atribuibles a una causa diferente al CCU invasor fueron tratadas como observaciones censuradas12. Dadas la extensión del contenido y las potenciales conclusiones resultantes, el análisis de variables quirúrgico-patológicas fue diferido para un próximo análisis, focalizando el presente estudio en las variables clínicas de relevancia epidemiológica para el CCU antes enumeradas.
El análisis estadístico de las curvas de supervivencia se realizó mediante el método de Kaplan-Meier13. Para la comparación entre los subgrupos se recurrió a la prueba de Log-Rank (Mantel-Cox)14. Para indagar el efecto independiente sobre la función de supervivencia se empleó el modelo multivariado de los riesgos proporcionales (regresión de Cox)15. Un valor de p < 0.05 fue considerado estadísticamente significativo. Se utilizó el paquete estadístico IBM® SPSS® Statistics (versión 21).
Resultados
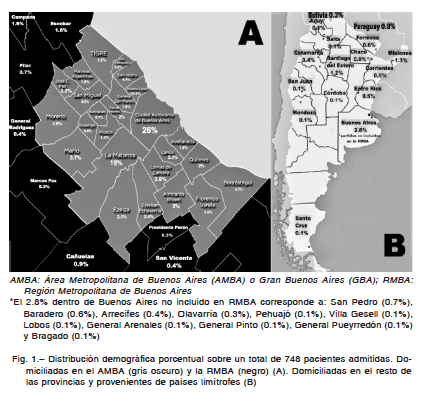
De las 748 pacientes incluidas en el estudio, 84% (n = 627) residía en el AMBA. Dicho porcentaje ascendió a 90% (n = 673) al considerar los 16 partidos restantes de la Provincia de Buenos Aires que conforman la RMBA. Ninguna tenía domicilio en el denominado Gran La Plata (partidos de La Plata, Berisso y Ensenada). El 2.8% (n = 21) residía en partidos de la Provincia de Buenos Aires no incluidos en la RMBA, el 6.1% (n = 46) provenía de otras provincias del país y el 1.1% (n = 8) de países limítrofes (0.8% Paraguay, 0.3% Bolivia) (Fig. 1).
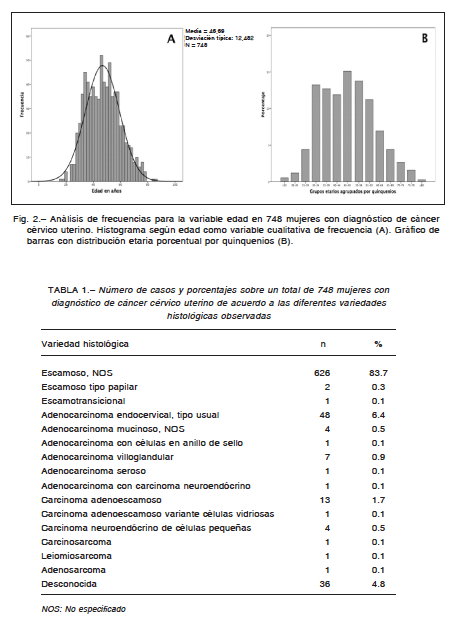
La media y la mediana de edad coincidieron en 46 años (rango 16-85) (Fig. 2). La media de seguimiento fue 35 meses y la mediana 38 (rango 0-60, desvío típico 23.8). La distribución porcentual de estirpes histológicas se presenta en la Tabla 1.
Al considerar el total de la cohorte, la supervivencia libre de enfermedad y la supervivencia por causa específica resultaron 55.5% y 59.3% respectivamente, y el 76.9% (n = 576) de los casos correspondía a estadios loco-regionalmente avanzados. Se observó diferencia significativa solo para las variables edad (por grupos) y tamaño tumoral clínico. El 53.6% (n = 401) presentó tumores con diámetros de > 4 cm y el 24.2% (n = 181) > 6 cm. Los valores más bajos de supervivencia libre de enfermedad y supervivencia por causa específica correspondieron a los subgrupos de tamaño tumoral clínico > 6-8 cm (29.0%, 34.4%) y > 8-10 cm (16.2%, 28.0%). En el análisis comparativo (por parejas sobre los estratos) no encontramos diferencia significativa entre tumores ≤ 2 vs. > 2-4 cm (p = 0.073), > 6-8 vs. > 8-10 cm (p = 0.804) y > 8-10 vs. > 10 cm (p = 0.117). Por el contrario, existió diferencia significativa entre tumores > 2-4 vs. > 4-6 cm y > 4-6 vs. > 6-8 cm (p = < 0.001 en ambos casos). El siguiente valor más bajo de supervivencia por causa específica se presentó en el grupo etario < 35 años (48.3%) (Fig. 3), el cual representó el 19.4% (n = 145) del total para la variable edad. El 48% (n = 70) de las pacientes de dicho grupo presentó el evento muerte; esto representa el 27% del total de muertes para dicha variable (35-59 años: 58%; ≥ 60 años: 15%). El patrón de supervivencia libre de enfermedad y supervivencia por causa específica según grupos etarios para cada variable, se presenta en detalle en la Tabla 2.
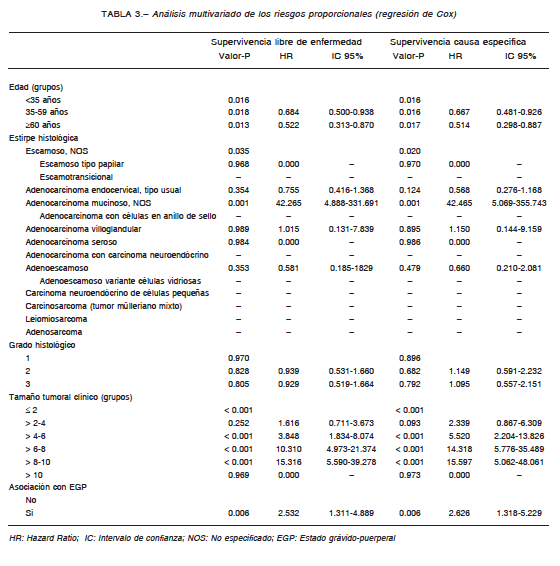
En el examen multivariado, las variables edad y tamaño tumoral conservaron su valor pronóstico al ser “ajustadas” por el resto de las variables clínicas (Tabla 3). Tomando como referencia el grupo etario < 35 años, las pacientes en el grupo 35-59 años presentaron un riesgo de muerte del 33%, es decir, probabilidad de morir 67% menor con respecto al grupo de referencia. En las ≥ 60 años, el riesgo de muerte fue 48% con respecto al grupo de referencia. Las pacientes con tamaño tumoral clínico > 4 cm presentaron 5.2 (> 4-6 cm), 14.3 (> 6-8 cm) y 15.6 (> 8-10 cm) veces más riesgo de morir que aquellas con tamaño tumoral ≤ 4 cm.
Discusión
Quien aborda la problemática del CCU en la Argentina con una perspectiva epidemiológica advierte que no existe a la fecha un registro de alcance federal. La información disponible de nuestra región está registrada en la base de datos GLOBOCAN, una iniciativa del IARC, que a su vez depende de la Organización Mundial de la Salud. GLOBOCAN ha basado sus estimaciones de incidencia en nuestro país en datos de seis registros regionales de base poblacional (Bahía Blanca, Concordia, Córdoba, Mendoza, Tierra del Fuego y Santa Fe) correspondientes al periodo 2003-200716. Estos registros cubren el 12% de la población del país y cuyas últimas estimaciones disponibles proyectadas para el año 2012 informaban 4956 nuevos casos y 2127 muertes por CCU17.

El Hospital Oncológico María Curie, ubicado en el barrio porteño de Caballito, recibe mayormente residentes del conurbano bonaerense. Así es como el conurbano aportó el 58% (n = 432) de nuestra muestra. En segundo lugar, se ubicó la CABA con el 26% (n = 195). El AMBA -con una superficie total de 2590 km2 y 12.8 millones de habitantes- concentra el 32% de la población total del país y es uno de los aglomerados urbanos más extensos del mundo18. Los restantes 16 partidos de la Provincia de Buenos Aires que completan la RMBA (10 695 km2, solo 2 millones de habitantes19) contribuyeron con el 6.2% de nuestra muestra. De este modo, queda expuesto este problema de salud pública focalizado en el AMBA, el cual presenta características demográficas y epidemiológicas únicas. El 77% de su población reside en el Conurbano Bonaerense (9.9 millones de habitantes), del cual, a su vez, el 43% carece de cobertura de salud (en contraste con el 16% de los residentes de la CABA)20. Dicha heterogeneidad podría justificar, en parte, el flujo de mujeres con CCU del conurbano hacia el hospital oncológico de referencia de la CABA. Del interrogatorio se desprende que dicho fenómeno se debe a la búsqueda de un centro especializado en oncología ante la ausencia de un equivalente en el municipio de residencia (ya sea por derivación formal o visita de “segunda opinión”) y/o la falta de respuestas en el primer y segundo nivel de atención sanitaria del subsistema público. El 1.1% (n = 8) de las mujeres consultaron directamente desde países limítrofes, correspondiendo el 0.8% a mujeres de nacionalidad paraguaya y el 0.3% restante a pacientes de nacionalidad boliviana.
En cuanto a las variedades histológicas del CCU, tanto la frecuencia como los valores de supervivencia observados en las cuatro estirpes predominantes –carcinoma escamoso, carcinoma adenoescamoso, adenocarcinoma variante endocervical tipo usual y adenocarcinoma villoglandular– coincidieron con datos disponibles en la literatura21, 22. También en coincidencia con estudios previos23, el adenocarcinoma villoglandular, que representó apenas el 0.9% (n = 7) de nuestra muestra, fue la estirpe de mejor pronóstico. En cuanto al sistema de gradación histológica, diversos autores han observado que no juega un papel importante en el pronóstico del CCU24, 25.
Entre los factores pronósticos clínicos considerados en la estadificación FIGO (Federación Internacional de Ginecología y Obstetricia), y, por ende, en la conducta terapéutica a adoptar, existe acuerdo en que el tamaño tumoral representa una variable de trascendental importancia. Sin embargo, el valor a considerar como punto de corte es aún motivo de debate26-35. En nuestro estudio, más de 7 de cada 10 mujeres fueron admitidas en un estadio avanzado y la proporción de los tumores denominados en la actualidad “bulky” (> 4 cm), es ampliamente superior a la de las series que han definido, y aún definen, los estándares de tratamiento, incluso cuando ninguna de ellas refleja experiencias de países en vías de desarrollo36-38. En nuestro estudio, el cambio más drástico se observó en pacientes con tamaño tumoral clínico > 6 cm: en este subgrupo la supervivencia por causa específica cayó bruscamente del 65 al 34.4% y las chances de muerte fueron 9 veces superiores a las del subgrupo con tumores de 4-6 cm. Se manifiesta aquí el concepto de “masa tumoral crítica”, es decir, el tumor > 6 cm, identificado como el principal factor pronóstico clínico adverso. Pacientes con esta característica representan cerca del 25% (n = 181) de la población estudiada. Coincidimos con recientes publicaciones de autores japoneses en que debe considerarse una nueva estrategia terapéutica para los tumores >6 cm, dado que es probable que dicho valor represente el punto de corte en cuanto a eficacia de las terapéuticas actualmente recomendadas, puntualmente en lo respectivo al límite de eficacia del tratamiento de quimio-radiación concurrente34, 35.
Datos de la Dirección de Estadísticas e Información de Salud (DEIS) para el quinquenio 2007-2011 indican que, tanto en la CABA como en el resto del país, el aumento más significativo en las tasas de mortalidad especificas por edad ocurre a partir de los 35 años, con un pico máximo entre los 50-54, y que la mortalidad es despreciable en menores de 2539, 40. A partir de datos suministrados por la DEIS para 2005 se ha informado que, en Argentina, el 6% del total de muertes por CCU ocurre en menores de 35 años. Dicho valor contrasta fuertemente con el 27% informado por nosotros en el AMBA41. Es probable que tal disparidad guarde relación con el alto porcentaje de muertes por CCU sin especificar y mal definidas que ofrecen las estadísticas vitales16, 41, 42. Se remarca enfáticamente la ausencia de publicaciones oficiales o provenientes de grupos de trabajo hospitalarios sobre supervivencia de mujeres con CCU en nuestro país, datos que serían particularmente útiles en aquellas regiones donde existe acceso diferencial a los servicios de salud42-44. Nuestro análisis revela que la probabilidad de las mujeres menores de 35 años de estar vivas a los 5 años del diagnóstico de CCU es menor al 50%. La literatura de Norteamérica, Europa y Asia referida a este tópico no arroja evidencia concluyente acerca de la influencia de la edad al momento del diagnóstico del CCU sobre su pronóstico45-50. Los autores consideran que la posibilidad de comenzar el tamizaje en edades más tempranas que las actuales o de una mayor frecuencia del mismo como parte de la actual política sanitaria debe permanecer como motivo de discusión y debate. En cualquier caso, el CCU en edades tempranas conlleva implícito el dilema de la mujer joven aún no madre o con deseos insatisfechos de maternidad. La expresión límite de este verdadero flagelo socio-cultural51 es una de las asociaciones más escalofriantes observada en la praxis médica: la coexistencia de CCU con embarazo o puerperio, la que ocurrió el 3% de las participantes de nuestro estudio.
Comprendemos las limitaciones de los estudios de base hospitalaria en cuanto al sesgo que conlleva el análisis estadístico de una muestra incompleta de la población. No obstante, consideramos que nuestro trabajo presenta ciertas fortalezas. En primer lugar, a diferencia de las conclusiones extraídas a partir de estadísticas vitales, nuestro análisis no presenta error debido a causas de muertes mal definidas o necesidad de reasignación de las defunciones por cáncer de útero de sitio no especificado: la causa de muerte se consignó por comprobación directa, evitando las inexactitudes inherentes a la baja calidad de la información aportada por los certificados de defunción en nuestro país42. De hecho, los datos de la región colectados mediante estadísticas vitales han sido considerados “de baja calidad” incluso por la propia IARC16. En segundo lugar, los lugares de residencia presentados son exactos porque corresponden al domicilio real de cada una de las participantes en el estudio. En tercer lugar, es el primer trabajo científico realizado en el país sobre supervivencia en CCU y fue elaborado con datos propios sobre una población relativamente homogénea de bajos recursos económicos y socio-culturales, usuaria del subsistema de salud pública. En cuarto lugar, la metodología empleada es considerada la más útil para describir tendencias de supervivencia porque permite un seguimiento de 5 años calendarios de la cohorte, es decir, la totalidad del periodo de análisis. Todo esto adquiere mayor trascendencia aún si se considera que el único centro participante es el hospital de referencia en cáncer de la CABA.
Las conclusiones aquí vertidas no son extrapolables a países con economías avanzadas ni a poblaciones con mayor tasa de detección de CCU en estadios iniciales o de menor tamaño tumoral. Históricamente, hemos basado nuestros esfuerzos para mejorar la supervivencia de nuestras pacientes en recomendaciones provenientes de países “líderes de opinión” en la materia, aun cuando las características clínicas de las mujeres que diariamente asistimos guardan poca o ninguna similitud con las de esos países.
Finalmente, es nuestra convicción que el abordaje del CCU como una mera dolencia individual debe cambiar. El cambio de paradigma necesario implica concebirlo como una verdadera enfermedad social, cuya completa comprensión aún permanece lejana en la escala de prioridades de nuestra sociedad.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Soderini A, Cuneo N. Ninguna mujer debería morir por cáncer de cuello uterino (Editorial). Rev Soc Obstet Ginecol B Aires 2013; 993: 91-3.
2. Ministerio de Salud de la Nación. Guía Programática Abreviada para la prevención del cáncer cérvico uterino. Programa Nacional de Cáncer Cérvico Uterino, 2010. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000433cnt-Guia_Programatica_Abreviada_BAJA.pdf; consultado diciembre 2017.
3. Instituto Nacional del Cáncer, Ministerio de Salud de la Nación. Prevención del cáncer cérvico-uterino: recomendaciones para el tamizaje, seguimiento y tratamiento de mujeres en el marco de programas de tamizaje basados en el test de VPH [actualización 2015]. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000017cnt-manual_recomendaciones_tamizaje_2015_baja.pdf; consultado diciembre 2017.
4. Arrossi S, Thouyaret L, Curotto M, Paolino M, Cuberli M, Laudi R. Manual para la implementación del test de VPH en contexto programático. Instituto Nacional del Cáncer, 1a edición, 2016. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000906cnt-2016-11-08-manual-para-la-implementacion-test-vph-en-contexto-programatico.pdf; consultado noviembre 2017.
5. Picconi MA. Detección de virus papiloma humano en la prevención de cáncer cérvico uterino. Medicina (B Aires) 2013; 73: 585-96.
6. Schiffman M, Castle PE. The promise of global cervical cancer prevention. N Engl J Med 2005; 353: 2101-4.
7. Subsecretaría de Urbanismo y Vivienda, Dirección Provincial de Ordenamiento Urbano y Territorial. Lineamientos estratégicos para la región metropolitana de Buenos Aires, 2007. En: https://www.mininterior.gov.ar/planificacion/pdf/planes-reg/Lineamientos-Estrategicos-para-la-Region-Metropolitana-de-Buenos-Aires.pdf, consultado octubre 2017.
8. Ministerio de Economía y Producción, Instituto Nacional de Estadística y Censos (INDEC). ¿Qué es el Gran Buenos Aires?, agosto de 2003 [versión revisada en 2005]. En: https://www.indec.gov.ar/nuevaweb/cuadros/1/folleto%20gba.pdf; consultado el 21/12/2017.
9. Unidad de Proyectos Especiales para el Área Metropolitana de Buenos Aires ¿Qué es AMBA? En: http://www.buenosaires.gob.ar/gobierno/unidades%20de%20proyectos%20especiales%20y%20puerto/que-es-amba; consultado diciembre 2017.
10. Kurman RJ, Carcangiu ML, Herrington CS, Young RH, editors. WHO classification of tumours of female reproductive organs. Volume 6. 4ta ed. Lyon, Francia: International Agency for Research on Cancer; 2014.
11. Pecorelli S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet 2009; 105: 103-4.
12. Begg CB, Schrag D. Attribution of deaths following cancer treatment. J Natl Cancer Inst 2002; 94: 1044-5.
13. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53: 457-81.
14. Peto R, Peto J. Asymptotically efficient rank invariant test procedures. J Royal Statist Society 1972; A135: 185-207.
15. Cox DR, Oakes D. The analysis of survival data. London: Chapman and Hall, 1984.
16. WHO. International Agency for Research on Cancer. GLOBOCAN 2012: estimated Cancer Incidence. Mortality and Prevalence Worldwide in 2012. En: http://globocan.iarc.fr/old/method/method.asp?country=032; consultado noviembre 2017.
17. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 11. Lyon, France: International Agency for Research on Cancer; 2013. En: http://globocan.iarc.fr; consultado el 15/08/2017.
18. Instituto Nacional de Estadística y Censos (INDEC). Censo nacional de población, hogares y viviendas 2010: censo del Bicentenario: resultados definitivos, Serie B nº 2, 1a edición, Buenos Aires, 2012. En: https://www.indec.gob.ar/ftp/cuadros/poblacion/censo2010_tomo1.pdf; consultado mayo 2018.
19. Fernández L. Censo 2010: Somos 14.819.137 habitantes en la región metropolitana de Buenos Aires. Argentina: Instituto del Conurbano-Universidad Nacional de General Sarmiento, 2011. En: https://es.scribd.com/document/62693576/Censo-2010-Somos-14-819-137-habitantes-en-la-Region-Metropolitana-de-Buenos-Aires; consultado mayo 2018.
20. de la Torre L. Heterogeneidades sociales en la Región Metropolitana de Buenos Aires: un sistema fragmentado que demanda planificación y coordinación de políticas metropolitanas. Observatorio de la Deuda Social Argentina, Buenos Aires: Pontificia Universidad Católica Argentina, 1a edición, Educa, 2013. En: http://www.buenosaires.gob.ar/sites/gcaba/files/heterogeneidades_sociales_en_la_region_metropolitana.pdf; consultado mayo 2018.
21. Shingleton HM, Bell MC, Fremgen A, et al. Is there really a difference in survival of women with squamous cell carcinoma, adenocarcinoma, and adenosquamous cell carcinoma of the cervix? Cancer 1995; 76 (10 Suppl): 1948-55.
22. Alfsen GC, Kristensen GB, Skovlund E, Pettersen EO, Abeler VM. Histologic subtype has minor importance for overall survival in patients with adenocarcinoma of the uterine cervix: a population-based study of prognostic factors in 505 patients with nonsquamous cell carcinomas of the cervix. Cancer 2001; 92: 2471-83.
23. Fujiwara K, Monk B, Devouassoux-Shisheboran M. Adenocarcinoma of the uterine cervix: Why is it different? Curr Oncol Rep 2014; 16: 416.
24. Zaino RJ, Ward S, Delgado G, et al. Histopathologic predictors of the behavior of surgically treated stage IB squamous cell carcinoma of the cervix. Cancer 1992; 69: 1750-8.
25. Baalbergen A, Ewing-Graham PC, Hop WC, Struijk P, Helmerhorst TJ. Prognostic factors in adenocarcinoma of the uterine cervix. Gynecol Oncol 2004; 92: 262-7.
26. Piver MS, Chung WS. Prognostic significance of cervical lesion size and pelvic node metastases in cervical carcinoma. Obstet Gynecol 1975; 46: 507-10.
27. Perez CA, Grigsby PW, Nene SM, et al. Effect of tumor size on the prognosis of carcinoma of the uterine cervix treated with irradiation alone. Cancer 1992; 69: 2796-806.
28. Kawagoe T, Kashimura M, Matsuura Y, Sugihara K, Toki N, Aoki T. Clinical significance of tumor size in stage IB and II carcinoma of the uterine cervix. Int J Gynecol Cancer 1999; 9: 421-6.
29. Nakanishi T, Ishikawa H, Nawa A, et al. The significance of tumor size in clinical stage IB cervical cancer: Can a cut-off figure be determined? Int J Gynecol Cancer 2000; 10: 397-401.
30. Kodaira T, Fuwa N, Kamata M, et al. Clinical assessment by MRI for patients with stage II cervical carcinoma treated by radiation alone in multicenter analysis: Are all patients with stage II disease suitable candidates for chemoradiotherapy? Int J Radiat Oncol Biol Phys 2002; 52: 627-36.
31. Kim TE, Park BJ, Kwack HS, Kwon JY, Kim JH, Yoon SC. Outcomes and prognostic factors of cervical cancer after concurrent chemoradiation. J Obstet Gynaecol Res 2012; 38: 1315-20.
32. Kudaka W, Nagai Y, Toita T, et al. Long-term results and prognostic factors in patients with stage III-IVA squamous cell carcinoma of the cervix treated with concurrent chemoradiotherapy from a single institution study. Int J Clin Oncol 2013; 18: 916-21.
33. Wagner AE, Pappas L, Ghia AJ, Gaffney DK. Impact of tumor size on survival in cancer of the cervix and validation of stage IIA1 and IIA2 subdivisions. Gynecol Oncol 2013; 129: 517-21.
34. Endo D, Todo Y, Okamoto K, Minobe S, Kato H, Nishiyama N. Prognostic factors for patients with cervical cancer treated with concurrent chemoradiotherapy: a retrospective analysis in a Japanese cohort. J Gynecol Oncol 2015; 26: 12-8.
35. Todo Y, Watari H. Concurrent chemoradiotherapy for cervical cancer: background including evidence-based data, pitfalls of the data, limitation of treatment in certain groups. Chin J Cancer Res 2016; 28: 221-7.
36. Barillot I, Horiot JC, Pigneux J, et al. Carcinoma of the intact uterine cervix treated with radiotherapy alone: a French cooperative study: update and multivariate analysis of prognostics factors. Int J Radiat Oncol Biol Phis 1997; 38: 969-78.
37. Rose PG. Chemoradiotherapy for cervical cancer. Eur J Cancer 2002; 38: 270–8.
38. Chemoradiotherapy for cervical cancer meta-analysis collaboration. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol 2008; 26: 5802-12.
39. Abriata MG, Roques L, Macías G, Loria D. Atlas de mortalidad por cáncer Argentina 2007-2011. 1ª edición, Buenos Aires: Instituto Nacional del Cáncer, Ministerio de Salud. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000869cnt-29-Atlas-de-mortalidadopt.pdf,consultado mayo 2018.
40. Kyung Min L, Macias G, Limardo L, Abriata MG. Atlas de mortalidad por cáncer. Ciudad de Buenos Aires, 2007-2011. 1ª edición, Buenos Aires: Instituto Nacional del Cáncer, Ministerio de Salud, 2015. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000001006cnt-2017-09-14-atlas-2007-2011.pdf, consultado mayo 2018.
41. Arrossi S, Paolino M. Proyecto para el mejoramiento del Programa Nacional de Prevención de Cáncer de Cuello Uterino en Argentina. Informe Final: Diagnostico de situación del Programa Nacional y Programas Provinciales. 1ª edición, Organización Panamericana de la Salud & Ministerio de Salud de la Nación, 2008. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000891cnt-2016-10-11-proyecto-para-mejoramiento-programa-nacional-prevencion-ccu.pdf; consultado noviembre 2017.
42. Fiorentino JA. Certificado médico de defunción. Es conveniente actualizar el tema y analizar las nuevas normativas propuestas para una nueva política mortuoria dentro del ámbito de la Ciudad de Buenos Aires. Actualización Intramed 03/03/2004. En: http://www.intramed.net/contenidover.asp?contenidoID=28397&pagina=4; consultado noviembre 2017.
43. Kogevinas M, Porta M. Socioeconomic differences in cancer survival: a review of the evidence. IARC Sci Publ 1997; (138): 177-206.
44. Bychkovsky BL, Ferreyra ME, Strasser-Weippl K, et al. Cervical cancer control in Latin America: A call to action. Cancer 2016; 122: 502-14.
45. Stanhope CR, Smith JP, Wharton JT, Rutledge FN, Fletcher GH, Gallager HS. Carcinoma of the cervix: the effect of age on survival. Gynecol Oncol 1980; 10: 188-93.
46. Clark MA, Naahas W, Markert RJ, Dodson MG. Cervical cancer: women aged 35 and younger compared to women aged 36 and older. Am J Clin Oncol 1991; 14: 352-6.
47. Popadiuk C, Stankiewicz A, Dickinson J, Pogany L, Miller AB, Onysko J. Mortality among Canadian women aged 15 to 29 and the impact of screening. J Obstet Gynaecol Can 2012; 34: 1167-76.
48. Sasieni P, Castanon A. Dramatic increase in cervical cancer registrations in young women in 2009 in England unlikely to be due to the new policy not to screen women aged 20-24. J Med Screen 2012; 19: 127-32.
49. Motoki Y, Mizushima S, Taguri M, et al. Increasing trends in cervical cancer mortality among young Japanese women below the age of 50 years: An analysis using the Kanagawa population-based Cancer Registry, 1975-2012. Cancer Epidemiol 2015; 39: 700-6.
50. Pelkofski E, Stine J, Wages NA, Gehrig PA, Kim KH, Cantrell LA. Cervical cancer in women aged 35 years and younger. Clin Ther 2016; 38: 459-66.
51. Aragona AM, Soderini AH, Cuneo NA, et al. Cáncer de cuello uterino durante el estado grávido-puerperal. Fundamentos clínico-quirúrgicos de un flagelo sociocultural. La experiencia del Hospital Oncológico de Buenos Aires. Rev Soc Obstet Ginecol 2014; 993: 2-26.
