MARÍA FERNANDA MODARELLI1, 2, OSVALDO J. PONZO1
1Laboratorio de Endocrinología, Instituto de Fisiología, Facultad de Medicina, Universidad de Buenos Aires, 2Centro Comunitario Privado Sanar 2000, Glew, Buenos Aires, Argentina
Resumen El hipotiroidismo subclínico (HS), elevación de tirotrofina con hormonas tiroideas normales, junto al bocio, aumentó la frecuencia en las últimas décadas. Con el objetivo de relacionar la prevalencia de bocio y HS con el consumo de agua subterránea como factor de riesgo etiológico poblacional, se analizaron 879 historias clínicas de un centro médico de Glew, en el conurbano bonaerense Sur. Se estudió la población según edad (20-60 y 12-19 años) y tipo de agua consumida (potabilizada o napa subterránea). El agua subterránea fue consumida por el 70.5% del grupo de 20 a 60 años (n = 559, 79.9% mujeres) y por el 66.3% del grupo de 12 a 19 años (n = 57, 81.4% mujeres). En el grupo de 20 a 60 años la prevalencia de HS en consumidores de agua potabilizada y subterránea fue del 1% y 57.8% (p < 0.0001) y la de bocio de 3.8% y 38.9% (p < 0.0001), respectivamente; con un riesgo atribuible al agua subterránea de 57% para HS y 35% para bocio. En el grupo de 12 a 19 años, la prevalencia de HS fue 6.9% y 52.6% (p < 0.0001) y de bocio 13.8% y 77.2% para los grupos de agua potabilizada y subterránea, (p < 0.0001) respectivamente; con un riesgo atribuible al agua subterránea de 46% para HS y 61% para bocio. El análisis fisicoquímico mostró presencia de nitratos (entre 24 y 83 mg/l) en aguas de pozos y ausencia en agua potable. La prevalencia aumentada de HS y bocio podrían deberse a la acción disruptora tiroidea de los nitratos.
Palabras clave: hipotiroidismo subclínico, bocio, disruptores endocrinos, aguas subterráneas
Abstract Relationship of subclinical hypothyroidism and goiter with the origin of water consumed by a population of the Buenos Aires suburbs. Subclinical hypothyroidism (SH), elevation of the level of thyrotrophin with normal thyroid hormones, along with goiter (glandular size > 25g), increased in recent decades. In order to relate the prevalence of goiter and SH with the consumption of groundwater, as a population etiological risk factor, we analyzed 879 clinical histories from a medical center in the city of Glew in the South Buenos Aires suburbs. The population was studied according to age (20 to 60 and 12 to 19 years) and type of water consumed (potable water or groundwater). Groundwater was consumed by 70.5% of the group from 20 to 60 years old (n = 559, 79.9% women) and by 66.3% of the group from 12 to 19 years old (n = 57, 81.4% women In the group of 20 to 60 years, the prevalence of SH in potable water and groundwater users was 1% and 57.8% (p < 0.0001) and the goiter rate of 3.8% and 38.9% (p < 0.0001) respectively; with an attributable risk to groundwater of 57% for HS, and 35% for goiter In the group of 12 to 19 years, the preva- lence of SH was 6.9% and 52.6% (p < 0.0001) and goiter 13.8% and 77.2% for the water and groundwater groups (p>0.0001) respectively, with an attributable risk of 46% for HS y 61% for goiter. The physicochemical analysis showed the presence of nitrates in the range of 24 to 83 mg/l in groundwater and absence in potable water. The increased prevalence of HS and goiter could be due to the thyroid disrupting action of nitrates.
Key words: subclinical hypothyroidism, goiter, endocrine disruptor, groundwater
Recibido: 23-III-2018 Aceptado: 11-X-2018
Dirección postal: Dr. Osvaldo Ponzo, Facultad de Medicina, Universidad de Buenos Aires, Paraguay 2155 Piso 7, 1121 Buenos Aires, Argentina
e-mail: oponzo@fmed.uba.ar
En las últimas dos décadas la frecuencia de presenta- ción de hipotiroidismo y bocio han aumentado. Se calcula que más de 2200 millones de personas están en riesgo de padecerlo, razón por la cual la OMS redujo el porcentaje de presentación necesario para considerarlo endemia del 10% al 5%1. Desde el punto de vista de la salud pública, se ha sugerido considerar zona endémica para bocio cuando la prevalencia de éste es por lo menos de grado 1b y no inferior al 5% en adolescentes, o de grado 1a y no inferior al 30% en adultos2. La frecuencia de presentación de las alteraciones tiroideas es tres veces mayor en mujeres, siendo el pico de incidencia entre los 30 y 50 años3.
El hipotiroidismo subclínico (HS) se caracteriza por elevación del nivel de tirotrofina (TSH) por encima de valores normales, con valores plasmáticos de triiodotiro- nina (T3) y tiroxina (T4) normales4, y ha surgido como una variante en la clasificación de las disfunciones tiroideas5, 6. Su prevalencia es del 1 a 10% pudiendo llegar a 20% en mujeres mayores de 60 años, con el posible subregistro de la enfermedad7. El aumento en los niveles plasmáticos de TSH lleva a una situación de hiperestimulación crónica de la glándula y a la generación de bocio. Por ello, se consideran los niveles plasmáticos de TSH ultrasensible como un marcador de riesgo, con una sensibilidad y espe- cificidad del 99%8, 9, siendo su rango normal de 0.45-4.50 mU/l y con una mediana de 1.40 mU/l10. Sin embargo, en un rango de 4.5 a 10 mU/l, la posibilidad de retorno de la TSH a los niveles séricos normales es alta11; siendo menor la probabilidad de detectar elevaciones transitorias cuanto más elevados son los niveles plasmáticos de esta hormona12.
La elevación de TSH en un rango considerado sub- clínico genera consecuencias en diversos sistemas. Se ha demostrado una correlación significativa entre un riesgo aumentado de eventos por enfermedad coronaria y mortalidad por enfermedad cardíaca con niveles de TSH mayores a 7mU/l, que se incrementa aún más con niveles mayores a 10mU/l13. Por otra parte, las mujeres con HS presentan una alteración en la composición bioquímica de la LDL, con mayor carga de triglicéridos, asociada a una reducción de la actividad de la enzima encargada de degradarlas, lo cual lleva a un mayor riesgo aterogénico (aun cuando el perfil lipídico-lipoproteico plasmático no demuestre cambios) siendo estas alteraciones reversibles con levotiroxina14.
La causa más frecuente de desarrollo de hipotiroidismo es el déficit de iodo15, 16 y la enfermedad autoinmune17,18. Sin embargo, se ha descripto el desarrollo de hipotiroi- dismo endémico en regiones sin déficit de iodo y sin que prevalezca la autoinmunidad tiroidea, lo cual indicaría la existencia de otros factores causales19-21. En la última década se ha dado gran importancia a la contaminación ambiental por sustancias con posible acción disruptora endocrina, como factores de riesgo etiológico para esta afección22, 23.
Un disruptor endocrino es un compuesto químico exógeno que una vez incorporado al organismo, altera la homeostasis hormonal interfiriendo la síntesis, se- creción, transporte, metabolismo, unión a su receptor y/o eliminación de las hormonas producidas por el sistema endocrino24. Los disruptores endocrinos se encuentran en plásticos, detergentes, surfactantes, pesticidas y productos químicos industriales, entre otros25. La exposición a estos disruptores endocrinos se produce a través de la ingesta en las comidas o agua contaminada con dichos compuestos26 acumu- lándose a veces en tejido adiposo, donde permanecen por largos períodos27.
Se ha descripto acción disruptora endocrina de nitritos, nitratos, percloratos, tiocianatos, bisfenoles, arsénico y compuestos orgánicos persistentes (COPs) que lleva- rían a cambios en la morfología y función de la glándula tiroidea28- 30.
Epidemiológicamente los disruptores endocrinos representan un factor de riesgo para la función tiroidea en poblaciones expuestas. Por ello, la cuantificación del riesgo es fundamental para la formulación de medidas preventivas. Nuestro objetivo fue analizar si la prevalencia de HS y bocio estaba aumentada en individuos residentes en la zona estudiada, con el consumo de aguas subte- rráneas no potabilizadas y probablemente contaminadas con disruptores endocrinos.
Materiales y métodos
Se realizó un estudio epidemiológico observacional descrip- tivo retrospectivo transversal. La información fue tratada en forma anónima por los profesionales involucrados en análisis de los datos. Los datos fueron recopilados por revisión de
1530 historias clínicas del Servicio de Medicina Familiar del Centro de atención médica Sanar 2000, de la ciudad de Glew en el sur del conurbano bonaerense. Esas historias clínicas corresponden a pacientes atendidos desde enero del 2003 hasta diciembre del 2012. Se excluyeron del estudio personas sin residencia permanente en la zona de estudio, así como los que se encontraban en tratamiento por hipotiroidismo y aquellos que usaban filtro de agua en su domicilio. Solo 879 historias clínicas presentaron la totalidad de datos necesa- rios para hacer el análisis estadístico. Posteriormente, esta muestra fue dividida para el análisis en dos grupos etarios: el primero de 20 a 60 años y el segundo de 12 a 19 años, ya que los valores de TSH plasmático para definir HS varían entre ambos grupos. Se definió hipotiroidismo subclínico utilizando valores plasmáticos de TSH mayores a 4.50 mUI/l en el grupo etario de 20 a 60 años y mayores a 3.59 mUI/l en el grupo de 12 a 19 años. Ambos grupos fueron divididos teniendo en cuenta el tipo de agua consumida: a) potabilizada (bidones de agua de mesa potabilizada), b) napas subterráneas obte- nidas de perforación que alcanzan en su mayoría el acuífero pampeano, es decir con una profundidad de 30 a 60 metros de profundidad con encamisados. El total de la población no cuenta con red cloacal de tratamiento de excretas ni agua potable de red.
Se consideraron las siguientes variables: edad, sexo, tipo de agua consumida, niveles plasmáticos de hormonas TSH, T4 y T3, así como presencia de bocio, considerándose como tal al aumento del tamaño glandular mayor a 25 g o una falange (usando el dedo pulgar), definido por ecografía o palpación respectivamente31. El rango de normalidad para valores plasmáticos fue TSH: 0.4 a 4.5 mUI/l, T4: 4.5 a 12.5 ng/dl y T3: 83 a 162 ng/dl en el grupo etario de 20 a 60 años32. En el grupo etario de 12 a 19 años, el rango fue: TSH 0.40 a 3.59 mUI/l, siendo los de T3 y T4 similares al otro grupo33. Las determinaciones hormonales se efectuaron por el método de quimioluminiscencia (ADVIA Centaur, equipo Siemens). Se analizó riesgo atribuible y la fracción de riesgo atribuible34.
Se efectuaron estudios fisicoquímicos del agua (conduc- tividad, sólidos disueltos, alcalinidad, dureza total, cloruros, sulfatos nitratos, nitritos, amoniaco y cromo) en diferentes pozos de la zona estudiada. Los métodos empleados para el análisis fueron los estipulados por código alimentario nacional, según normas de calidad para el agua de consumo humano. Para la recolección de las muestras se utilizaron bidones o botellas plásticas de 1 a 2 litros de capacidad, previamente enjuagados dos veces con el agua a analizar. Luego se limpió la boca de salida del grifo con un paño limpio, se dejó correr el agua unos 5 minutos, se enjuagó, llenó el envase y se tapó. Se rotularon las muestras en todos los casos identificando el sitio de extracción. Los envases se conservaron en un sitio fresco (heladera a 5 °C) hasta el momento del análisis (INTI, Buenos Aires). Los valores de referencia para agua de consumo humano fueron los de la Agencia de protección ambiental de EE.UU..
Para el análisis estadístico se utilizó el programa InStat (GraphPad, InStat1998, GraphPad Software, Inc., San Diego California USA). Se comprobaron los supuestos de normalidad por el test de Shapiro Wilk y homogeneidad de varianza por el test de Levene para el análisis de las determinaciones hor- monales tiroideas. Por otra parte, la comparación de medias se realizó utilizando el test no paramétrico Wilcoxon-Mann- Whitney. Para poder efectuar el análisis ANOVA de un factor, debido a las características propias del diseño se realizó un ajuste logarítmico de los datos, empleándose el post test de Tukey para evaluar las interacciones entre las variables analizadas. Para las variables presencia o ausencia de bocio se empleó el test de Fisher. En todos los casos se consideró un nivel de significancia de p < 0.05.
subclínico (p < 0.0001) (Fig. 2A). De los que consumían agua de napa subterránea y presentaron hipotiroidismo subclínico 258 fueron mujeres (79.9%) y 65 hombres (20.1%). Mientras en el grupo que consumió agua po- tabilizada las dos afectadas fueron mujeres. En este grupo etario, el número de pacientes con consumo agua de napa subterránea que presentaron TSH plasmática elevada fueron: entre 4.5 y 7 mUI/l: 128 (39.6%), entre 7 y 10 mUI/l: 72 (22.3%) y mayor a 10 mUI/l: 123 (38.1%). Mientras que en el grupo que consumió agua potabilizada hubo un caso con TSH de 4.5 a 7 mUI/l y otro con un valor mayor a 10 mUI/l. Del análisis del riesgo etiológico para el HS en este grupo etario se obtuvo que un riesgo atribuible de 0.57 (57%) con intervalo de confianza (IC) 95% (0.48,0.68) y la fracción de riesgo atribuible de 0.99 (IC 95%:0.88, 1.08) (p < 0.01). Respecto a los valores plasmáti- cos de las hormonas tiroideas T4 y T3 no se registraron diferencias significativas entre los dos grupos de consumo de agua (napa subterránea o potabilizada), encontrándose los valores dentro de los parámetros normales en ambos grupos: agua potabilizada T4: 8.3 ± 1.5 ng/dl y T3: 102.3 ± 7.5 ng/dl y agua de napa subterránea T4: 7.8 ± 1.6 ng/dl y T3: 122 ± 17 ng/dl. La prevalencia de bocio observada fue mayor (p < 0.0001) en el grupo que consumió agua de napa subterránea: 38.9% (n = 218, 165 mujeres), respecto a los que consumieron agua potabilizada: 3.8% (n = 9, 7 mujeres) (Fig. 3A). Con respecto a los presencia de bocio se obtuvo un riesgo atribuible de 0.35 (35%) con IC del 95% (0.29, 0.49) y una fracción atribuible de 0.97 (IC 95%: 0.86, 1.06) (p < 0.001).
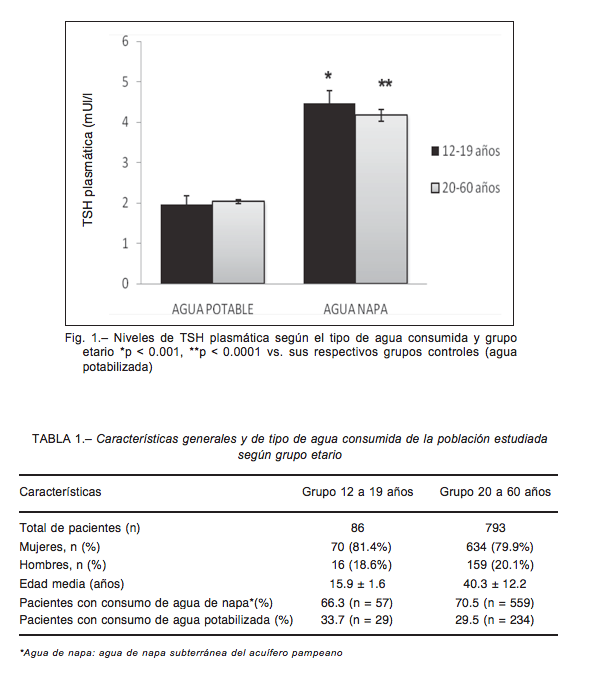
Del segundo grupo etario que comprendió de los 12 a 19 años, 57 personas consumieron agua de napas sub- terráneas y solo 29 tuvieron acceso al consumo de agua potabilizada. La prevalencia general de hipotiroidismo subclínico (TSH mayor a 3.59 mUI/l) fue de 37.2% (32 ca- sos). Esta prevalencia fue mayor en los que consumieron agua de napa subterránea: 52.6% (30 casos, 20 mujeres) respecto a los que consumieron agua potabilizada: 6.9% (2 casos, 1 mujer) (p < 0.0001) (Fig. 2B), siendo las medias de TSH plasmáticas 4.17 ± 0.32 y 2.04 ± 0.21 mUI/l, respectivamente (p < 0.001) (Fig.1). El número de individuos que consumiendo agua de napa subterránea presentaron TSH elevadas entre 3.59 y 7: 21 (65.6%), entre 7 a 10 mUI/l: 8 (25.0%) y con valores mayores a 10 mUI/l: 3 (9.4%). En el grupo de HS que consumió agua potabilizada hubo 1 caso con TSH entre 3.59 y 7.0 mUI/l y uno con TSH mayor a 10 mUI/l. Del análisis del riesgo etiológico para el HS en este grupo etario se obtuvo que el riesgo atribuible fue de 0.46 (46%) con IC 95% (0.42, 0.63) y la fracción de riesgo atribuible que fue igual 0.93 (IC 95%: 0.82, 1.02) (p < 0.001). La prevalencia de bocio fue en el grupo que consumió agua de napa subterránea: 77.2% (44 casos, 39 mujeres) y agua potabilizada: 13.8% (4 casos, 3 mujeres) (p < 0.0001) (Fig. 3B). Del análisis casos de bocio subclínico se obtuvo un riesgo atribuible de 61% con IC 95% (0.67, 0.84) y una fracción de riesgo atribuible de 0.96 (IC 95%: 0.85, 1.05) para el grupo que consume agua subterránea (p < 0.001).
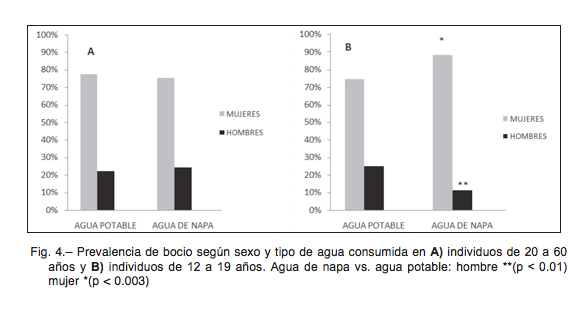
Al analizar la prevalencia de bocio según sexo y tipo de agua consumida, se observó un aumento de porcentaje de mujeres afectadas en el grupo etario de 12 a 19 años ante el consumo de agua de napa subterránea (Fig. 4B). El riesgo atribuible para este grupo ante el consumo de agua de napa fue de 0.30 (30%) con IC 95% (0.16, 0.48) y fracción de riesgo atribuible de 0.54 (IC 95%: 0.46, 0.62) (p < 0.01). No se observó esta diferencia (relación porcen- tual mujer/hombre) en el grupo de 20 a 60 años (Fig. 4A).
Finalmente, en el análisis físico-químico de las muestras de agua se observó que la concentración de nitratos fue de 24 mg/l en la muestra proveniente de los pozos más profundos y de 83 mg/l en las muestras provenientes de los pozos más superficiales. Ambas muestras tuvieron niveles de nitratos superiores a 20 mg/l, valor estipulado (2 casos, 1 mujer) (p < 0.0001) (Fig. 2B), siendo las medias de TSH plasmáticas 4.17 ± 0.32 y 2.04 ± 0.21 mUI/l, respectivamente (p < 0.001) (Fig.1). El número de individuos que consumiendo agua de napa subterránea presentaron TSH elevadas entre 3.59 y 7: 21 (65.6%), entre 7 a 10 mUI/l: 8 (25.0%) y con valores mayores a 10 mUI/l: 3 (9.4%). En el grupo de HS que consumió agua potabilizada hubo 1 caso con TSH entre 3.59 y 7.0 mUI/l y uno con TSH mayor a 10 mUI/l. Del análisis del riesgo etiológico para el HS en este grupo etario se obtuvo que el riesgo atribuible fue de 0.46 (46%) con IC 95% (0.42, 0.63) y la fracción de riesgo atribuible que fue igual 0.93 (IC 95%: 0.82, 1.02) (p < 0.001). La prevalencia de bocio fue en el grupo que consumió agua de napa subterránea:
77.2% (44 casos, 39 mujeres) y agua potabilizada: 13.8% (4 casos, 3 mujeres) (p < 0.0001) (Fig. 3B). Del análisis casos de bocio subclínico se obtuvo un riesgo atribuible de 61% con IC 95% (0.67, 0.84) y una fracción de riesgo atribuible de 0.96 (IC 95%: 0.85, 1.05) para el grupo que consume agua subterránea (p < 0.001).
Al analizar la prevalencia de bocio según sexo y tipo de agua consumida, se observó un aumento de porcentaje de mujeres afectadas en el grupo etario de 12 a 19 años ante el consumo de agua de napa subterránea (Fig. 4B). El riesgo atribuible para este grupo ante el consumo de agua de napa fue de 0.30 (30%) con IC 95% (0.16, 0.48) y fracción de riesgo atribuible de 0.54 (IC 95%: 0.46, 0.62) (p < 0.01). No se observó esta diferencia (relación porcen- tual mujer/hombre) en el grupo de 20 a 60 años (Fig. 4A).
Finalmente, en el análisis físico-químico de las muestras de agua se observó que la concentración de nitratos fue de 24 mg/l en la muestra proveniente de los pozos más profundos y de 83 mg/l en las muestras provenientes de los pozos más superficiales. Ambas muestras tuvieron niveles de nitratos superiores a 20 mg/l, valor estipulado por la EPA como límite de seguridad para el consumo humano (Tabla 2).
Discusión
El hipotiroidismo subclínico se caracteriza por elevación del nivel plasmático de TSH acompañado de valores normales de T4 y T3, que puede coexistir o no con la presencia de bocio. La prevalencia a nivel mundial es del 5% al 10%35, siendo su diagnóstico y tratamiento de gran importancia para evitar el compromiso sistémico que conlleva36. La relación mujer/hombre de 7:3 observada en nuestro trabajo coincide con la prevalencia del HS descripta por otros autores, siendo el pico de incidencia en el sexo femenino entre los 30 y 50 años37.
La población estudiada corresponde a un área sin déficit de iodo38-40. En dicha región no ha sido aún descripto un factor que se relacione con el aumento de prevalencia de bocio e HS por nosotros observados. Hace más de dos décadas Perinetti41 mencionó la existencia de causas de bocio endémico no relacionadas con la deficiencia de iodo. Otros autores postulan a la contaminación am- biental como factor predisponente para el desarrollo de hipotiroidismo y bocio en las poblaciones expuestas a estas condiciones42. Un ejemplo de esto es el empleo de diversos tipos de plaguicidas en la fumigación de campos, que actúan como disruptores endocrinos en múltiples ejes hormonales, incluido el tiroideo43.
La zona de estudio del presente trabajo cuenta con más de 50 000 habitantes (censo 2001) que carecen de redes de agua potable y cloacales. Por otra parte, se encuentra un importante parque industrial con fábricas de diversos productos a una distancia de 15 kilómetros hacia el Noreste de la ciudad.

en la región noroeste y suroeste de la ciudad de Buenos Aires los valores de nitratos mayores a 45 ppm parecen derivar de vertidos de barrios del conurbano carentes de servicios cloacales56. Esto ha sido observado en otras regiones a nivel nacional e internacional57- 59.
La erradicación del bocio endémico y el HS es de suma importancia médica y social en nuestro país60, así como en otros 61, 62, debido a que altas tasas de prevalencia de los mismos generan un alto costo en salud a largo plazo63. Por ello es fundamental implementar medidas preventivas de saneamiento ambiental tendientes a disminuir la con- centración de todo potencial disruptor endocrino en aguas subterráneas empleadas para consumo humano64. Para ello, es necesario un adecuado y constante monitoreo de las concentraciones de contaminantes en los acuíferos de los cuales se nutren diversas ciudades del conurbano, así como el tendido de redes cloacales y agua potable en las zonas con un riesgo etiológico poblacional elevado.
Agradecimientos: Este trabajo fue apoyado por el Subsidio de la Universidad Buenos Aires: UBACYT20020130100439BA
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Miranda Gómez O, Álvarez Pérez AE, Guerrero Riopedre SM, Pacheco Rodríguez MD. Bocio endémico difuso. Rev Cub Med Mil 2008; 37:1-6.
2. De Maeyer EM, Lowenstein FW, Thilly CH. Organización Mundial de la Salud (OMS). La lucha con- tra el bocio endémico,1978. En: apps.who.int/iris/bit- stream/10665/40112/1/9243560603_spa.pdf; consultado noviembre 2017.
3. Zárate A, Basurto L, Saucedo R, Hernández Valencia M.
Enfermedad tiroidea: un tema de revisión constante por el ginecólogo, por su frecuencia en las mujeres. Ginecol Obstet Mex 2009; 77: 96-102.
4. Biondi B, Cooper DS. The clinical significance of subclinical thyroid dysfunction. Endocr Rev 2008; 29: 76-131.
5. Cooper DS, Fatourechi V. Subclinical hypothyroidism: Anupdate for primary care physicians. Mayo Clin Proc 2009;
84: 65-71.
6. Wilson GR, Curry RW Jr. Subclinical thyroid disease. AmFam Physician 2005; 72: 1517-24.
7. Yanes Quesada M. Disfunción tiroidea subclínica. Rev Cub Endocrinol 2012; 23: 221-4.
8. Gharib H, Tuttle RM, Baskin HJ, Fish LH, Singer PA, McDermott MT. Subclinical thyroid dysfunction: a joint statement on management from the American Associa- tion of Clinical Endocrinologists, the American Thyroid Association and The Endocrine Society. Thyroid 2005; 90: 581-5.
9. Helfand M, Redfern CC. Clinical guideline. Part 2. Screen- ing for thyroid disease: an update. American College of Physicians. Ann Intern Med 1998; 129: 144-58.
10. Hollowell JG, Staehling NW, Flanders WD, et al. Serum TSH, T4, and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002; 87: 489-99.
11. Diez JJ, Iglesias P, Burman KD. Spontaneous normalization of thyrotropin concentrations in patients with subclini- cal hypothyroidism. J Clin Endocrinol Metab 2005; 90: 4124-7.
12. Huber G, Staub JJ, Meier C, et al. Prospective study of the spontaneous course of subclinical hypothyroidism: prog- nostic value of thyrotropin, thyroid reserve, and thyroid antibodies. J Clin Endocrinol Metab 2002; 87: 3221-6.
13. Rodondi N, den Elzen WP, Bauer DC, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA 2010; 304: 1365-74.
14. Dunta L. H. and Brenta G. A Renewed focus on the association between thyroid hormones and lipid. Front
Endocrinol 2018; 9: 1-10.
15. Zimmermann MB, Jooste PL, Pandav CS. The iodine deficiency disorders. Lancet 2008; 372: 1251-62.
16. The National Academy of Clinical Biochemistry (NACB).
Guía de consenso para el diagnóstico y seguimiento de la enfermedad tiroidea. Parte III. Acta Bioquím Clín Latinoam 2007; 41: 87-119.
17. Baloch Z, Carayon P, Conte-Devolx B, et al. Laboratory medicine practice guidelines. Laboratory support for the diagnosis and monitoring of thyroid disease. Thy- roid 2003; 13: 3-126.
18. Weetman AP. Autoimmune thyroid disease. Autoimmunity 2004; 37: 337-40.
19. Diamanti-Kandarakis E, Bourguignon JP, Giudice LC, et al. Endocrine-disruption chemicals: an Endocrine Society scientific statement. Endocr Rev 2009; 30: 293-342.
20. Pignatta AB, Bollada PN, Campi VC, Andrada I, Niepomniszcze H. Probable rol de bociógenos ambientales en una localidad de la provincia de Catamarca, Argentina. Gland Tir Paratir 2009; 18:16-20. En: www.revistatiroi- des.com.ar/Revistas/18/RevGlan-Art2-6.pdf; consultado noviembre 2017.
21. Pistelli A, Foddis R, Guglielmi G, Bonotti A, Cristaudo A. Prevalence of thyroid disease in healthcare workers occu- pationally exposed to ionizing radiation at the University Hospital of Pisa. G Ital Med Lav Ergon 2012; 34: 280-2.
22. Schmutzler C, Gotthardt I, Hofmann PJ, et al. Endocrine disruptors and the thyroid gland – A combined in vitro and in vivo analysis of potential new biomarkers. Environ Health Perspect 2007; 115: 77-83.
23. Leung AM, Braverman LE, He X, et al. Environmental perchlorate and thiocyanate exposures and infant serum thyroid function. Thyroid 2012; 22: 938-43.
24. Azaretzky M, Ponzo OJ, Viale ML, et al. Disruptores endo- crinos: Guía de reconocimiento, acción y recomendacio- nes para el manejo médico. Rev Arg Endocrinol Metab2018; 55: 89-98.
25. Soldin OP, Braverman LE, Lamm SH. Perchlorate clinical pharmacology and human health: a review. Ther Drug Monit 2001; 23: 316-31.
26. Zewdie T, Smith CM, Hutcheson M, West CR. Basis of the Massachusetts reference dose and drinking water standard for perchlorate. Environ Health Perspect 2010; 118: 42-8.
27. Argota Pérez G, Argota Coello H, Iannacone J. Exposición bioacumulativa a metales pesados en Gambusia punctata y Gambusia puncticulata del ecosistema Almendares, La Habana, Cuba. The Biologist (Lima) 2014; 14: 339-50. En: revistas.unfv.edu.pe/index.php/rtb/article/view/109; consultado noviembre 2017.
28. Chiappini FA. Efecto del hexaclorobenceno sobre la regu- lación del crecimiento de células foliculares tiroideas. Estudios in vivo e in vitro. Tesis Doctoral. Biblioteca Digital FCEN-UBA2012, p 1-180. En: https://www. digital. bl.fcen.uba.ar; consultado diciembre 2012.
29. Crofton KM, Craft ES, Hedge JM, et al. Thyroid hormone disrupting chemicals: evidence for dose-dependent ad- ditivity or synergism. Environ Health Perspect 2005; 113: 1549-54.
30. Colborn T, vom Saal FS, Soto AM. Developmental effects of endocrine-disrupting chemicals in wildlife and humans. Environ Health Perspect 1993; 101: 378-84.
31. Organización Panamericana de la Salud, Organización Mundial de la salud. Reducción del consumo de sal en la población. Foro de la OMS sobre la Reducción del Consumo de Sal en la Población. París, Francia. Octubre
5 al 7 de 2006. En: http://www.who.int/dietphysicalactivity/ salt-report-SP.pdf; consultado enero 2018.
32. Díez JJ. Hipotiroidismo subclínico. Endocrinol Nutr 2005; 52: 251-9.
33. Blount BC, Pirkle J.L, Osterloh JD, Valentin-Blasini L Caldwell KL. Urinary perchlorate and thyroid hormone levels in adolescents and adult men and women living in the United States. Environ Health Perspect 2006; 114:
1865-71.
34. Pita Fernández S, Vila Alonso MT, Carpente Montero J.Determinación de factores de riesgo. Cad Aten Primaria 1997; 4: 75-8.
35. Andersson M, Takkouche B, Egli I, Allen HE, de Benoist B. Current global iodine status and progress over the last decade towards the elimination of iodine deficien- cy. Bull WHO 2005; 83: 518-25. En: http://www.who.int/ bulletin/volumes/83/7/518.pdf; consultado enero 2018.
36. Surks MI, Ortiz E, Daniels GH, et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA 2004; 291: 228-38.
37. Quirantes Moreno A, Mesa Rosales B, Quirantes Hernández A. Hipotiroidismo subclínico en mujeres adultas atendidas por exceso de peso corporal. Rev Cub Endocrinol 2015; 26: 246-53.
38. FAO. Perfiles Nutricionales por Países. Organización de las Naciones Unidas para la Agricultura y la Alimentación. Argentina. Enero 2001, p 1-37. En: https://www.bvsde. paho.org/texcom/nutricion/ARGmap.pdf; consultado junio 2017.
39. Salvaneschi J, García J. La endemia bocio cretínica en la República Argentina. Rev Asoc Med Arg 2014; 127: 27-9.
40. Salvaneschi J, García J. El bocio endémico en la República Argentina: Antecedentes, extensión y magnitud de la en- demia, antes y después del empleo de la sal enriquecida con yodo. Rev Arg Endocrinol Metab 2009; 46: 48-58.
41. Perinetti H, Borremans C. Patología Tiroidea. Compendio (3era ed). Universidad Nacional de Cuyo. Facultad de Medicina, 2000, Cap. 10, p 68-525.
42. Colborn T. Clues from wildlife to create an assay for thyroid system disruption. Environ Health Perspect 2002; 110: 363-7.
43. Générations Futures ONG. Exppert 8. Evaluación de la calidad del agua del grifo con respecto a los plaguicidas en 2014. Ministerio francés de Asuntos Sociales y de Salud 2016. En: https://www.bioecoactual.com; consul- tado junio 2017.
44. Tolcachier AJ. Salud Ambiental. Biblioteca Virtual Intramed. Roemmers. Cap. Contaminación del Agua 2009; 1:1-10. En: https://www.intramed.net/84535; consultado octubre
2017.
45. Comisión para la Cooperación Ambiental. Sustancias químicas tóxicas y salud infantil en América del Norte: planteamiento sobre la necesidad de un despliegue de esfuerzos para determinar las fuentes, niveles de exposición y riesgos de las sustancias químicas indus- triales para la salud infantil. Montreal. Departamento de Comunicación y Difusión Pública del Secretariado de la CCAC, Mayo 2006, p 1-96. En: https://www.cec.org; consultado octubre 2017.
46. Colombo JC, Khalil MF, Arnac M, Horth AC, Catoggio JA.
Distribution of chlorinated pesticides and individual poly- chlorinated biphenyls in biotic and biotic compartments of the Río de la Plata, Argentina. Environl Sci Technol 1990; 24: 498-505.
47. Greenpeace. Napas Contaminadas. Cuenca Matanza Riachuelo. Estudio de potabilidad de agua de pozos. Campaña Tóxicos/Riachuelo, 2009. En: https://www. greenpeace.org › Inicio › Informes; consultado octubre 2017.
48. Janiot L. Estudio de Impacto Ambiental y Saneamiento de la cuenca de los A° San Francisco y Las Piedras,
3° etapa 2000, p 1-75. En: https://www.geoeducar.files. wordpress.com/2015; consultado octubre 2017.
49. FREPLATA, 2006. Transboundary Diagnostic Analysis: Synthesis for Policymakers. Technical Report FREPLA- TA. Environmental Protection of the Río de la Plata and its Maritime Front. Pollution Prevention and Control, and Habitat Restoration. UNDP/GEF/RLA/99/G31. En: https:// iwlearn.net/…/5410cdb3482ad8e93e76bd42239f5f58; consultado marzo 2018.
50. Zang F, Degitz SJ, Holcombe GW, et al. Evaluation of gene expression endpoints in the context of a Xenopus laevis metamorphosis-based bioassay to detect thyroid hormone disruptors. Aquat Toxicol 2006; 76: 24-36.
51. Alea Reyes ME, Carballo Hondal O, Trujillo Herández J, Torres Alemán MA. Toxicidad aguda del herbicida químico glifosan en larvas de la rana cubana: Osteopilus septentrionalis. Retel 2008. En: https://www.sertox.com. ar/retel); consultado marzo 2018.
52. Modarelli MF, Carbone S, Samaniego YA, Ponzo OJ. Acción disruptora endócrina del agua de napa sobre la metamorfosis del Xenopus laevis y su utilidad como bioensayo. Medicina (B Aires) 2014; 74 (Supl III): 94.
53. Muck P, Cantera J, Brazeiro A, et al. Análisis diagnostico transfronterizo del Rio de la Plata y su frente marítimo. FREPLATA. Reducción y Prevención de la contaminación de origen terrestre en el Río de la Plata y su Frente Marítimo mediante la implementación del Programa de Acción Estratégico de FREPLATA.Contaminantes en Agua, Sedimentos y Biota. Aportes de Contaminantes al Río de la Plata. 2001, p 1-34.
54. Camargo JA, Alonso A. Contaminación por nitrógeno inorgánico en los ecosistemas acuáticos: problemas medioambientales, criterios de calidad del agua, e im- plicaciones del cambio climático. Ecosistema 2007; 16:
98-110.
55. Holland E, Braswell B, Sulzman J, Lamarque J. Nitrogen deposition onto the United States and Western Europe: synthesis of observations and models. Ecolog Appl 2005; 15: 38-57.
56. Auge M. Hidrogeología de la Ciudad de Buenos Aires.
Facultad de Ciencias Exactas y Naturales. Departamento Ciencias Geológicas Cátedra Hidrogeología, UBA. 2004, p 1-81. En: https://www.sedici.unlp.edu.ar; consultado octubre 2016.
57. Beron E, Morando J, Morrone Oca L. Estudio de las causas de la Endemia de bocio en niños de una zona rural de San Juan con iodurias normales. Rev Argent Endocrinol Metab 2004; 41: 144-51.
58. Fares Taie A, Sarlo G, Agote Robertson M, et al. Estudio sobre la posible causa de bocio endémico en una zona de la ciudad de Mar del Plata. Rev Argent Endocrinol Metab 2004; 41: 74-7.
59. Townsend A, Howarth R, Bazzaz F, et al. Human health
