LUIS E. VOYER 1, CAUPOLICÁN ALVARADO 2
1Comité de Docencia e Investigación, 2Servicio de Nefrología. Hospital Pedro de Elizalde, Asociado a la Facultad de Medicina, UBA
Resumen La cocción de los alimentos a altas temperaturas en calor seco, produce ciertas modificaciones organolépticas que los hace especialmente apetecibles y objetos de adicción. Esto es resultado de la reacción de Maillard, o glicación, que se produce por unión no enzimática del grupo carbonilo, de azúcares reductores como glucosa y fructosa, con el grupo amino de proteínas y ácidos nucleicos. Junto a los cambios físicos, cambia la estructura química y la función de estos aductos, denominados también glicotoxinas. Además de la glicación exógena, generada durante la cocción de los alimentos, recientemente ha sido referida la glicación in situ, en la luz intestinal, durante la digestión, cuando determinados alimentos no glicados se combinan en el momento de su ingestión. A esto se agrega la glicación endógena extracelular relacionada con la glucosa sanguínea y la intracelular, con metabolitos de la glucólisis y de la fructosa. Desde la década del 70, con el remplazo en gran medida de la sacarosa por fructosa, significativamente más reactiva que la glucosa, aumentó la presencia de productos de glicación en alimentos procesados y bebidas gaseosas. Están documentados sus efectos patogénicos como contribuyentes al estrés oxidativo y a la inflamación, especialmente en diabetes, insuficiencia renal y enfermedad cardiovascular y están siendo explorados en otras enfermedades crónicas, como procesos neurodegenerativos y envejecimiento temprano. Se describen medidas para preservar la salud, atendiendo medios de cocción y procesamiento de los alimentos y recomendaciones sobre hábitos de vida e ingesta de antioxidantes para acción inhibitoria o antagónica sobre las glicotoxinas.
Palabras clave: reacción de Maillard, glicación, glicotoxinas, estrés oxidativo
Abstract Maillard reaction. Pathogenic effects. Certain organoleptic modifications by way of processing and cooking foods at high temperatures in dry heat, make them especially appetizing and objects of addiction. It results from Maillard reaction, or glycation, consisting of the non-enzymatic union between carbonyl groups, mainly from reducing sugars as glucose and fructose, with the amino group of proteins and nucleic acids. In addition to physical changes, also the chemical structure and function of these compounds are changed. Besides exogenous glycation generated during the cooking of foods, recently in situ glycation has been reported in the intestinal lumen during digestion, when certain non-glycated foods are combined with fructose at the time of ingestion. In addition, endogenous glycation, which correlates in the extracellular mainly with blood glucose and in the intracellular with glycolysis metabolites and fructose, is specially significant. Since the 70s, with the frequent sucrose replacement by fructose, much more reactive than glucose, the presence of glycation products in processed foods and soft drinks increased.Pathogenic effects of these compounds, also called glycotoxins, are known to contribute to oxidative stress and inflammation. This increases progression of chronic diseases, well documented in diabetes, renal insuficiency, cardiovascular disease and aging process, and are being explored in many other chronic diseases as neurodegenerative disorders and early aging. Based on the knowledge achieved so far, measures to preserve health are described by attending ways of cooking and processing foods, besides recommendations for life habits and antioxidants dietary intakes for inhibition or antagonism on glycotoxins.
Key words: Maillard reaction, glycation, glycotoxins, oxidative stress
Dirección postal: Luis E. Voyer, Ramallo 2050, 1429 Buenos Aires, Argentina
e-mail: drvoyer@email.com
La glicación o reacción de Maillard 1, consiste en la unión no enzimática del grupo carbonilo, principalmente de aldehídos o cetonas de azúcares reductores, como la glucosa y la fructosa, con el grupo amino de proteínas o ácidos nucleicos. Los grupos carbonilos también se generan en la degradación por oxidación de los lípidos. La glicación está directamente relacionada a la concentración y al tiempo de contacto de las sustancias referidas y es fuertemente acelerada a elevadas temperaturas con baja humedad (calor seco). A temperaturas superiores a 100/120 °C y más aún, 140 °C, se aprecia una acelerada generación de estos productos en variados alimentos. Esto ocurre en parrilla, horno, plancha o frituras y es facilitado por el pH alcalino, el cobre y el hierro. Por esto aumenta con la cocción en ollas de estos materiales, y con adición de bicarbonato de sodio, práctica utilizada a veces en la elaboración de dulce de leche con el fin de lograr por glicación un color más oscuro que el de la caramelización.
La glicación es motivo de interés en gastronomía, pues es la responsable del tostado con variables tonalidades de marrón por compuestos pardos denominados melanoidinas, lo que junto a los atractivos cambios de sabor y aroma en los que intervienen también numerosos productos derivados de la oxidación de los lípidos 2, hace especialmente apetecible alimentos como carnes asadas, medialunas y papas fritas.
En 1976 se observó que en la hemoglobina, normalmente una fracción está en forma de hemoglobina glicada (HbA) mal llamada hemoglobina glucosidada, fracción que está aumentada en diabéticos, en relación a los niveles de glucemia. Esto despertó gran interés en la clínica para control del tratamiento en la diabetes 3.
La glicación genera tres tipos de productos: compuestos inestables y reversibles denominados “bases de Schiff”, compuestos más estables, potencialmente reversibles, denominados “productos de Amadori”, y compuestos irreversibles denominados “productos finales de glicación avanzada” (AGE, por Advanced Glycation End-products).
Los productos de glicación originados del catabolismo lipídico, se denominan “productos finales de lipooxidación avanzada” (ALE, por Advanced Lipooxidation Endproducts 4.
Los productos de glicación pueden ser medidos en sangre, orina y tejidos por métodos diversos, como enzimoinmunoensayo, anticuerpos mono y policlonales, autofluorescencia, cromatografía, o espectrometría de masas, que es el método más sensible 5.
La carboximetil-lisina es el AGE más estudiado, al igual que los precursores muy reactivos como glioxal y metilglioxal 5.
El consumo de alcohol en exceso, a través de su metabolito acetaldehído, y en especial cerveza negra y licores ricos en azúcar, pueden ser importantes contribuyentes en la generación de AGE 6.
Los productos de glicación son retenidos en diversos órganos y tejidos, o son parcialmente desactivados, originándose productos de segunda generación que se excretan por orina 7, 8.
La glicación, de interés en la gastronomía por hacer más apetecibles algunos alimentos, es de gran interés en la clínica desde la observación que una fracción normalmente glicada de la hemoglobina se incrementa en los diabéticos en relación a la hiperglucemia y de que productos de glicación, además de ser parcialmente desactivados y excretados, son también retenidos en diversos órganos y tejidos.
Glicación exógena. El papel de la fructosa
La glicación exógena corresponde a la dieta y se refiere a los AGE como dAGE (AGE dietético). Siempre se consideró que se genera principalmente y, casi en forma exclusiva, durante la cocción de los alimentos. Recientemente se observó que un alimento no glicado, como la ovoalbúmina, ingerido junto a jugo de manzanas, determina elevaciones de productos de glicación en suero y orina. Esto es interpretado como glicación enteral, in-situ en la luz intestinal, con la consecuente absorción de los aductos.
En modelos simulados de digestión gastrointestinal de ovoalbúmina en presencia de fructosa, que es mucho más reactiva que la glucosa, se comprueba la formación de AGE. Esto es inhibido en un alto porcentaje por el ácido clorogénico, principal compuesto fenólico de la yerba mate, Ilex paraguariensis, acción tan potente como la de la aminoguanidina, conocido inhibidor de glicación 9-12.
La glicación exógena se genera en los alimentos durante la cocción, pero también puede originarse en la luz intestinal por acción de la fructosa sobre fuentes alimentarias proteicas.
Glicación endógena
La glicación endógena se produce en condiciones fisiológicas, en pequeñas cantidades durante el metabolismo, tanto fuera como dentro de las células. La extracelular resulta de la interacción de la glucosa sanguínea con las proteínas plasmáticas y, consecuentemente, aumenta en la hiperglucemia. La fructosa no desempeña mayor papel pues su concentración en el suero no supera el 1% de la glucemia, pero es importante en la glicación intracelular. En la intracelular, los metabolitos de la glucólisis, desde glucosa-6-fosfato y los precursores dicarboxílicos, glioxal y metilglioxal, tienen actividad reactiva para la glicación 13.
La especial significación de la fructosa está en que, además de ser significativamente más reactiva que la glucosa, su concentración intracelular aumenta no solo con la ingesta, sino con elevaciones de la glucemia, que activa la aldosa reductasa, generadora de fructosa a partir de la glucosa 13.
La glicación endógena ocurre fuera de las células en relación a la glucemia y dentro de las células en relación a los metabolitos de la glucólisis y a los niveles de fructosa.
Efectos patogénicos
Por tener efectos potencialmente adversos para la salud, los productos de glicación son también denominados “glicotoxinas”. Son moléculas muy reactivas, actúan como dadores de electrones en la generación de radicales libres, lo que puede llevar al estrés oxidativo, factor relevante de daño celular que, además, aumenta la glicación endógena.
Los AGE activan receptores específicos (RAGE, por Receptor Advanced Glycation Endproducts)14 y citoquinas proinflamatorias como interleuquina 1 o interleuquina 6, factor de necrosis tumoral a, factor insulínico de crecimiento 1 y proteína C reactiva (PCR). Esto altera la permeabilidad y vitalidad de las membranas celulares. La interacción AGE-RAGE parece mediar la mayoría de los efectos biológicos, incluida la generación de radicales libres, y cerrar así un círculo vicioso.
Los radicales libres también estimulan la activación de plaquetas con promoción de trombosis. Contribuyen la vasoconstricción por síntesis de óxido nítrico disminuída en el músculo liso de las paredes vasculares y el incremento de inhibición del plasminógeno, compuesto fibrinolítico primordial.
La acción proinflamatoria y la promoción de trombosis y ateroesclerosis, son causantes de daño orgánico, principalmente en el hígado, riñón, cerebro, cristalino y tejido conectivo, especialmente de la piel, los cartílagos y los tendones 4.
AGE y proteínas plasmáticas o de órganos y tejidos en formas reticuladas, cross links, interactúan con RAGE localizados en superficies endoteliales especialmente del colágeno, con enfermedad micro y macrovascular, pérdida de flexibilidad y movilidad articular.
La alteración de proteínas estructurales en el tejido conectivo interfiere la diferenciación de osteoblastos para remodelación ósea y lleva a fragilidad esquelética 15.
A través de una serie de reacciones, se producen alteraciones de la estructura química de las proteínas, con aminoácidos que han perdido su normal conformación tridimensional, lo que altera sus funciones con potenciales efectos patogénicos. También pueden alterarse los ácidos nucleicos transformados en aductos, que pueden sufrir depurinación y consiguiente deleción o mutación 16.
Se ha observado disminución en la actividad enzimática de la bomba de calcio, calmodulina y superóxido dismutasa y aumento en la actividad de la aldosa reductasa. Al verse afectada la superóxido dismutasa, se incrementa el efecto nocivo de los radicales libres con alteración de la permeabilidad de membranas celulares, lo que junto a la afectación de la calmodulina y de la bomba de calcio, modifica la concentración de calcio intracelular, proceso que tiene influencia en la contracción muscular, la expresión génica, la diferenciación celular y las funciones neuronales 17. El aumento de actividad de la aldosa reductasa incrementa la concentración de fructosa.
La mayor o menor afectación de las diversas proteínas está en relación a la vida media de éstas. Se observan bases de Schiff y, en menor medida productos de Amadori, mayormente inestables y por lo tanto reversibles, en proteínas de alto recambio, de vida media corta por un proceso más activo de renovación celular, como proteínas plasmáticas, de los hematíes y de órganos como el intestino, la piel y el hígado.
Los AGE se observan en meses o años de contacto con proteínas de vida media larga, como de cristalino, de colágeno, de vainas de mielina y también con ácidos nucleicos. Su acumulación en tejidos humanos con daño micro y macrovascular, primero descripta con especial relevancia en la diabetes, actualmente ha sido asociada a estadios avanzados de enfermedad renal, enfermedades neurodegenerativas, obstrucción pulmonar crónica, deterioro cerebral, enfermedad cardiovascular, cataratas, ateroesclerosis y envejecimiento temprano, especialmente de la piel y los endotelios vasculares 18-21.
El envejecimiento se explica como una red deletérea en la que participan el estrés oxidativo, los radicales libres, el daño mitocondrial y el incremento de calcio intracelular, todo lo cual es incrementado por la glicación.
Los AGE afectan lentamente la renovación de tejidos y la elevada vida media de las proteínas de la dermis las hace especialmente sensibles al daño por glicación, estimulado por rayos ultravioleta.
En ancianos con diabetes tipo 2 y compromiso de capacidad cognitiva, se observaron niveles de AGE, RAGE y PCR significativamente aumentados en correlación con los valores de HbA 22. En placas seniles y en manojos neurofibrilares y placas de ß-amiloide de la enfermedad de Alzheimer, se observan depósitos de AGE tres veces superiores a lo que puede verse en controles 23.
Aunque menos estudiado, los depósitos de AGE también parecen desempeñar un papel patogénico en otras enfermedeades neurodegenerativas como Parkinson 24, enfermedad con cuerpos de Lewy 25, esclerosis lateral amiotrófica 26, Huntington 27 y Creutzfeldt-Jakob 28. Se han descripto altos niveles de AGE en suero y activación de RAGE en el síndrome de ovario poliquístico 29.
Los diabéticos son especialmente susceptibles a las glicotoxinas debido a la aumentada producción endógena, por lo cual en su tratamiento, el control de la glucemia y la reducción de dAGE es relevante para la prevención de las enfermedades crónicas que suelen presentarse en su evolución, como nefropatía, retinopatía y neuropatía. En diabéticos insulino-dependientes con nefropatía y retinopatía, puede apreciarse rigidez articular en las manos. Este signo, por su evidencia y sencillez, constituye un valioso integrante del cuadro semiológico y puede registrarse en la impresión palmar comparada con controles, por la falta de marcación de las primeras falanges 30,31.
En la nefropatía diabética después de la primer etapa de alteraciones funcionales, la segunda etapa de alteraciones estructurales, se caracteriza por engrosamiento de la membrana basal, expansión del mesangio y cambios en las arterias glomerulares. En estas lesiones no ha sido documentada una participación inmunológica, y una alteración de las proteínas estructurales parece ser el principal factor patogénico.
Madres diabéticas mal controladas durante la gestación pueden dar a luz niños con malformaciones congénitas, como la secuencia de retracción caudal, en la forma más leve, que es la agenesia de sacro, o la más grave, la sirenomielia o simpodia, fusión de los brotes de miembros inferiores. No se sabe si estas malformaciones, consecuencia de un defecto del blastema caudal o de la porción media posterior del mesodermo, se deben a alteración de las proteínas estructurales del tejido conectivo o a alteraciones de ácidos nucleicos 32.
Reducir dAGE es relevante no solo en la diabetes, sino también en la insuficiencia renal.
La alimentación con bajos dAGE en pacientes en diálisis peritoneal por insuficiencia renal avanzada, mostró relación con mejoría en los valores de urea, creatinina, proteínas totales, albúmina y fósforo, lo que permite una mejor evolución 33.
Los enfermos renales crónicos pueden sufrir un daño especial por la disminuida eliminación de compuestos con grupos carbonilos, altamente reactivos para glicación (estrés carbonílico).
Los AGE son compuestos patogénicos responsables de inducción y progresión del deterioro renal y de complicaciones cardiovasculares que ensombrecen el pronóstico. Como muchos AGE son fluorescentes, la medida de la fluorescencia en la piel permite apreciar el grado en que esta se ve afectada, lo que se determina como un índice de daño vascular y renal de valor pronóstico en pacientes en hemodiálisis o con trasplante renal 34.
Dentro de las células, el daño consecuente a los AGE se da especialmente en las mitocondrias, lo que disminuye la producción energética. Con la depleción del metabolismo mitocondrial y disminución en la generación energética, aumenta la glucólisis citoplasmática sin acceso al ciclo de Krebs y cadena respiratoria, con producción final de ácido láctico, base de la teoría metabólica del cáncer 35, 36. Los AGE son inductores de apoptosis, que normalmente se produce para remplazar células envejecidas o dañadas, o durante el desarrollo, o como defensa ante ataques virales.
Estudios efectuados en los que se modifica la alimentación para una baja o alta ingestión de dAGEs, en algunos casos no muestran correlación con la concentración de estos productos en el plasma ni en la orina, ni cambios significativos en indicadores inflamatorios, tonometría arterial periférica o función endotelial 37. Estas observaciones aparentemente discordantes no permitieron sacar conclusiones definitivas, pero podrían atribuirse a que los dAGE son solo parcialmente absorbidos, en especial los de peso molecular bajo que no interactúan con los RAGE, aunque se ha postulado que éstos podrían inducir la formación endógena de AGE de alto peso molecular.
Además, como lo hemos referido al tratar glicación exógena, la generación de AGE puede ocurrir in-situ, en la luz intestinal por acción de la fructosa, del jarabe de maíz alto en fructosa (JMAF) o de frutas o jugos de frutas, al ingerirse junto a fuentes alimentarias proteicas.
Hasta 1970 la ingestión de fructosa era de entre 6 y 12 gramos diarios, correspondiente al contenido de las frutas. Limitaciones en la disponibilidad y el alto costo de la sacarosa llevó posteriormente a utilizar la fructosa como alternativa en la gastronomía. Consecuentemente, el consumo de fructosa ha venido aumentando considerablemente desde 1980. El JMAF es utilizado en bebidas gaseosas, tortas, frutas enlatadas, mermeladas y otros diversos alimentos procesados.
Relevamientos efectuados en EE.UU. 38 y en Europa 39 muestran que, en el 30% de la población, los hidratos de carbono aumentaron en un 25% el aporte calórico junto con una disminución en el aporte de nutrientes. El aporte calórico de azúcares simples, glucosa y fructosa agregados a alimentos y bebidas subió de 5% a 13% del aporte calórico total. En bebidas gaseosas, la fructosa representa entre 55 y 58% del contenido total de azúcar 40.
La presencia de fructosa no es fácilmente puesta de manifiesto para el consumidor, pues en la etiqueta de ingredientes con frecuencia figura: “JMAF y/o azúcar”.
La fructosa no requiere insulina para su metabolización, que se efectúa directamente en el hígado y por ser mucho más reactiva que la glucosa es una importante fuente generadora de AGE.
El tejido graso y el muscular son los principales consumidores de glucosa, en déficit o resistencia a la insulina no pueden usarla y entonces los otros tejidos que no necesitan de la insulina tienen glucosa en el intra y el extracelular. Como ya lo hemos referido, el aumento de la glucosa genera elevación en los niveles de fructosa.
Numerosas observaciones referidas entre 2013 y 2017 41-44 hacen casi innegable efectos patogénicos de un elevado consumo de fructosa, principalmente como JMAF, mediante generación de AGE. Estas observaciones hacen necesaria una conducta precautoria. No solo debe reducirse el consumo de sacarosa, sino también debe limitarse el consumo de fructosa hasta donde sea posible, al de 200 o 400 gramos de frutas por día.
Un estudio in-vitro con los edulcorantes artificiales aspartano y sucralosa, informa glicación sobre albúmina sérica humana y bovina, inmunoglobulina G y factores de coagulación VIII y IX. Esto se debería a la presencia, al igual que en la glucosa, de grupos reactivos que interactúan con grupos amino de la lisina. Pero un estudio posterior no lo confirma, e incluso informa un efecto antiglicación para el acelsulfano 45,46.
Subproductos de la reacción de Maillard
La acrilamida y el furán, son subproductos de la reacción de Maillard que, a lo largo de los años, aumentan potencialmente el riesgo cancerígeno. También, especialmente a la acrilamida, se han atribuido potenciales efectos de daño neurológico y genético con alteraciones cromosómicas. Esto es motivo de que diversos organismos internacionales estén participando en medidas de control sobre el riesgo alimentario. Los principales alimentos involucrados son papas fritas, biscuits, tortas, café instantáneo, chocolates y otros en base a cereales para adición a leches y yogures (Food Standards Agency. Survey of acrylamide and furan in UK retail products. 2014 to 2018).
Por efectos patogénicos los productos de glicación se denominan también glicotoxinas. Intervienen en la generación de radicales libres, activan citoquinas proinflamatorias, alteran estructura química y función de proteínas y ácidos nucleicos. Tienen manifiestos roles patogénicos en la diabetes y la insuficiencia renal e intervienen en el envejecimiento y posiblemente en enfermedades neurodegenerativas. Alteraciones mitocondriales dan base a la teoría metabólica del cáncer, a lo que se suman subproductos de la reacción de Maillard que aumentan potencialmente el riesgo cancerígeno.
Preservación de la salud
En el organismo existe una batería de compuestos antioxidantes que protegen a las células de los productos iniciales de glicación. La alimentación provee también sustancias antioxidantes como las vitaminas retinol, ácido ascórbico y tocoferol, flavonoides, licopenos, indoles y luteínas, muchas de las cuales son también antiinflamatorias, contenidas en frutas, verduras frescas, té verde, mate y vino.
En la clínica se ha procurado el bloqueo de productos Amadori 47 por derivados de hidralazina, que tiene mayor reactividad para los grupos amino que los carbonilos. La aminoguanidina ha mostrado efectividad para prevenir la formación de AGE y la reticulación de proteínas in-vitro y lo mismo se ha observado in vivo en el tejido conectivo de paredes arteriales en ratas 48.
Se están evaluando agentes inhibidores de AGE para uso clínico. Se ha atribuido capacidad para disminuir el daño inducido por AGE de generación endógena a diversos compuestos como ácido lipoico, carnitina, taurina, benfotiamina, a-tocoferol, niacinamida, piridoxal, o rivoflavina; a elementos como selenio, zinc o manganeso y a diversas hierbas y especias como canela, clavos de olor, orégano y jengibre al igual que al té, al mate, al chocolate y al ajo, por su contenido de flavonoides y otros fitoquímicos como carnosina, catequina, quercetina, curcumina, o sulforafán 49, 50. La piridoxamina se ha mostrado en este aspecto como la más efectiva.
Estudios efectuados con extractos alcohólicos de especias, en especial canela, clavos de olor y pimienta negra, mostraron efectividad en disminuir glicación de proteínas, en relación a su contenido de flavonoide 51-53. Se busca agregar productos como los mencionados para topicación de alimentos antes de la cocción, pero faltan estudios al respecto.
Estudios efectuados con yerba mate, Ilex paraguariensis, muestran acción antioxidante superior al té verde e inhibitoria sobre la generación de AGE tan potente como la de la aminoguanidina, debido al elevado contenido de sus dos principales compuestos fenólicos, el ácido clorogénico y el ácido cafeico 54. Otros polifenoles, como la naringina, el ácido elágico, o la genisteína, que es una isoflavona, también han sido estudiados en su acción protectora de los efectos patogénicos de la glicación 55.
Desde el reconocimiento de la HbA como el mejor parámetro para control de tratamiento en la diabetes, observaciones clínicas y en animales de experimentación aportan abundantes conocimientos sobre el rol de la glicación en la patogenia de variadas enfermedades crónicas, no necesariamente relacionadas a la diabetes.
Lo antedicho justifica medidas de prevención mediante la alimentación y hábitos de vida.
La cocción por hervido, vapor, escalfado o estofado, en microondas, por menor temperatura y mayor humedad y en menores tiempos de exposición, disminuye significativamente la generación de glicotoxinas. La cocción en agua o al vapor, disminuye en forma logarítmica la generación de dAGE 56. La acidificación de las carnes en vinagre o jugo de limón, una hora antes de su asado u horneado o durante su escalfado o estofado, también reduce la formación de glicotoxinas.
Es recomendable evitar el recalentamiento de estos alimentos antes de su consumo a altas temperaturas.
La reducción de la glicación endógena se logra, en primer lugar con el control de la glucemia. Deben evitarse alimentos de alto índice glucídico como sacarosa y fructosa, de esta manera se disminuye la carga glucídica. La ingesta diaria de 2 o 3 raciones de frutas y verduras crudas al igual que especias, usadas generalmente como condimentos, como la cúrcuma y el jengibre, tienen también importantes propiedades antioxidantes.
Teóricamente, como la generación de AGE es acelerada por especies reactivas de oxígeno, los antioxidantes como el resveratrol, presente en el vino especialmente tinto, serían efectivos para limitar su producción 57. El chocolate negro, antioxidante por su contenido de flavonoides y polifenoles, disminuye la resistencia a la insulina, baja la presión arterial y aumenta la biodisponibilidad endotelial de óxido nítrico, disminuyendo el riesgo de enfermedad cardiovascular 58.
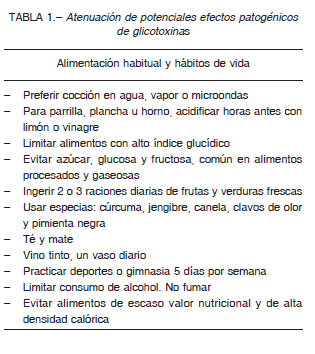
Prebióticos y probióticos, principalmente fibra y alimentos fermentados, son fundamentales para mantener una saludable flora bacteriana intestinal. La microbiota con su aporte biológico, el microbioma, produce enzimas que permiten la hidrólisis necesaria para la absorción de antioxidantes y la acción secuestradora de AGE y ALE. Es probable que los lactobacilos tengan capacidad de eliminar AGE y ALE de los alimentos, como también pueden eliminar gluten y cancerígenos alimentarios 59.
También se aprecia una disminución de AGE como resultado de entrenamiento deportivo 60 en tanto que niveles más elevados de estos productos, o de moléculas inmunoquimicamente relacionadas, son observados en cristalino y vasos sanguíneos de fumadores 61.
En animales de experimentación se ha observado que la restricción calórica también disminuye la acumulación de glicotoxinas en el colágeno de la piel a lo largo de los años 62.
En conclusión, sin erradicar alimentos, el consumo mesurado de algunos de ellos, reservados para alimentación eventual y no para la alimentación habitual, junto a ciertos hábitos de vida, puede hacer mucho para preservar el estado de salud (Tabla 1).
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Machiels D, Istasse L. La réaction de Maillard: importance et applications en chimie des aliments. Ann Med Vet 2002; 146: 347-52.
2. Flores M. Understanding the implications of current health trends of the aroma of wet and dry cured meat products. Meat Sci 2018; 144: 53-61.
3. Khaw KT, Wareham N, Luben R, et al. Glycated haemoglobin, diabetes, and mortality in men in Norfolk cohort of european prospective. Brit Med J 2001; 322: 15-8.
4. Bengmark S. Amplifiers of systemic inflammation, the role advanced glycation and lipoxidation end products in foods. Kuwait Med J 2008; 40: 3-17.
5. Uribarri J, del Castillo MD, de la Maza MP, et al. Dietary advanced glycation end products and their role in health and disease. Adv Nutr 2015; 6: 461-73.
6. Kalousova M, Zima T, Popov P, et al. Advanced glycation end-products in patients with chronic alcohol misuse. Alcohol Alcohol 2004; 39: 316-20.
7. Forster A, Kuhme Y, Henle T. Studies on absorption and elimination of dietary Maillard reaction products. Ann N Y Acad Si 2005; 1043: 474-81.
8. Smedsrod B, Melkko J, Araki N, Sano H, Horiuchi S. Advanced glycation end products are eliminated by scavenger-receptor-mediated endocytosis in hepatic sinusoidal Kupffer and endothelial cells. Bioch J 1997; 322: 567-73.
9. De Christopher LR. Perspective: The paradox in dietary advanced glycation end products research. The source of the serum and urinary advanced glycation end products is the intestines, not the food. Adv Nutr 2017; 8: 679-83.
10. Gugliucci A. Formation of fructose-mediated advanced glycation end products and their roles in metabolic and inflammatory diseases. Adv Nutr 2017; 8: 54-62 .
11. Suárez G, Rajaram R, Oronsky AL, Gawinowicz MA. Nonenzymatic glycation of bovine serum albumin by fructose (fructation). Comparison with the Maillard reaction initiated by glucose. J Biol Chem 1989; 264: 3674-9.
12. Bains Y, Gugliucci A, Caccavello R. Advanced glycation endproducts form during ovalbumin digestion in the presence of fructose: Inhibition by chlorogenic acid. Fitoterapia 2017; 120: 1-5.
13. Aragno M, Mastrocola R. Dietary sugars and endogenous formation of advanced glycation endproducts: emerging mechanisms of disease. Nutrients 2017; 9: 385.
14. Ramasamy R, Vannucci SJ, Yan SS, Herold K, Yan SF, Schmidt AM. Advanced glycation end products and RAGE: a common threat in aging, diabetes, neurodegeneration, and inflammation. Glycobiology 2005; 15: 16R-28R.
15. Barzilay JI, Buzková P, Zieman SJ, Kizer JR, Djoussé L, Ix JH. Circulating levels of carboxy-methyl-lysine (CML) are associated with hip fracture risk. J Bone Miner Res 2014; 29: 1061-6.
16. Breyer V, Frischmann M, Bedmon C, Schemm A, Schiebel K, Pischetsrieder M. Analysis and biológical relevance of advanced glycation end-products of DNA in eukaryotic cells. FEBS J 2008; 275: 914-25.
17. Gonzalez Flecha FL, Castello PR, Gagliardino JJ, Rossi JPFC. Molecular characterization of the glycated plasma membrane calcium pumps. J Membrane Biol 1999; 171: 25-34.
18. Birlouez-Aragon I, Saavedra G, Tessier FJ, et al. A diet based on high-heat-treated foods promotes risk factors for diabetes mellitus and cardiovascular diseases. Am J Clin Nutr 2010; 91: 1220-6.
19. Smit AJ, Gerrits EG. Skin autofluorescence as a measure of advanced glycation endproduct deposition: a novel risk marker in chronic kidney disease. Curr Opin Nephrol Hypertens 2010; 19: 527-33.
20. Enzinger C, Fazekas F, Matthews PM, et al. Risk factors for progression of brain atrophy in aging: six-year follow-up of normal subjects. Neurology 2005; 64: 1704-11.
21. Nadeem A, Raj HG, Chhabra Sk. Increased oxidative stress and altered levels of antioxidants in chronic obstructive pulmonary disease. Inflammation 2005; 29: 23-32.
22. Gorska-Ciebiada M, Saryusz-Wolska M, Borkowska A, Ciebiada M, Loba J. C-reactive protein, advanced glycation end products, and their receptor in type 2 diabetic, elderly patients with mild cognitive impairment. Front Aging Neurosci 2015; 7: 209: 116-59.
23. Smith MA, Taneda S, Rickey PL, et al. Advanced Maillard reaction end products are associated with Alzheimer pathology. Proc Soc Natl Acad Sci USA 1994; 91: 5710-4.
24. Castellani R, Smith MA, Richey PL, Perry G. Glycoxidation and oxidative stress in Parkinson disease and diffuse Lewy body disease. Brain Res 1996; 737: 195-200.
25. Dalfo E, Portero-Otin, M, Ayala V, Martinez A, Pamploina R, Ferrer I. Evidence of oxidative stress in the neocortex in incidental Lewy body disease. J Neuropathol Exp Neurol 2005; 64: 816-30.
26. Kaufmann E, Boehm BO, Süssmuth SD, et al. The advanced glycation end-product N epsilon-.(carboxymethyl)-lysine level is elevated in cerebrospinal fluid of patients with amyotrophic lateral sclerosis. Neurosci Lett 2004; 371: 226-9.
27. Ma L, Nicholson LF. Expression of the receptor for advanced glycation end products in Huntington’s disease caudate nucleus. Brain Res 2004; 1018:10-7.
28. Sasaki N, Takeuchi M, Chowei H, et al. Advanced glycation end products (AGE) and their receptor (RAGE) in the brain of patients with Creutzfeldt-Jacob disease with prion plaques. Neurosci Let 2002; 326: 117-20.
29. Diamanti-Kandarakis E, Piperi C, Kalofoutis A, et al. Increased levels of serum advanced glycation end-products in women with polycystic ovary syndrome. Clin Endocrinol 2005; 62: 37-43
30. Voyer LE, Bruno O, Ibarra R, et al. Nefropatía diabética en la infancia. Rev Hosp Gral Niños Pedro de Elizalde 1997; 7: 23-30.
31. Rosenbloom AC, Silverstein JH, Lezotte DC, Richardson K, Mc Callum M. Limited joint mobility in childhood diabetes mellitus indicates increased risk for microvascular disease. N Eng J Med 1981; 305: 191-4.
32. Voyer LE. Síndromes malformativos. Secuencia de retracción caudal. En: Voyer, Ruvinsky, Cambiano. Pediatría, 3ra ed. Buenos Aires: Editorial Journal, 2011, p 1102.
33. Uribarry J, Peppa M, Cai W, et al. Restriction of dietary glycotoxin reduces exessive glycation end products in renal failure patients. J Am Soc Nephrol 2003; 14: 728-31.
34. Gerrits EG, Lutgers HL, Smeets GHW, et al. Autofluorescence: a pronounced marker of mortality in hemodialysis patients. Nephron Extra 2012; 2: 184-91.
35. Gogvadze V, Orrennius S, Zhivotovsky B. Mitochondria in cancer cells: what is so special about them? Trends Cell Biol 2008; 18: 165-73.
36. Gonzalez M, Miranda Massari JR, Duconge J, et al. The bio-energetic theory of carcinogenesis. Med Hypotheses 2012; 79: 433-9.
37. Semba RD, Gebauer SK, Baer DJ, et al. Dietary intake of advanced glycation end products did not affect endothelial function and inflammation in healthy adults in a randomized controlled tial. J Nutr 2014; 144: 1037-42.
38. Marriott BP, Olsho L, Hadden L, Connor P. Intake of added sugars and selected nutrients in the United States, National Health and Nutrition Examination Survey (NHANES) 2003-2006. Crit Rev Food Sci Nutr 2010; 50: 228-58.
39. Azaïs-Braesco V, Sluik D, Maillot M, Kok F, Moreno LA. A review of total & added sugar intakes and dietary sources in Europe. Nutr J 2016; 16: 6.
40. White JS, Hobbs LJ, Fernandez S. Fructose content and composition of commercial HFCS-sweetened carbonated beverages. Int J Obes 2015; 39: 176-82.
41. Poulsen MW, Hedegaard RV, Andersen JM, et al. Advanced glycation endproducts in food and their effects on health. Food Chem Toxicol 2013; 60: 10-37.
42. De Christopher LR, Uribarri J, Tucker KL. Intake of highfructose corn syrup sweetened soft drinks, fruit drinks and apple juice is associated with prevalent arthritis in US adults, aged 20-30 years. Nutr Diabetes 2016; 6: e199.
43. De Christopher LR, Uribarri J, Tucker KL. Intakes of apple juice, fruit drinks and soda are associated with prevalent asthma in US children aged 2-9 years. Public Health Nutr 2016; 19: 123-30.
44. Aragno M, Mastrocola R. Dietary sugars and endogenous formation of advanced glycation endproducts: Emerging mechanisms of disease. Nutrients 2017; 9: 385.
45. Ali A, Devrukhkas J. In vitro study on glycation of plasma protein with artificial sweeteners. Biol Szeged 2016; 65-7.
46. Ali A, More TA, Hoonjan AK, Sivakami S. Antiglycating potential of acesulfame potassium: an artificial sweetener. Appl Physiol Nutr Metab 2017; 42: 1054-63.
47. Khalifah RG, Baynes JW, Hudson BG. Amadorins: novel post-amadori inhibitors of advance glycatioon reaction. Bioche Biophys Res Commun 1999; 257: 251-8.
48. Zimmerman GA, Meistrell M, Bloom O, et al. Neurotoxicity of advanced glycation endproducts during focal stroke and neuroprotective effects of aminoguanidine. Proc Natl Acad Sci USA 1995; 92: 3744-48.
49. Hagen TM, Liu JL, Lykkesfeldt J, et al. Feeding acetyl-Lcarnitine and lipo-acid to old rats significantly improves metabolic function while decreasing oxidative stress. Proc Nati Acad Sci USA 2002; 99: 1870-5.
50. Nandhini ATA. Thirunavakkaras, V. Anuradha CV. Taurine prevent collagen abnormalities in high fructose-fed rats. Indian J Med Res 2005; 122: 171-7.
51. Kim CS, Park S, Kim J, The role of glycation in the pathogenesis of aging and its prevention through herbal products and physical exercise. J Exerc Nutrition Biochem 2017; 21: 55-61.
52. Yamagishi SI, Matsui T, Ishibashi Y, et al. Phytochemicals against advanced glycation end products (AGEs) and the receptor system. Curr Pharm Des 2017; 23: 1135-41.
53. Jessica Elizabeth T, Gassara F, Kouassi AP, Brar SK1, Belkacemi K. Spice use in food: Properties and benefits. Crit Rev Food Sci Nutr 2017; 57: 1078-88.
54. Bains Y, Gugliucci A. Ilex paraguariensis and its main component chlorogenic acid inhibit fructose formation of advanced glycation endproducts with amino acids at conditions compatible with those in the digestive system. Fitoterapia 2017; 117: 6-10.
55. Kong Y, Li X, Zheng T, et al.. Glycation of ß-lactoglobulin and antiglycation by genistein in different reactive carbonyl model systems. Food Chem 2015; 183: 36-2.
56. Uribarri J, Woodruff S, Goodman S, et al. Advanced glycation end products in foods and a practical guide to their reduction in the diet. J Am Diet Assoc 2010; 110: 911-6.
57. Liu Y, He XQ, Huang X, et al. Resveratrol protects mouse oocytes from methylglyoxal-induced oxidative damage. PloS ONE 2013; 8: e77960.
58. Ried K, Sullivan Th, Fakler P, et al. Does chocolate reduce blood pressure? A meta-analysis. BMC Med 2010; 8: 39.
59. di Cagno R, de Angelis M, Alfonsi G, et al. Pasta made from durum wheat semolina fermented with selected lactobacilli as a tool for a potential decrease of the gluten intolerance. J Agric Food Chem 2005; 53: 4393-02.
60. Couppé C, Svensson RB, Grosset JF, et al. Life-long endurance running is associated with reduced glycation and mechanical stress in connective tissue. Age (Dordr) 2014; 36: 9665.
61. Nicholl ID, Still AW, Moore JE, et al. Increased levels of advanced glycation endproducts in the lenses and blood vessels of cigarette smokers. Mol Med 1998; 4: 594-01.
62. Cefalu WT, Bell-Farrow AD, Wang ZQ, et al. Caloric restriction decreases age-dependent accumulation of the glycoxidation products, N epsilon (carboxymethyl) lysine and pentosidine, in the rat skin collagen. J Gerontol Biol Sci 1995; 50A: B337-B341.
