MARÍA A. AGUIRRE 1, BRUNO R. BOIETTI 1, ELSA NUCIFORA 2, ROSARIO LUXARDO 3, PATRICIA SORROCHE 4, SOLEDAD SAEZ 4, DIEGO H. GIUNTA 1, MARÍA L. POSADAS-MARTÍNEZ 1
1Servicio de Clínica Médica, 2 Servicio de Clínica Médica, Sección Hematología, 3 Servicio de Nefrología, 4 Servicio de Laboratorio Central, Hospital Italiano de Buenos Aires, Buenos Aires, Argentina
Resumen La amiloidosis AA causa principalmente disfunción renal, lo que lleva a un elevado riesgo de mortalidad a mediano plazo. Existe escasa información epidemiológica sobre la amiloidosis AA en Argentina, por lo que el objetivo de este trabajo fue describir las características epidemiológicas de esta enfermedad en un hospital de tercer nivel en nuestro país. Se realizó una cohorte prospectiva de todos los pacientes consecutivos con evidencia de amiloidosis AA, por inmunohistoquímica de tejidos, incluidos en el Registro Institucional de Amiloidosis del Hospital Italiano de Buenos Aires, desde el 01/04/2012 hasta el 31/12/2017. De los 121 pacientes del registro, se incluyeron 18 con AA para el análisis. Del total incluido, 50% (9) eran mujeres, con una mediana de edad de 53.5 (rango intercuartil, RII 46-61) años. El 88.9% (16) presentó compromiso renal, todos tuvieron proteinuria, y 6 requirieron diálisis. Seis tuvieron infiltración amiloide del aparato digestivo. La latencia entre la aparición de la enfermedad subyacente y el diagnóstico de AA tuvo una mediana de 27 (RII 8-35) años. La enfermedad subyacente fue de origen inflamatorio en 6 casos. En el 50% (9) de los enfermos la causa de amiloidosis AA fue desconocida. En el restante 50% esas causas se asemejan a las de países desarrollados. A su vez, nuestros resultados resaltan la importancia de su diagnóstico diferencial para identificar el tratamiento o seguimiento más adecuado según el cuadro que presente cada paciente.
Palabras clave: amiloidosis, epidemiología, amiloide sérico A
Abstract AA amyloidosis. A single institution cohort study. There is limited epidemiological information on AA amyloidosis in Argentina, so the objective of this study was to describe the epidemiological characteristics of this disease in a tertiary hospital in our country. We designed a prospective clinical cohort of all consecutive patients with AA amyloidosis confirmed by immunohistochemistry in tissue from the Institutional Registry of Amyloidosis of the Hospital Italiano de Buenos Aires, in the period 04/01/2012- 12/31/2017. Of the 121 patients in the registry, 18 were included with AA for the analysis. Of the total included, 50% (9) were female, with a median age of 53.5 (interquartile range, RII 46-61) years. The 88.9% (16) of cohort presented renal compromise, all had proteinuria, and 6 required dialysis. Six had amyloid infiltration of the digestive system. The latency between the onset of the underlying disease and the diagnosis of AA had a median of 27 (RII 8-35) years. The underlying disease was of inflammatory origin in 6 cases. In 50% (9) of the patients the cause of AA amyloidosis was unknown. In the remaining 50%, these causes resemble those observed in developed countries. Furthermore, our results highlight the importance of their differential diagnosis to identify the most appropriate treatment or follow-up according to the situation presented by each patient.
Key words: amyloidosis, epidemiology, serum amyloid A protein
Dirección postal: María A. Aguirre, Hospital Italiano de Buenos Aires, Tte. Gral. Juan D. Perón 4190, 1199 Buenos Aires, Argentina
e-mail: adela.aguirre@hospitalitaliano.org.ar
La amiloidosis está caracterizada por el depósito de material amorfo extracelular que se tiñe con Rojo Congo. Su evolución es potencialmente fatal y la mortalidad se relaciona generalmente con la disfunción del órgano que afecta. El diagnóstico suele ser tardío. Existen diferentes proteínas amiloidogénicas, hasta ahora aproximadamente 34 han sido descritas 1,2. La entidad se define según el tipo de proteína implicada, particularmente la amiloidosis causada por amiloide sérico A (SAA) se denomina AA. El diagnóstico se realiza en biopsia de tejidos con inmunohistoquímica para la detección de SAA 1-6. En dos estudios, la mediana de supervivencia desde el diagnóstico de amiloidosis AA fue de 11 años aproximadamente 1, 7.
El SAA es una proteína cuya síntesis hepática es inducida por el aumento de citoquinas proinflamatorias, entre ellas las interleukinas 1 y 6 y el factor de necrosis tumoral 8, 9. Al sintetizarse, los niveles séricos se elevan por encima de lo normal. Por causas que tendrían que ver con la isoforma de SAA que cada individuo posee, la proteína se deposita en diferentes órganos 10, 11. Pueden pasar años desde la aparición del cuadro que origina la liberación de las citoquinas proinflamatorias hasta que la amiloidosis se manifieste. Este período es variable, puede ser de varios años (17 años, de acuerdo a Lachmann y col. y 13.7 años, de acuerdo a Palladini y col.), hasta décadas 1, 7. El tratamiento del cuadro que genera la amiloidosis puede mejorar la función del órgano y los síntomas del paciente, pero si la enfermedad recrudece, los síntomas suelen reaparecer 1, 2, 8, 12.
La amiloidosis AA causa principalmente disfunción renal, lo que lleva a un elevado riesgo de mortalidad a
mediano plazo 1, 2, 7. Las causas principalmente descritas de AA son artritis reumatoidea, enfermedad inflamatoria intestinal, infecciones crónicas (tuberculosis, fístulas, osteomielitis, etc.), enfermedades autoinflamatorias hereditarias como la fiebre mediterránea familiar y neoplasias. En algunos casos la causa puede no ser aparente, aun habiendo estudiado al paciente exhaustivamente, dando lugar a amiloidosis AA de origen idiopático, o bien, la causa puede manifestarse después que la amiloidosis se hizo evidente clínicamente 1, 7, 13, 14.
En Argentina se informó una densidad de incidencia de amiloidosis AA de 1.8 (95% IC: 0.5-7.2) por millón/año 5. Sin embargo, disponemos de escasos datos sobre las características de la amiloidosis AA en nuestra población. Por ello, conocer la distribución de las causas de amiloidosis AA y las características en nuestra región es relevante para la comunidad y tiene importancia asistencial.
El objetivo de este trabajo es describir una cohorte de pacientes con AA en nuestro centro.
Materiales y métodos
Se diseñó una cohorte prospectiva con todos los pacientes consecutivos con diagnóstico confirmado de SAA incluidos en el Registro Institucional de Amiloidosis del Hospital Italiano de Buenos Aires, en el período desde 01/04/2012 hasta el 31/12/2017. El protocolo y el consentimiento informado oral fueron evaluados y aprobados por el Comité de Ética independiente y publicado en clinicaltrials.gov (NCT01347047). El centro se conforma de dos hospitales universitarios de alta complejidad asociados a un Instituto Universitario y 21 centros de salud periféricos de atención ambulatoria. A su vez, cuenta con un sistema prepago de atención médica de 163 000 afiliados, predominantemente de clase media. Se reciben además pacientes derivados de todo el país y países limítrofes. Se dispone de un repositorio de datos computarizado, donde se registran centralmente todos los procedimientos médicos, diagnósticos e intervenciones de los beneficiarios.
El Registro Institucional de Amiloidosis tiene carácter institucional y recluta los casos de amiloidosis sin exclusión de ningún área dentro del ámbito hospitalario 5. La forma de ingreso de casos se efectúa de dos maneras, la primera es la captura desde de la historia clínica electrónica a través de la búsqueda sistemática periódica utilizando vocabulario controlado según servidor de terminología con tesauro local.
Posteriormente, las historias clínicas de los pacientes seleccionados son revisadas por un médico especialista para confirmar la presencia de amiloidosis. La otra forma de ingreso es a través de la derivación de un profesional, tanto del centro como de cualquier otro centro de salud. Si bien se incluyen casos de amiloidosis desde el 2006, los casos de amiloidosis AA incidentes pudieron ser incluidos a partir del 2012, año en el que se incorporan las técnicas de inmunohistoquímica para confirmar AA en biopsia de tejidos.
El diagnóstico de amiloidosis se realizó con biopsia de tejido con técnica de Rojo Congo y/o tioflavina positivo. El diagnóstico de amiloidosis AA se realizó con inmunohistoquímica en tejido con anticuerpos antiAA. Se seleccionó la totalidad de pacientes registrados mayores de 18 años con diagnóstico confirmado. Ninguno se negó a participar.
Un investigador entrenado, supervisado por dos expertos en amiloidosis, completó la información de datos demográficos, clínicos y comorbilidad en el momento del diagnóstico de amiloidosis y actualizó de forma periódica y sistemática el seguimiento mediante la revisión de la historia clínica electrónica. En aquellos que no se siguen en el hospital o se pierden en el seguimiento se utilizó un esquema fijo de evaluaciones telefónicas.
Se emplearon variables cuantitativas como media y desvío estándar o mediana e intervalo intercuartil (RII) de acuerdo a la distribución observada. Se presentaron las variables categóricas con su valor absoluto y relativo como porcentaje. Se utilizó para el análisis estadístico el software STATA versión 13 (StataCorp, College Station, Texas-USA).
Resultados
Se incluyeron 121 pacientes con diagnóstico de amiloidosis, de los cuales 21 (17.4%) tuvieron diagnóstico de amiloidosis AA. Para el análisis se excluyeron tres casos por falta de datos clínicos, quedando 18 pacientes, 9 (50%) de sexo femenino, con una mediana de edad de 53.5 (RII: 46-61) años. En la Tabla 1 se muestran las características basales.
La mitad de los pacientes no poseían una causa evidente de amiloidosis AA, a pesar de haber sido evaluados exhaustivamente. Las enfermedades que ocasionaron el depósito de amiloide sérico A, por orden de frecuencia, fueron de origen autoinmune en 6 casos e infecciones respiratorias crónicas en 3 (Tabla 1).
El tiempo de inicio de síntomas hasta el diagnóstico de amiloidosis AA tuvo una mediana de 27 (RII: 8-35)
años. El máximo tiempo de latencia desde el inicio de la enfermedad inflamatoria hasta el diagnóstico de amiloidosis fue de 45 años. En un caso se diagnosticó a la vez amiloidosis y la enfermedad subyacente y en otro la clínica de amiloidosis antecedió al diagnóstico de la enfermedad que la generaba (Tabla 2).
De los 9 con amiloidosis AA idiopática, 7 presentaron afectación renal grave y progresiva. De los dos pacientes que no tuvieron afectación renal, uno presentó compromiso localizado de tubo digestivo superior e inferior de 15 años de evolución y el otro, compromiso pulmonar localizado.
En nuestro registro, uno de los 18 pacientes falleció de causa cardiológica y renal terminal secundaria a amiloidosis y otro de causa traumática.
Con respecto a los órganos afectados, 16 pacientes presentaron compromiso renal, todos se manifestaron con proteinuria y caída del filtrado glomerular y 6 requirieron terapia de sustitución renal en forma permanente (Tabla 3).
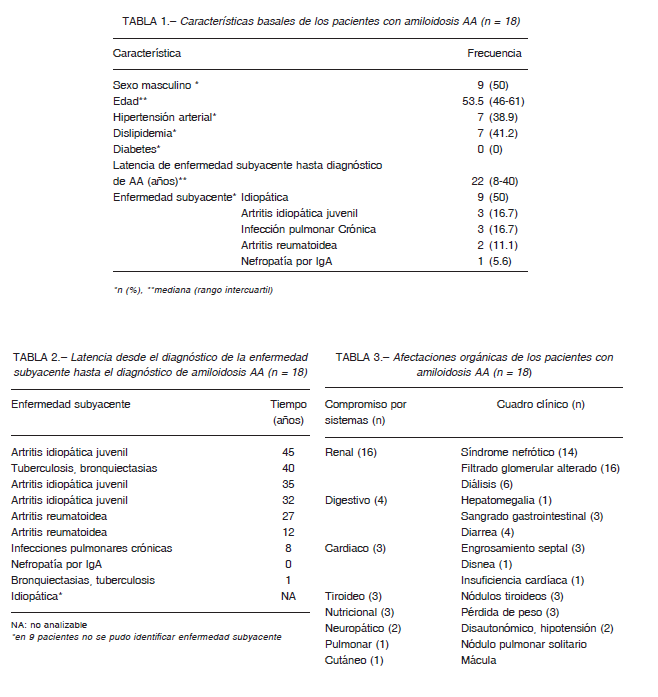
Seis presentaron compromiso del aparato digestivo. Las manifestaciones más frecuentes fueron diarrea
clínicamente invalidante, hepatomegalia y sangrado gastrointestinal.
Otros órganos afectados fueron el corazón, la tiroides y el pulmón. La afectación cardiaca se presentó como insuficiencia cardíaca de difícil control, miocardiopatía hipertrófica y presencia de amiloide AA en la válvula mitral. El compromiso tiroideo fue evidente por bocio y nódulos tiroideos mientras que el compromiso pulmonar se manifestó como nódulo pulmonar solitario.
A todos se les realizó al menos una biopsia. La biopsia renal fue indicada en 16 (89%) por caída del filtrado glomerular y síndrome nefrótico sin causa aparente. Los 4 pacientes con biopsia con tinción Rojo Congo positivo de tubo digestivo tuvieron como manifestación clínica el sangrado, los siete restantes, con biopsia digestiva presentaban síntomas inespecíficos. En siete casos con biopsia de médula ósea, se había sospechado amiloidosis de tipo AL. Los tres pacientes con biopsia tiroidea tuvieron nódulos tiroideos mayores a 2 cm, con diagnóstico presuntivo de neoplasia tiroidea y se les realizó Rojo Congo por los antecedentes. A raíz de un traumatismo costal, uno presentó como hallazgo un nódulo pulmonar asintomático y se realizó una resección pulmonar.
Discusión
Este estudio describe las características de los pacientes con amiloidosis AA incluidos en el Registro Institucional de Amiloidosis. Las enfermedades subyacentes que dieron origen al desarrollo de amiloidosis AA en nuestro centro son similares a las mencionadas en series de países desarrollados, probablemente debido a las características socioeconómicas de la población atendida en nuestra institución 1, 7.
Si bien las afecciones encontradas son similares, la distribución de frecuencias es diferente a las encontradas por otros investigadores. La causa más frecuente en nuestra serie es la idiopática y esto es sensiblemente mayor que en otras series 1, 7, 14. En nuestro estudio, esta elevada frecuencia tendría probablemente que ver con la baja sospecha de desórdenes autoinflamatorios y las dificultades en el diagnóstico de los mismos, ya que en nuestro país no están disponibles estudios genéticos de síndromes autoinflamatorios hereditarios en población adulta a nivel asistencial, y el costo de los mismos en centros extranjeros es elevado.
Según el grupo del Royal College of London, la frecuencia de enfermedades autoinflamatorias y las formas
idiopáticas está en aumento, mientras que la frecuencia de enfermedades autoinmunes está en franco descenso 14. Una de las causas más frecuente en nuestra cohorte es la autoinmune, al igual que en el estudio de Lachmann y col. y en la serie de Pavia. El órgano más frecuentemente afectado fue el riñón, tal cual está ampliamente descrito en la literatura 1, 7, 14.
La mediana de tiempo de latencia entre el diagnóstico de la enfermedad subyacente hasta el diagnóstico de
amiloidosis es similar en nuestra cohorte a la del trabajo de Lachmann y en el grupo de Pavía 1, 7. Estas similitudes en el tiempo de latencia probablemente tienen que ver con la semejanza de enfermedades subyacentes.
A pesar de ser un estudio realizado en un único centro, al ser un centro de referencia en la enfermedad, se cuenta con pacientes derivados de todo el país. La rigurosidad en el diagnóstico agrega valor a este registro, ya que todos los casos con AA tienen confirmación de amiloidosis en biopsia de tejidos y realización de inmunohistoquímica específica para AA. El proceso de recolección de datos se realiza de manera sistemática. La información se almacena de forma estandarizada y prospectiva con énfasis en el control de calidad.
En ámbitos clínicos la amiloidosis AA debe sospecharse en pacientes con síndrome nefrótico. La sospecha es fundamental para poder diagnosticar la entidad. Si se confirmara la presencia de SAA, como la proteína
se deposita en diferentes órganos (riñón, tubo digestivo, tejido celular subcutáneo, tiroides, hígado, pulmón, corazón, sistema nervioso, etc.) 10, 11, el médico deberá hacer un análisis exhaustivo para descartar o confirmar enfermedades reumáticas y enfermedades infecciosas recurrentes o crónicas, entre otras.
En definitiva, nuestros resultados contribuyen a que la comunidad científica y médica conozca las características de la condición en nuestro medio y manifiesta la importancia de su diagnóstico diferencial para identificar el tratamiento o seguimiento más adecuado según el cuadro que presenta cada paciente.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Lachmann HJ, Goodman HJB, Gilbertson JA, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med 2007; 356: 2361-71.
2. Khalighi MA, Dean Wallace W, Palma-Diaz MF. Amyloid nephropathy. Clin Kidney J 2014; 7: 97-106.
3. Von Hutten H, Mihatsch M, Lobeck H, et al. Prevalence and origin of amyloid in kidney biopsies. Am J Surg Pathol 2009; 33: 1198-205.
4. Said SM, Sethi S, Valeri AM, et al. Renal amyloidosis: origin and clinicopathologic correlations of 474 recent cases. Clin J Am Soc Nephrol 2013; 8: 1515-23.
5. Aguirre MA, Boietti BR, Nucifora E, et al. Incidence rate of amyloidosis in patients from a medical care program in Buenos Aires, Argentina: a prospective cohort. Amyloid 2016; 23: 184-7.
6. Casadonte R, Kriegsmann M, Deininger S-O, et al. Imaging mass spectrometry analysis of renal amyloidosis biopsies reveals protein co-localization with amyloid deposits. Anal Bioanal Chem 2015; 407: 5323-31.
7. Palladini G, Riva E, Basset M, et al. Prognostication of survival and progression to dialysis in AA amyloidosis. Amyloid 2017; 24 (Suppl 1): 136-7.
8. Lane T, Gillmore JD, Wechalekar AD, et al. Therapeutic blockade of interleukin-6 by tocilizumab in the management of AA amyloidosis and chronic inflammatory disorders: a case series and review of the literature. Clin Exp Rheumatol 2015; 33(6 Suppl 94): S46-53.
9. Urieli-Shoval S, Linke RP, Matzner Y. Expression and function of serum amyloid A, a major acute-phase protein, in normal and disease states. Curr Opin Hematol 2000; 7: 64-9.
10. Tanabe H, Maki Y, Urabe S, et al. Myopathy in a patient with systemic AA amyloidosis possibly induced by psoriasis vulgaris: An autopsy case. Muscle Nerve 2015; 52: 1113-7.
11. Booth DR, Booth SE, Gillmore JD, et al. SAA1 alleles as risk factors in reactive systemic AA amyloidosis. Amyloid 1998; 5: 262-5.
12. Hamanoue S, Suwabe T, Hoshino J, et al. Successful treatment with humanized anti–interleukin-6 receptor antibody (tocilizumab) in a case of AA amyloidosis complicated by familial Mediterranean fever. Mod Rheumatol 2016; 26: 610-3.
13. Meneses CF, Egües CA, Uriarte M, et al. Colchicine use in isolated renal AA amyloidosis. Reumatología Clínica 2015; 11: 242-3.
14. Lane T, Pinney JH, Gilbertson JA, et al. Changing epidemiology of AA amyloidosis: clinical observations over 25 years at a single national referral centre. Amyloid 2017; 24: 1-5.
