HUGO E. ARCE
Departamento de Salud Pública, Instituto Universitario de Ciencias de la Salud, Fundación Barceló
Resumen Frente al incontenible incremento en los costos de las innovaciones terapéuticas, los sistemas de salud enfrentan graves dificultades para mantener la sustentabilidad de sus fuentes de financiamiento. Una de las modalidades posibles en Argentina es la implementación de un reaseguro para enfermedades de “baja incidencia y alto costo”, calificadas como “catastróficas”. Hasta el momento ese reaseguro solo ha sido implementado para enfermedades y tratamientos taxativamente definidos en las obras sociales sindicales o seguros sociales obligatorios. Los costos de la prima de un reaseguro universal para todas las formas de cobertura requieren estimaciones muy complejas, cuya estructura es ejemplificada. Otra modalidad de análisis consiste en evaluar la consistencia científica de las innovaciones terapéuticas. A tal fin existen agencias de evaluación de tecnologías sanitarias, cuyos ejemplos en Europa y América Latina son mencionados. Pero la perspectiva futura es difícil para todos los países, que se encuentran ante la judicialización que pueden presentar los beneficiarios de sistemas de protección y los argumentos interpuestos por los responsables de brindar los beneficios reclamados.
Palabras clave: medicamentos de alto costo, enfermedades catastróficas, cobertura de gastos catastróficos, planes de salud, financiamiento de salud
Abstract In view of the uncontrolled increase in the costs of therapeutic innovations, the health systems face serious difficulties in maintaining the sustainability of their funding sources. In Argentina, one alternative is the implementation of a reinsurance for “low incidence and high cost” diseases classified as “catastrophic”. So far, the healthcare systems managed by trade unions and compulsory social insurance have only implemented this reinsurance for specifically-defined diseases and treatments. The cost estimate of a universal reinsurance premium for all forms of coverage requires very complex calculations, whose structure is exemplified. Another approach is the analysis of the scientific consistency of therapeutic innovations, as performed by health technology assessment agencies, whose examples in Europe and Latin America are mentioned. However, the prospects are difficult for all countries, in view of the demands for legalization expected to be presented by beneficiaries of protection systems and the arguments interposed by those responsible for providing the claimed benefits.
Key words: high-cost health care, catastrophic illness, managed care programs, healthcare financing
Dirección postal: Hugo E. Arce, Paraguay 631 6º B, 1057 Buenos Aires, Argentina
e-mail: arce@satlink.com
A partir de la década del 50, la industria farmacéutica del hemisferio occidental desarrolló un proceso de innovación de nuevos productos, cuyo crecimiento exponencial alcanza hasta nuestros días. Los diversos sistemas sanitarios esquemáticamente se fueron organizando en base a dos modelos genéricos: a) los servicios nacionales de salud, en los que los recursos pertenecen al estado y se financian mediante impuestos generales, y b) los de seguridad social, donde los recursos pueden ser estatales o privados y se financian mediante alícuotas del salario 1.
Hacia fines del siglo XX los diversos modelos se fueron adecuando para afrontar dos fenómenos universales, que se verifican tanto en los países industrializados como en los de medianos ingresos: a) la transición epidemiológica, donde la carga de enfermedad va desplazándose desde el predominio de las enfermedades infectocontagiosas hacia el de las condiciones crónicas inherentes a mejores niveles socioeconómicos; y b) la transición demográfica, debida a que se extiende la expectativa media de vida y los mayores de 65 años crecen proporcionalmente en la pirámide poblacional, acompañando la progresiva urbanización de la población.
Ya en la década del 70, estudios económicos de la industria farmacéutica en expansión internacional mostraban que las inversiones en investigación y desarrollo se amortizaban en los primeros dos años de comercialización, mediante precios sobredimensionados, hasta que el uso de los nuevos productos se imponía en el mercado, se otorgaban licencias a otras empresas productoras, o simplemente eran reemplazados por nuevas drogas que perfeccionaban las anteriores. En esas condiciones, las innovaciones se limitaban a precios razonablemente asociados a los costos de producción. La formulación de sucesivos medicamentos − ya fuera por la adición de otros radicales a la molécula original o por el hallazgo de nuevos productos de acción realmente innovadora − era un motor de su evolución económica con el fin de sostener una alta tasa de retorno 2. Comportamientos similares se han observado en todos los países con la introducción de nuevas tecnologías de diagnóstico.
Una de las ramas industriales que se anticipó a la globalización a partir de la década del 80 fue la farmacéutica, dado que las empresas transnacionales mostraron un particular dinamismo para comprar activos de industrias nacionales y organizar redes multinacionales de investigación, producción, fraccionamiento y distribución. Frente a estos mercados tempranamente globalizados, no existen organismos internacionales con capacidad de regulación suficiente, para establecer condiciones de comercialización (fijan sus precios según las características del mercado de cada país), limitaciones en la cobertura, análisis de eficacia terapéutica e incorporación de innovaciones a guías de práctica clínica. De hecho, la Organización Mundial de la Salud puede hacer recomendaciones y normatizar, pero carece de poder fiscalizador, de modo que los países que no contaban con organismos propios para hacerlo, debieron adherir a las decisiones adoptadas por organismos equivalentes de EE.UU., el Reino Unido o la Comunidad Europea. Desde la década del 90, la influencia de las empresas farmacéuticas fue creciente en el financiamiento de investigaciones, planificación de ensayos terapéuticos, organización de eventos científicos y colaboración de líderes de opinión en diversas especialidades, incluyendo publicaciones. En algunos casos, ciertos consensos técnicos pueden desplazar los umbrales de normalidad, induciendo un mayor consumo de las medicaciones crónicas asociadas.
Las innovaciones farmacológicas de costos no sustentables se han expresado especialmente en el campo de
las drogas oncológicas y en el de algunas enfermedades genéticas. Algunos ejemplos pueden ilustrar este proceso.
El ivacaftor para el tratamiento de una de las mutaciones de la fibrosis quística, tiene un costo de US$ 340 000/año.
El nusinersén, un oligonucleótido aprobado para la atrofia muscular espinal, tiene costos del orden de US$ 840 000/año y se administra por vía intratecal. En 2017, el costo de un tratamiento basado en la identificación celular personalizada para la leucemia infantil era de US $475 000.
Peter Bach, un médico experto en la estimación teórica del costo de drogas oncológicas, desarrolló una herramienta para calcular el valor de estas terapias, denominada Drug Abacus, en base a su importancia relativa, tolerancia, mecanismo de acción, frecuencia y costo de un año de supervivencia. Una estimación del gasto en 52 drogas oncológicas, aplicado comparativamente mediante esa herramienta en el Medicare de EE.UU. y el National Health Service del Reino Unido (NHS) mostró que en EE.UU. los precios están sobredimensionados en un 80%, mientras que en el NHS están subdimensionados en un 50%.
Frente a un gasto anual estimado por el DrugAbacus de US$ 27 billones, Medicare erogó US$ 32 billones, en tanto el NHS gastó US$ 14.5 billones. Para revisar los costos crecientes de las innovaciones, el National Institute for Health and Care Excellence (NICE) creó un fondo especial de US$1.8 billones (1800 millones), que permitió al NHS mejorar el acceso a tratamientos innovadores, evitando los que no fueran costo-efectivos. Algunas grandes compañías farmacéuticas implementaron ciertas garantías: p.ej. Novartis reintegra el costo de tisagenlecleucel para pacientes que no hayan tenido mejoras dentro de los 30 días posteriores al tratamiento de ciertas leucemias (US$ 475 000). Roche proveyó trastuzumab a Kenya en 2016, para tratar cáncer de mama a un grupo reducido de pacientes, compartiendo el precio por mitades con el
Ministerio de Salud (US$ 195 000) 3.
¿Cómo enfrentan los países estos gastos exorbitantes −calificados como “catastróficos”− que exceden todo tipo de previsiones? En Argentina las obras sociales (OS’s) sindicales contribuyen a un Fondo Solidario de Redistribución (FSR), que permite el reembolso de los gastos por enfermedades de “baja incidencia y alto costo”. Las enfermedades comprendidas están taxativamente establecidas a través de revisiones cada dos años (aunque las innovaciones son permanentes), e incluyen enfermedades genéticas que requieren tratamientos de alto costo, trasplantes, prótesis implantables, rehabilitación integral de discapacitados y ayuda social para ciertas catástrofes naturales. La administración del programa tuvo períodos de gestión seriamente objetados; además quedan excluidas las OS’s provinciales, el PAMI, las OS’s universitarias, de las fuerzas armadas y de seguridad, de los poderes legislativo y judicial y la medicina prepaga, ya sea porque no son reguladas por la Superintendencia de Servicios de Salud o porque no contribuyen al FSR. En función de esas limitaciones, se han propuesto seguros de enfermedades catastróficas, con el fin de alcanzar a otras coberturas y revisar las enfermedades comprendidas 4. Cabe señalar que en EE.UU. el rubro de “enfermedades catastróficas” forma parte de los tramos opcionales para fijar el monto de la prima al contratar seguros de salud en las Health Maintenance Organizations.
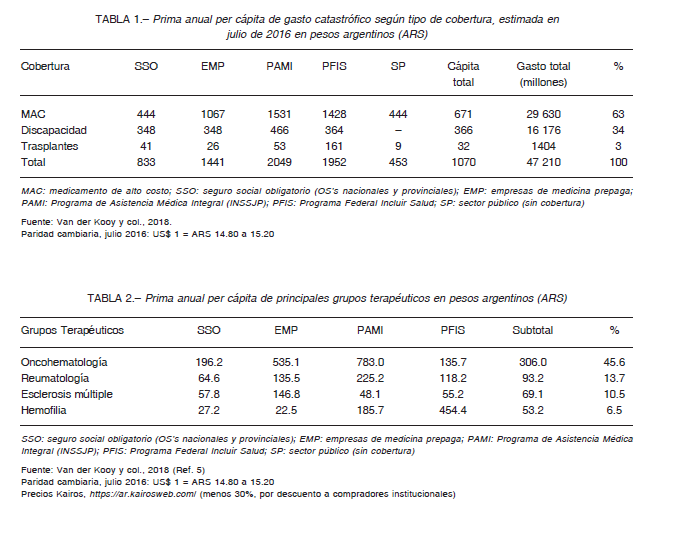
En Argentina no existe una agencia que concentre la información sobre gasto en salud, y ni siquiera la Secretaría de Gobierno de Salud logra recopilar esos datos en forma sistemática, de modo que debe recurrirse a laboriosas estimaciones en base a múltiples fuentes fragmentadas. A fin de contar con algunas dimensiones sobre el gasto per capita necesario para que un seguro pueda cubrir medicamentos de alto costo (MAC) a julio de 2016, conviene recurrir a un estudio específico que contempló los precios vigentes en ese momento, teniendo en cuenta las respectivas distribuciones de frecuencias de uso 5. Para no dispersar el análisis, se considerarán en principio el conjunto de gastos, que debería incluir prestaciones de rehabilitación y de trasplantes (Tabla 1), para luego concentrarnos en los MAC, que son el objeto de este artículo, con el fin de aproximarnos al costo completo de una prima de seguro para “enfermedades catastróficas”. En caso de existir la decisión política de un reaseguro universal de “enfermedades catastróficas” para todas las modalidades de cobertura existentes, deberían prorratearse según la magnitud de las poblaciones a ser cubiertas, ya que un reaseguro de esta naturaleza solo resultaría actuarialmente viable si estuviera comprendida la totalidad de la población del país. Por ser una modalidad de distribución de los riesgos de eventuales siniestros, los seguros y reaseguros son prospectivamente más sustentables cuanto mayor es la escala de usuarios asegurados.
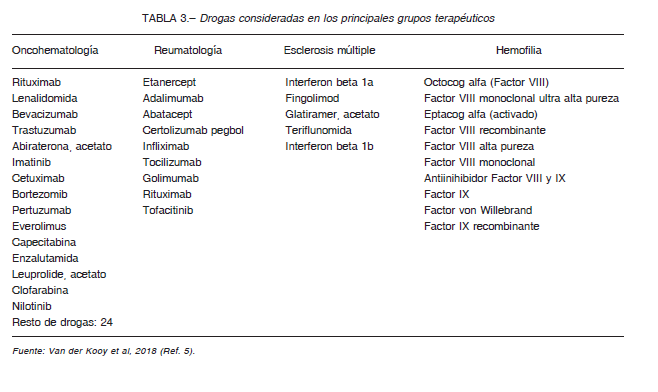
En la Tabla 2, se presentan desagregados los principales grupos de MAC manteniendo la discriminación del gasto según el tipo de cobertura. Para definir los componentes de estas estimaciones, cabe enumerar las principales drogas que fueron consideradas (Tabla 3).
Resultaría imposible incluir la totalidad del arsenal terapéutico, ya que la introducción de nuevas drogas se produce en forma muy dinámica y, dado que no existen registros oficiales de consumo, las estimaciones deben basarse retrospectivamente en los gastos acumulados por las diversas modalidades de seguros las que, a su vez, se encuentran extremadamente fragmentadas. Los datos presentados tienen el valor de aproximaciones de razonable consistencia, a los fines de ilustrar decisiones políticas tendientes a integrar la dispersión de recursos del sistema de salud, sin abarcar la totalidad de tratamientos protegidos.
En estas enumeraciones no fueron incluidas todas las enfermedades de baja incidencia y alto costo tuteladas por las diversas modalidades de cobertura. Deberían agregarse: artritis gotosa grave, artritis idiopática juvenil sistémica, síndrome autoinflamatorio asociado a criopirinas, asma perenne, déficit de alfa 1-antitripsina, degeneración muscular, enfermedades de Fabry, Gaucher y Pompe, hemoglobinuria paroxística nocturna, síndrome urémico-hemolítico atípico, hipertensión pulmonar, mucopolisacaridosis I, II y VI, sobrecarga de hierro y tirosinemia hereditaria tipo I.
A efectos de enfrentar los nuevos desafíos a la sustentabilidad de los sistemas de salud que implican las innovaciones terapéuticas, así como determinar la consistencia científica de las investigaciones que las avalan, muchos países han creado organismos de evaluación de tecnologías sanitarias (ETS) de diversas naturalezas, adecuados al ordenamiento institucional local. A título de ejemplo, se mencionan las más importantes de Europa y América Latina: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) en Alemania; Red Española de Agencias de Evaluación de Tecnologías Sanitarias (Comunidades Autónomas) en España; Haute Autorité de Santé (HAS) en Francia; NICE (ya mencionado) en Inglaterra; Statens Beredning för Medicinsk Utvärdering (SBMU) en Suecia. Todas forman parte de la International Network Agencies of Health Technology Assessment (INAHTA). En América Latina pueden mencionarse: Comissão Nacional de Incorporação de Tecnologías no SUS (CITec) en Brasil; Instituto de Evaluación Tecnológica en Salud (IETS) en Colombia; Centro Nacional de Excelencia Tecnológica en Salud (CeNETec) en México 6.
En 2016, el gobierno de Argentina envió al Congreso un proyecto de creación de la Agencia Nacional de Evaluación de Tecnologías Sanitarias (AgNET), que tuvo un prolongado debate parlamentario, ya que se le opuso otro proyecto de una Agencia Federal de Evaluación de Tecnologías Sanitarias (AFETS), con lo que el problema técnico tendió a politizarse. Por ese motivo, en 2018 el proyecto original fue reformulado y enviado nuevamente al Senado. Al menos en nuestro país, el problema espera un prolongado procesamiento antes de ser efectivo, así como un alto riesgo de resignar objetividad científica en función de su viabilidad parlamentaria. Pero más allá de las ineficiencias y fragmentaciones institucionales atribuibles a nuestro sistema de salud, la ETS no es un tema menor aun para las organizaciones sanitarias mundiales más eficaces y prestigiosas. Como lo expresó en 2012 Sir Michael Rawlins, entonces presidente del NICE: “… ningún país del mundo tiene los suficientes recursos para poder proveer a todos sus ciudadanos la totalidad de los servicios con los máximos estándares de calidad posibles; cualquiera que crea lo contrario vive en el País de las Maravillas” 6.
El abordaje de la ETS no es solamente un área de interés para el campo de la innovación científica, sino que también tiene amplias derivaciones en el campo jurídico, donde están en juego los derechos de los individuos a acceder a los recursos terapéuticos más avanzados, cuya cobertura es cuestionada por los diferentes medios de financiamiento de salud. Frente a la opción de una probable mejoría en el pronóstico de una enfermedad o el riesgo de sustentabilidad financiera de la entidad aseguradora, los jueces siempre fallan a favor del individuo afectado, aunque las probabilidades sean remotas. Pero estos conflictos no solo se ventilan en estrados judiciales, sino también en medios de difusión masiva. Un prestigioso experto en cáncer de mama manifestó en un reportaje que “la inmunoterapia es una modalidad de tratamiento y la terapia personalizada se adapta a las necesidades de cada persona con su tumor” 7. ¿Qué juez se atrevería a oponerse al pedido de un paciente, frente a fundamentos respaldados por estas afirmaciones?
Agradecimientos: Al Dr. Basilio Kotsias por haber facilitado fuentes bibliográficas. Asimismo a la Dra. Ma. Cecilia Salazar Güemes por sus comentarios en la revisión del manuscrito.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Arce H. Organización y financiamiento del sistema de salud en Argentina. Medicina (B Aires) 2012; 72: 414-8.
2. Katz J. La industria farmacéutica argentina. Estructura y comportamiento. Buenos Aires: Instituto Torcuato Di Tella, Centro de Estudios Económicos, 1973. En: http://lanic.utexas.edu/project/laoap/utdt/cie/dt/067.pdf; consultado marzo 2019.
3. Dolgin E. Bringing down the cost of cancer treatment. Nature 2018; 555: S26-9.
4. Tobar F, Liftschitz E. Seguro Nacional de Enfermedades Catastróficas. Propuestas y fundamentos. Buenos Aires: Equipos Argentinos de Salud S.A., CIPPEC, 2011.
5. Van der Kooy E, Torres R, Solmesky S, et al. Gasto Catastrófico en Salud. Isalud-Prosanity-CEMIC, Buenos Aires, 2018.
6. Lifschitz E (coordinator) et al. Agencia de evaluación de tecnologías sanitarias en Argentina ¿Por qué, para qué, cómo?, 1a ed. adapted. Buenos Aires: Fundación Sanatorio Güemes, 2018, p 344. En: http://www.fsg.com.ar/facebook/ediciones_pdf/agenciaETS.pdf; consultado marzo 2019.
7. Czerwacki A. Hay que cambiar la percepción que la gente tiene del cáncer. No es una enfermedad incurable (entrevista Fabrice André), Clarín. Marzo 3, 2019, p 38. En: https://www.pressreader.com/argentina/clarin/20190303/281921659345557; consultado marzo 2019.
– – – –
Cuidará [el médico] que la influencia de la enfermedad en la psique del enfermo no ocasione depresión o angustia, y si éstas aparecen a pesar de todo, le prestará atención debida pues no es al corazón que estamos tratando, sino a todo el individuo. Será su preocupación la de no someter al enfermo a exámenes innecesarios, sobre todo que no se lo estudie “a muerte” como decía Whipple con agudeza. Tendrá suficiente personalidad para resistir las presiones del ambiente o las que produzca su propia angustia para que al enfermo no se lo hospitalice sin necesidad. Tratará que el gasto que requiera el proceso de enfermedad sea el menor posible, y esto no solamente en los enfermos que no tengan “cobertura” económica, sino aun en aquellos a los que entidades estatales o seguros les pagan los gastos de internación, pues dilapidar o gastar innecesariamente ocasiona el aumento de las primas de los seguros o la insolvencia de los mecanismos de previsión. Y en todo esto, tanto la parte exclusivamente médica como el aspecto psíquico, social y económico, es tarea del médico que debe estar, cualquiera sea su jerarquía, al servicio del enfermo. Sir Robert Hutchinson sintetizaba con precisión y elocuencia las cualidades que debería tener el médico en su época y que me animo a decir en todas las épocas: “Líbrenos Dios de interferir en el proceso de curación espontáneo, de entusiasmarse con lo nuevo y despreciar lo viejo, de anteponer erudición antes que sabiduría, ciencia con exclusión del arte, “viveza” antes que sentido común, de tratar los enfermos como casos clínicos, y de hacer el tratamiento de la enfermedad más penoso y fatigoso que la misma enfermedad”.
Alfredo Lanari (1910-1985)
Reflexiones sobre la investigación y el futuro de la Medicina (1974). Conferencia pronunciada en el VI° Congreso Internacional de Cardiología el 2 de setiembre de 1974, Buenos Aires, con el título Conferencia Houssay. En: Vocación y convicción. Fundación Alfredo Lanari; Buenos Aires, 1995, p 156-7
