LUCAS ALESSANDRO 1, LISANDRO E. OLMOS 2*, LUCAS BONAMICO 2, DIANA M. MUZIO 2, MARTINA H. AHUMADA 2, MARÍA JULIETA RUSSO 3, 4, RICARDO F. ALLEGRI 3, 4, MATIAS G. GIANELLA 5, HORACIO CAMPORA 5, RICARDO DELORME 6, MARIA ESTHER VESCOVO 2, VANINA LADO 7, LILIANA R. MASTROBERTI 8, AYELEN BUTUS 5, HUGO D. GALLUZZI 9, GRACIELA DÉCIMA 9, SEBASTIAN F. AMERISO 10
1 Departamento de Neurología, 2 Departamento de Medicina de Rehabilitación, 3 Departamento de Rehabilitación Cognitiva y Lenguaje, 4 Departamento de Neurología Cognitiva, Neuropsiquiatría y Neuropsicología, Centro de Memoria y Envejecimiento, 5 Departamento de Kinesiología, 6 Departamento de Medicina Interna, 7 Servicio de terapia ocupacional, 8 Servicio de Nutrición, 9 Departamento de Enfermería, 10 Departamento de Neurología Vascular, Centro Integral de Neurología Vascular, Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI), Buenos Aires, Argentina
Resumen Se estima que dos tercios de las personas que han sufrido un accidente cerebrovascular (ACV) tienen secuelas que condicionan su calidad de vida. La rehabilitación del ACV es un proceso complejo, que requiere de un equipo multidisciplinario de profesionales especializados (médicos, kinesiólogos, enfermeros, terapistas ocupacionales, fonoaudiólogos, neuropsicólogos y nutricionistas). Actualmente, las prácticas realizadas en rehabilitación son consecuencia de la combinación de evidencia y consenso, siendo la mayoría aportadas a través de guías internacionales de rehabilitación en ACV. El objetivo de esta revisión es ajustar las recomendaciones internacionales sobre rehabilitación a lo aplicado a la práctica diaria, a fin de unificar criterios en las recomendaciones y reducir la variabilidad de las prácticas empleadas. En este trabajo, se realizó una revisión de la literatura sobre las guías de rehabilitación en ACV realizadas en los últimos 10 años y cada apartado fue supervisado por distintos profesionales especializados en dichas áreas. Se analizaron los tiempos y organización necesaria para desarrollarla, las recomendaciones para la rehabilitación motora, cognitiva y visual, el tratamiento de la disfagia y nutrición, de las comorbilidades (trombosis venosa, úlceras cutáneas, dolor, trastornos psiquiátricos, osteoporosis) y las tareas necesarias para favorecer el retorno a las actividades de la vida diaria.
Palabras clave: accidente cerebrovascular, discapacidad en adultos, rehabilitación
Abstract It is estimated that two thirds of people who have suffered a stroke have sequels that condition their quality of life. The rehabilitation of the stroke is a complex process, which requires the multidisciplinary approach of specialized professionals (doctors, kinesiologists, nurses, occupational therapists, phonoaudiologists, neuropsychologists and nutritionists). Currently, the practices carried out are a consequence of the combination of evidence and consensus, most of them through international stroke rehabilitation guides. The objective of this review is to adjust the international recommendations on stroke rehabilitation to what is applied to daily practice, in order to unify the criteria of the recommendations and to reduce the variability of the practices carried out. This work is a review of the literature on stroke rehabilitation guides developed in the last 10 years. Each section was supervised by different professionals specialized in these areas. We analyze the time and organization necessary to develop rehabilitation, recommendations for motor, cognitive and visual rehabilitation, the management of dysphagia and nutrition, the approach of comorbidities (venous thrombosis, skin ulcers, pain, psychiatric disorders and osteoporosis) and the necessary tasks to favor the return to the activities of daily life.
Key words: stroke, adults´ disability, rehabilitation
Dirección postal: Lucas Alessandro, Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI), Montañeses 2325, 1428 Buenos Aires, Argentina
e-mail: lalessandro@fleni.org.ar
El accidente cerebrovascular (ACV) representa una de las causas más frecuentes de mortalidad y morbilidad en todo el mundo. En Argentina se registran 76.5 casos cada 100 000 habitantes todos los años 1. A pesar de los protocolos cada vez más actualizados sobre el tratamiento agudo del ACV a nivel mundial, un porcentaje menor (5.7%) en nuestro país consulta a tiempo para recibir el tratamiento inicial adecuado y solo el 1% recibe tratamiento trombolítico 2, 3. Dos tercios de aquellos que han sufrido un ACV tienen secuelas que afectan su calidad de vida y requieren rehabilitación 4. La misma es un proceso progresivo y dinámico, orientado hacia el objetivo de permitir alcanzar un óptimo estado físico, cognitivo, emocional, social y funcional. El tratamiento de esta enfermedad es complejo e involucra a un grupo multidisciplinario de profesionales de la salud (médicos, kinesiólogos, enfermeros, terapistas ocupacionales, fonoaudiólogos, psicólogos y nutricionistas), incluyendo en los últimos años al propio paciente y cuidadores como parte importante del equipo de rehabilitación 5, 6. Recientemente se ha incrementado el número de trabajos publicados sobre este tema. Sin embargo, muchos de los mismos cuentan con escaso número de pacientes y la rigurosidad metodológica es menor en comparación con otros tipos de ensayos clínicos. Por lo tanto, la información y las recomendaciones sobre esta temática son consecuencia de una combinación entre evidencia y consenso.
El objetivo de esta revisión es ajustar las recomendaciones internacionales sobre rehabilitación en ACV a lo aplicado en la práctica diaria, a fin de unificar criterios en las recomendaciones y reducir la variabilidad de las prácticas realizadas, optimizando su eficiencia. Para ello se realizó una revisión de la literatura sobre las guías de rehabilitación en ACV realizadas en la última década y cada apartado fue supervisado por un especialista en dicha área.
Organización de la rehabilitación en ACV
Etapa aguda (intrahospitalaria)
El tiempo de inicio e intensidad exacta de la rehabilitación en ACV es un tema controvertido. Sin embargo, la evidencia demuestra que es beneficioso iniciarla tan pronto como el paciente esté listo y pueda tolerarla (> 24 h del inicio del evento), con una intensidad suficiente (combinación de las terapias > 3 h al día) 5-7. La movilización temprana durante las primeras 24-72 h, debe realizarse con precaución en aquellos que han tenido una punción arterial (ej., por haberse realizado trombectomía mecánica), o presenten cualquier condición médica que lo desestabilice (deterioro del sensorio, desaturación de oxígeno, fracturas en la extremidad inferior, infecciones) 6. Resulta necesaria la formación de equipos multidisciplinarios especializados encargados de iniciarla tempranamente, aun en las unidades cerebrovasculares o de terapia intensiva 5, 6, 8.
Etapa subaguda-crónica (post-hospitalaria)
El sitio y modalidad donde realizar la rehabilitación cerebrovascular post-hospitalaria deberían ser acordes a la complejidad y grado de dependencia del caso particular.
Aquellos con un alto grado de complejidad y dependencia, que necesitan contacto regular de un médico, múltiples intervenciones terapéuticas y enfermería continua, requerirán internación en centros de rehabilitación especializados (Tabla 1) 5, 6. No obstante, no se recomienda la inclusión de pacientes con enfermedad terminal, con supervivencia limitada y con demencia previa al ACV 6.
Existe un grupo con complejidad intermedio o bajo que puede beneficiarse de rehabilitación ambulatoria con el mismo nivel de eficiencia que la hospitalaria8. Incluso, la rehabilitación ambulatoria en casos seleccionados disminuye los índices de readmisión hospitalaria, riesgo de efectos adversos y costos generales en la atención, aumentando la probabilidad de independencia 8, 9. No obstante, debe asegurarse que sean los adecuados (terapéutica multidisciplinaria igual a la recibida en internados) y que el paciente sea capaz de asistir por sus propios medios a las terapias o cuente con el apoyo del familiar/cuidador 5, 6, 10. Un tipo de modalidad de rehabilitación ambulatoria es mediante la utilización de centros de rehabilitación con servicio de hospital de día. En todos los casos ambulatorios, debe asegurarse que las terapias de cada una de las especialidades requeridas duren al menos 45 minutos y que se desarrollen durante 2-5 días de la semana de acuerdo la necesidad de cada paciente, por lo menos durante 2 meses 6.

La rehabilitación es un proceso dinámico, variando el nivel de complejidad a lo largo de la evolución. Por dicho motivo, los planes deben revisarse con una periodicidad menor a 30 días 5, 6. La rehabilitación cerebrovascular tiene mayor rédito cuanto antes se inicie. Algunas guías muestran que hasta un año desde el alta hospitalaria podría prevenir el deterioro funcional y mantener las actividades de la vida diaria (AVD) 8. Tanto para modalidades de internación como ambulatorias, las diferentes disciplinas deben tener un espacio de reunión formal interprofesional por semana para discutir el progreso y los problemas que subyacen al proceso de rehabilitación, para ir redefiniendo objetivos a corto y largo plazo 5,6.
Rehabilitación motora en ACV
Rehabilitación motora de miembros inferiores y de la marcha
Uno de los déficits neurológicos más relevantes en los pacientes con ACV son los trastornos de la marcha, siendo la rehabilitación motora fundamental para lograr mayor grado de independencia. Se recomienda realizar entrenamiento intensivo, repetitivo y movilidad-tarea para aquellos con trastornos de la marcha. El mismo consiste en actividades como transferencias (silla de ruedas-cama o cama-silla) ponerse de pie, sentarse, subir escaleras y girar sobre su propio eje 11. Las terapias de circuito, son un tipo de intervención grupal en la cual el paciente va circulando por distintas estaciones de ejercicios centrados en la práctica repetitiva de tareas funcionales. Ejercicios sobre cinta adicionados a la rehabilitación convencional caminando sobre el suelo puede ser razonable, aunque no se ha demostrado diferencias significativas entre ambas en pacientes que deambulan. Sin embargo, la caminata asistida mecánicamente con soporte de peso corporal (entrenador electromecánico de marcha, dispositivos robóticos) podría ser considerada útil en etapas tempranas (<3 meses) solo en aquellos que no deambulan 12. Es importante incluir también rehabilitación motora selectiva utilizando diferentes técnicas manuales para sumar estímulos (estimulación multisensorial) y mejorar la calidad y confort de la recuperación motora 13. Ejemplos de técnicas manuales son el estiramiento de facilitación neuromuscular propioceptivo (PNF) y el método Bobhath. Este último consiste en inhibir el tono y los patrones de movimiento anormales, facilitando el movimiento normal y estimulando en casos de hipotonía o inactividad muscular.
El uso de equipamiento ortésico tobillo-pie (AFO) puede favorecer la marcha. Se recomienda para aquellos con debilidad de dorsiflexores y caída del pie 14. La estimulación eléctrica funcional (FES) es una ortesis electrónica que también favorece la recuperación de la marcha al aplicarse sobre los músculos dorsiflexores del tobillo 15.
Aunque no existe suficiente evidencia para recomendar el uso de ciertos fármacos para favorecer la movilidad o la marcha, existen algunos trabajos que muestran que la fluoxetina 16 o L-DOPA 17 podrían beneficiar la recuperación motora.
La realidad virtual puede ser beneficiosa para mejorar la marcha, al promover un medio que genere mayor motivación para el paciente 18, aunque el acceso a este tipo de tecnologías puede ser dificultoso.
Rehabilitación motora de miembros superiores
Las tareas funcionales deben estar basadas en el entrenamiento específico de una tarea, mejorando el rendimiento de la acción y favoreciendo el aprendizaje repetido de una habilidad motora 19. Todos los pacientes deben ser entrenados en tareas habituales de la vida diaria, con o sin instrumental. Las terapias de movimiento inducido por restricción son razonables para utilizar (ej., restricción de los movimientos del tronco compensatorios, pueden favorecer la rehabilitación proximal). Los ejercicios de fortalecimiento pueden ser utilizados como complemento a la tarea funcional 20. En aquellos con plejía o debilidad grave, puede considerarse la rehabilitación robótica como opción, favoreciendo principalmente las actividades de la vida diaria sin claro beneficio sobre la fuerza 21. También la estimulación multisensorial brindada por los conceptos y métodos de Bobhat y PNF, son beneficiosos a la hora de buscar selectividad de movimiento 13.
La utilización de la FES puede considerarse como tratamiento de la subluxación y dolor del hombro hemipléjico, dentro de los primeros meses después del ACV 22.
También se aplica en los músculos de la mano y muñeca combinados con entrenamiento tarea específica 23. La utilización de realidad virtual y las técnicas basadas en la práctica o imaginería mental pueden ser consideradas como complemento para la rehabilitación de la extremidad superior. Las terapias en espejo son otras técnicas complementarias que pueden tener utilidad 6.
Tratamiento de la espasticidad. Prevención y cuidados de contracturas articulares
Uno de los pilares fundamentales en el tratamiento de la espasticidad es la aplicación de toxina botulínica. En los músculos de la extremidad superior, se recomienda para mejorar el rango de movimiento pasivo y/o activo, el vestir y la higiene, como así también las posiciones viciosas de las extremidades 24. En los miembros inferiores, para reducir la espasticidad de los músculos que interfieren con la función de la marcha 25. El tratamiento farmacológico es más beneficioso para aquellos con espasticidad generalizada, pero su uso puede ser limitado debido a los efectos secundarios (por ej., sedación). Los más utilizados son baclofeno, dantroleno y tizanidina 5,6. La terapia intratecal con baclofeno puede reservarse para aquellos pacientes con espasticidad grave que no responden a otras intervenciones 26.
La FES o la aplicación de vibración sobre los músculos espásticos pueden ser razonables para mejorar la espasticidad temporalmente, como un complemento a la terapia de rehabilitación 27.
Las contracturas articulares pueden reducir el rango de movilidad y causar dolor. Los movimientos pasivos
de estiramiento de la mano y la utilización de férulas, pueden ser útiles para prevenir la formación de las mismas en pacientes sin movimiento activo de la mano 28.
Las férulas en los tobillos también tienen una efectividad similar 29. En pacientes hemipléjicos, puede ser necesario la movilidad pasiva de los hombros (ej., rotación externa forzada) durante al menos 30 min al día todos los días 30.
La combinación de férulas de descanso y aplicación temprana de toxina botulínica, por ejemplo aplicada sobre los músculos flexores de muñeca y dedos, también puede resultar beneficiosa. En aquellos con contracturas graves o dolor refractario, pueden considerarse cirugías de liberación de tendones (ej., braquial, braquiorradial) 31.
Rehabilitación de la taxia y balance. Profilaxis de caídas
Hasta el 70% de las personas con ACV presentan caídas durante los primeros 6 meses después del alta hospitalaria32, con mayor riesgo de fracturas. Muchos desarrollan miedo a las caídas, que condiciona la rehabilitación y aumenta aún más el riesgo de las mismas. El incremento se debe a: disminución de la fuerza muscular, marcha alterada, alteración del equilibrio, uso de múltiples medicamentos y antecedente previo de caídas 33. Las escalas más utilizadas para predecir su riesgo son la Morse Fall Scale 34 y la Berg Balance Scale 35. Los programas de prevención deben iniciarse de forma temprana, incluso, previo al alta hospitalaria 5. Deben ir dirigidos al paciente y sus cuidadores, brindando información específica aplicada sobre las modificaciones necesarias en su hogar para disminuir este tipo de accidentes5. Durante la internación, otras medidas preventivas útiles son: menor altura de la cama, barandas elevadas, luz tenue por la noche y timbre de llamada cercano.
Se recomienda realizar ejercicios de entrenamiento de equilibrio 36. Los que han demostrado mayor eficacia son el Tai Chi 37, el entrenamiento postural y la terapia orientada a la tarea. El uso de dispositivos y aparatos ortopédicos (ej., bastón, AFO) también mejoran el balance.
Elección de dispositivos de soporte y sillas de ruedas
Más de la mitad de los pacientes con ACV requieren de algún tipo de dispositivo de soporte para ayudar a la movilidad 38. Los mismos deben ir de acuerdo con la necesidad de cada uno: a) bastón de un solo punto, que brinda una limitada mejora del equilibrio y estabilidad; b) bastón de 3 o 4 puntos, que ofrecen mayor estabilidad, aunque son más pesados, incómodos y pueden influir negativamente la recuperación postural; y c) caminadores de 2-4 ruedas, que soportan más peso corporal y son más eficientes energéticamente, aunque requieren del uso de ambos brazos y piernas, y no pueden ser utilizados en las escaleras. Hasta el 40% de los pacientes requieren al menos el uso transitorio de sillas de ruedas antes del alta hospitalaria. La misma debe utilizarse en quienes no deambulan o presentan una capacidad muy reducida 39. La correcta prescripción de una silla de ruedas (manual o motorizada; ajustada a cada necesidad) puede aumentar la participación en la rehabilitación y mejorar la calidad de vida.
Disfagia y nutrición
La disfagia se presenta frecuentemente (42-67%) dentro de los primeros 3 días del ACV, provocando en la mitad de los casos aspiración y en un tercio neumonía 40. Otras consecuencias son: desnutrición, deshidratación, pérdida de peso y disminución de la calidad de vida.
La evaluación de la deglución y estado nutricional en pacientes con ACV agudo debe hacerse tan pronto el estado de conciencia de éstos lo permita (primeras 24-48 h, con revaluación semanal) 41-43, a fin de disminuir las complicaciones clínicas, hospitalización prolongada, mortalidad y costos. Debe ser realizada por personal entrenado 5, 6 y antes de ofrecer alimentos, medicación y bebidas. Se sugiere iniciar la alimentación por vía oral solo cuando el patrón de alerta sea máximo 44.
La primera evaluación clínica de la deglución tendrá un valor predictivo y no de diagnóstico definitivo. Si existen signos clínicos de disfagia, se proyectará la evaluación instrumentada. No está totalmente establecido qué material instrumental debería ser el adecuado 5, 6. Los métodos son: videofluoroscopia y evaluación endoscópica con fibra óptica o evaluación endoscópica con fibra óptica con pruebas sensoriales 5, 6.
Una vez establecido el diagnóstico y gravedad de disfagia, se trazará el plan terapéutico más adecuado. Si la vía oral es insegura o insuficiente, se deberá valorar opciones de soporte nutricional. En caso de requerir sonda nasogástrica (SNG), la misma debe colocarse antes de los 3 días post-ACV 6, 45. Cuando existe alto riesgo de aspiración, se recomienda la alimentación pospilórica (preferentemente a yeyuno, más allá del ángulo de Treitz), a infusión continua46. La alimentación por gastrostomía, preferentemente endoscópica percutánea (GEP), se debe considerar cuando se estima que se demorará >4 semanas en recibir un aporte nutricional y/o hídrico adecuado por vía oral 45, 47. La GEP está asociada con menos fallas de tratamiento, menos hemorragia gastrointestinal y mayor aporte nutricional 47. No obstante, con frecuencia se inicia con SNG ya que es considerada la opción más sencilla, menos invasiva y rápidamente reversible 48.
Si el paciente está clínicamente estable, suficientemente alerta y ha recuperado la capacidad deglutoria segura, puede iniciarse la transición hacia la alimentación oral.
Cuando se asegura ≥ 75% de su nutrición e ingesta de líquidos por vía oral durante 3 días, el soporte instrumental nutricional podrá suspenderse 49.
Los ejercicios de deglución, modificaciones posturales (alimentación en posición vertical 90°), consejos de seguridad y modificaciones dietéticas apropiadas, deben considerarse para el tratamiento de la disfagia 47. Puede resultar útil explicar dichos ejercicios tanto a los pacientes como a sus familiares6. Otras medidas que disminuyen el riesgo de neumonía aspirativa es la higiene oral, por ejemplo, con clorhexidina 45.
Los suplementos nutricionales solo están indicados en pacientes desnutridos o en riesgo de desnutrición, ya que no aportan mayores beneficios y provocan riesgo de hiperglucemia 5,50.
La resolución de la disfagia puede ocurrir días a meses siguientes al ACV, por lo cual es importante que personal capacitado verifique si el tratamiento indicado para la disfagia y nutrición siguen siendo seguros y eficaces después del alta 46.
Rehabilitación cognitiva
Se estima que hasta el 80% de los pacientes que han tenido un ACV experimentan uno o más síntomas cognitivos en algún punto del curso de la enfermedad. Cuando dichos déficits son persistentes, interfieren de forma negativa sobre los procesos de rehabilitación, limitan la participación en actividades sociales y dificultan el retorno laboral, lo que implica consecuencias negativas a nivel familiar y socioeconómico. Los sobrevivientes de un ACV tienen mayor riesgo de desarrollar deterioro cognitivo de forma progresiva, siendo la clásica demencia vascular el estadio terminal de dicha entidad 51.
La mayoría evidencia mejoras en su rendimiento cognitivo durante los primeros 3 meses, aunque la recuperación puede continuar durante al menos el primer año. Algunos de los mecanismos implicados en la recuperación son la espontánea, la mejora de la diasquisis, la neuroplasticidad y la reserva tanto cognitiva como motora.
La rehabilitación cognitiva es parte integral y fundamental en cualquier programa de rehabilitación neurológica (Fig. 1). El diseño de dichos programas debe basarse en modelos teóricos de referencia, en tareas jerárquicamente organizadas y en la repetición de dichas tareas. Existen varias técnicas: 1) modificación del ambiente (adaptación del entorno físico a las capacidades cognitivas); 2) estrategias compensatorias (utilización de comportamientos alternativos); y 3) técnicas de restauración de la función (tratamiento de los déficits neuropsicológicos subyacentes). La rehabilitación cognitiva no debe realizarse de forma aislada, sino combinada con actividad física y entrenamiento en actividades de la vida diaria 52. Además, la actividad física per se tiene un efecto protector contra el deterioro cognitivo 53, dado que aumenta el volumen sanguíneo cerebral y la expresión de factores neurotróficos. Los tratamientos farmacológicos (inhibidores de la acetilcolinesterasa, antidepresivos, atomoxetina, metilfenidato y modafinilo) no han demostrado mejoría del deterioro cognitivo post-ACV 5, por lo que su uso debe ser individualizado.
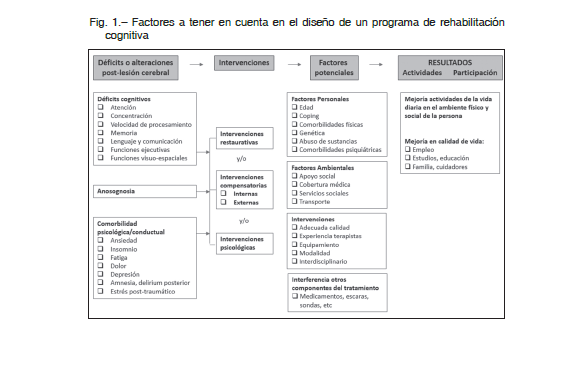
Existe buena evidencia de que la rehabilitación cognitiva es efectiva en el tratamiento de déficits más focales, como la de funciones visual-espaciales o afasia 54, mientras que faltan tratamientos efectivos para memoria 55 y funciones ejecutivas56, que a menudo se asocian a lesiones más difusas.
Evaluación de las funciones cognitivas después de un ACV
La detección de déficits cognitivos se recomienda para todos los que han sufrido un ACV antes del alta hospitalaria.
Cuando hay déficits cognitivos, debe realizarse una evaluación más detallada por un especialista en neuropsicología entrenado en lesiones adquiridas. Las áreas específicas que deben incluirse son: velocidad de procesamiento; atención simple y compleja (incluyendo memoria de trabajo); lenguaje y comunicación; habilidades visual-espaciales perceptivas y constructivas (Fig. 2); funcionamiento ejecutivo; y memoria.
Rehabilitación de la atención, la memoria de trabajo y la velocidad de procesamiento
Los trastornos de la atención, memoria de trabajo y velocidad de procesamiento (tríada cognitiva) deben ser atendidos de forma prioritaria y tratarlos en primer lugar para que la rehabilitación tenga éxito. Dicho tratamiento debe basarse en los modelos teóricos vigentes, siendo las redes atencionales de Posner el más aceptado 57. Este modelo considera que existen 3 sistemas de atención anatómicos y funcionalmente independientes: a) sistema posterior o de orientación (localización del input sensorial en el espacio); b) sistema anterior o de selección (componente ejecutivo encargado de seleccionar los objetivos de la atención); y c) sistema de alerta o vigilancia (mantiene estado preparatorio o de arousal general, necesario para la detección rápida del estímulo esperado). La mayoría de las intervenciones se basan en ejercicios y prácticas utilizadas dentro del paradigma de estímulo-respuesta. El enfoque utilizado se basa en la premisa de que la activación y estimulación repetida de los sistemas atencionales facilita cambios en la capacidad cognitiva, incrementando progresivamente la demanda atencional a medida que el paciente progresa.
Rehabilitación del lenguaje y la comunicación
La evaluación de la comunicación debe consistir en una entrevista completa, con análisis de la conversación y observación de la conducta del paciente, la administración de pruebas estandarizadas para evaluar el habla, el lenguaje, la comunicación cognitiva, la pragmática, la lectura y la escritura. Deben identificarse las fortalezas y debilidades comunicativas, y las estrategias compensatorias útiles.
La rehabilitación intensiva de los trastornos del lenguaje es beneficiosa, aunque no hay un acuerdo definitivo sobre el tiempo e intensidad óptimo 58. Parte del mismo consiste en incluir el entrenamiento de familiares y acompañantes, otorgando pautas que favorezcan la comunicación (Tabla 2) 59. En ocasiones, pueden beneficiarse de tratamientos grupales con pacientes en similares condiciones de compromiso del lenguaje (ej., grupos combinados con musicoterapia o tecnología asistiva) 60. Las terapias con tecnología asistiva mediante computadoras, podrían ser un complemento en el tratamiento 61. No obstante, este tipo de asistencia es particularmente útil en aquellos que tienen trastornos del habla como disartria o apraxia (ej., tableros de imágenes; tableros de ortografía) 62. La estimulación magnética transcraneana (TMS) solo tiene evidencia experimenta l5.

Rehabilitación de la negligencia espacial unilateral
La rehabilitación de la negligencia es complejo, debido a que existe dificultad para corregir todos los síntomas con un solo método. Debido a la naturaleza multifactorial del trastorno, la intervención elegida por el terapeuta debe tener valor clínico (duración del efecto y modificación de la conducta) y es necesario incluir estrategias para mejorar y/o compensar el registro del déficit (anosognosia). Las intervenciones en rehabilitación deben implementarse de forma repetitiva, considerando estrategias pasivas vs. activas, de restauración vs. compensación, bottom-up vs. top-down 63. Las estrategias bottom-up son aquellas en las cuales la manipulación de condiciones conductuales repercuten directamente en la ejecución de tareas observables, intentado corregir la heminegligencia sin la participación consciente del paciente. Dichas tareas se implementan a partir de dispositivos externos o manipulando el ambiente sensorial, facilitando la percepción del lado contralesional, con la ventaja de que no requieren necesariamente de la cooperación del paciente. En cambio, las estrategias topdown, son aquellas que desde el inicio buscan mediante el esfuerzo voluntario del paciente, reducir o compensar el lado negligido, siguiendo las indicaciones que el especialista en rehabilitación cognitiva les otorga. Ejemplos sobre dichas estrategias se exponen en la Tabla 3. Cabe aclarar, que ninguna de estas actividades de forma aislada es eficaz, sino que es necesaria la utilización de varias de forma simultánea. La utilización de TMS es otra estrategia que podría considerarse como complemento 64.

Rehabilitación de las funciones ejecutivas
Las funciones ejecutivas representan las habilidades cognitivas superiores que subyacen a los aspectos de la cognición social y las relaciones interpersonales.
La disfunción ejecutiva es el principal componente de los trastornos neuroconductuales luego del ACV, que consisten en conductas disruptivas que generan impacto en la autonomía, independencia funcional e interacción social.
El diseño de los programas de rehabilitación de las funciones ejecutivas presenta como obstáculos principales la gran variedad de síntomas frontales (cognitivos y conductuales), la complejidad teórica y la falta de evidencia de calidad 65. Es por ello, que se necesita utilizar diferentes técnicas no excluyentes como: 1) modificación del entorno; 2) técnicas de restauración; 3) estrategias compensatorias; y 4) intervenciones educacionales/estratégicos. La intervención en grupos constituye una herramienta de trabajo de gran valor, ya que representa una oportunidad de observar y trabajar el funcionamiento cognitivo, conductual y la interacción entre las personas del grupo.
Rehabilitación de la memoria
La evidencia hallada hasta la fecha sugiere que para quienes tienen problemas leves de memoria, se pueden
considerar estrategias compensatorias. Para aquellos con alto grado de independencia funcional, buena conciencia de déficit y adecuada motivación hacia el tratamiento, el uso de estrategias internas (ej., imágenes visuales, organización semántica, práctica espaciada) es una opción.
Las ayudas externas no electrónicas también pueden utilizarse (ej., cuadernos, calendarios de pared, notas, lista de cosas para hacer, agendas) 66, teniendo en cuenta que requieren de cierto grado de memoria y funciones ejecutivas para garantizar el aprendizaje de su manejo y su uso mínimamente autónomo.
Para aquellos que presentan déficits más graves, se recomienda el uso de compensaciones externas mediante
la tecnología asistida (ej., tablets, computadoras portátiles).
También se recomiendan intervenciones específicas como el aprendizaje sin error, dirigidas a facilitar la
adquisición de habilidades concretas. La TMS sobre la corteza prefrontal dorsolateral izquierda ha demostrado mejorar la atención, pero sin un resultado claro sobre la memoria y el aprendizaje 67. Aunque no existe suficiente evidencia, los juegos de realidad virtual podrían mejorar la atención y la memoria visual-espacial68; siempre debe considerarse el conocimiento previo sobre tecnología del paciente. Por su parte, la musicoterapia puede ser útil para mejorar la memoria verbal 69.
Rehabilitación visual
Después de un ACV entre un 20-57% de los pacientes presentan defectos del campo visual, alteraciones binoculares (estrabismos adquiridos, diplopías, alteraciones en la motilidad ocular) y en la percepción visual 70. La rehabilitación visual se basa en diferentes tipos de terapias, que tienen como objetivo aprovechar al máximo el resto visual del paciente y reducir las limitaciones diarias: la sustitutiva u óptica, en la cual mediante el uso de ayudas ópticas, se busca potenciar el campo visual residual. La utilización de prismas gemelos puede ser útil para ayudar a compensar los trastornos campimétricos 71; la compensatoria u oculomotora, es la utilizada en los pacientes con trastornos de la motilidad ocular, basada en la realización de ejercicios oculares para tratar dichos déficits. Para aquellos que presentan trastornos campimétricos, el entrenamiento de escaneo compensatorio puede ser considerado para mejorar la funcionalidad, pero no reduce la magnitud del déficit visual 71; finalmente, la restitutiva contempla la recuperación del campo visual mediante la estimulación visual. La estimulación de borde del campo ciego produciría mejoras en el tamaño del campo visual, el rendimiento visual subjetivo, cambios en la función y reorganización cortical 72. También se ha utilizado el entrenamiento de restauración de visión de forma computarizada, aunque no existe evidencia suficiente de momento que sustente su indicación.
La exploración espacial audiovisual multimodal es una forma de rehabilitación útil para los trastornos de la percepción visual-espacial, que complementa al tratamiento neurocognitivo 73. El uso de entornos de realidad virtual para mejorar la representación visual-espacial puede considerarse para mejorar el rendimiento visual funcional.
Comorbilidades
Trombosis venosa profunda (TVP) y tromboflebitis
Las medidas profilácticas pueden dividirse en mecánicas y farmacológicas. En cuanto a las primeras, aquellos con movilidad reducida pueden beneficiarse con la utilización de compresión neumática intermitente acordes a la masa corporal asociado a las medidas estándares (tratamiento antiplaquetario, hidratación), dado que ha demostrado reducir el riesgo de TVP y la supervivencia a 6 meses 5, 45, 74, 75. Sin embargo, este tipo de medida profiláctica se encuentra contraindicada en pacientes con alteraciones locales en las piernas (dermatitis, gangrena, edema grave, estasis venosa, enfermedad vascular periférica grave, ligadura de venas postoperatorias o injertos)5, 45. El uso de medias elásticas se encuentra contraindicado, debido a que no reduce el riesgo de TVP y tromboembolismo pulmonar, y a que aumenta el riesgo de complicaciones cutáneas locales 5, 45, 76.
El uso de anticoagulantes no debe ser aplicado de forma sistemática en todos los pacientes, dado que solo han demostrado disminuir el riesgo de TVP y tromboembolismo pulmonar asintomáticos, sin lograr la reducción de la morbimortalidad. Además, dichos fármacos aumentan el riesgo de hemorragia intra y extracraneanas 5, 45, 74, 75, 77.
Por dicho motivo, la indicación de anticoagulantes debe ser individualizada. De utilizarse, no hay diferencias significativas entre el uso de heparinas de bajo peso molecular vs. heparinas no fraccionadas 5,45. Aunque las heparinas de bajo peso molecular tienen la ventaja de ser administradas una vez al día, deben utilizarse con cuidado en ancianos y en insuficientes renales 5, 45, 74, 75. No existe clara evidencia del tiempo que debe continuarse la profilaxis; por lo general, se hace durante toda la estancia de rehabilitación o hasta que se recupere la movilidad, quedando en última instancia a criterio del grupo médico tratante 5,45.
El riesgo de tromboflebitis puede minimizarse con la correcta utilización de los accesos venosos periféricos.
De ser posible, los mismos deben colocarse en el brazo no dominante, para permitir la mejor movilidad. El dolor y ardor en el sitio de punción son habitualmente los primeros síntomas, motivo por el cual debe evitarse la colocación de los catéteres venosos en los miembros con plejía o hipoestesia grave, ya que podrían hacer pasar por desapercibidos estos síntomas de alarma.
Cuidados de la piel
Las lesiones de piel (úlceras por presión-UPP) constituyen un importante problema de salud pública, ocasionando alteraciones en la calidad de vida, prolongación de la estadía hospitalaria y aumento de las horas de atención de enfermería. Cada institución debe generar programas de prevención y cuidado de las UPP, que deberá ser aplicado a todos los pacientes. Una minuciosa exploración física debe realizarse de forma diaria y darle principal atención a los pacientes con alto riesgo de UPP: ACV en estados críticos, ventilación mecánica, déficit motriz o cognitivo grave, respuesta inflamatoria sistémica o en estado de malnutrición. Las escalas más utilizadas para predecir el riesgo de UPP son la Arnell modificada y la Branden. Para prevenir la aparición de UPP se debe minimizar o eliminar la fricción de la piel mediante giro/rotación regular en la cama (cada 2 h), utilizando colchones especializados, cojines para silla de ruedas y todo tipo de material de soporte blando para zonas de apoyo constantes 5, 78. Otros sitios que se deben tener vigilancia especial son aquellos donde se encuentran los sensores de saturometría, drenajes, sondas, máscaras, bigoteras de oxígeno, equipos de ventilación no invasiva, tubos endotraqueales, férulas y dispositivos de compresión neumática intermitente, los cuales deben ser cuidados y rotados. La higiene diaria o según demanda, hidratantes de piel (cremas hipoalergénicas, ácidos grasos hiperoxigenados) y una correcta hidratación/nutrición, son otros aspectos importantes en la prevención de UPP.
Una vez instalada la lesión, se debe contar con un protocolo de tratamiento efectivo para su curación y
cicatrización rápida. En estadios más avanzados (grado 3 y 4), resulta prudente la intervención de equipos de cirugía plástica.
Tratamiento del dolor
El dolor de hombro es un tipo de dolor somático muy común. Los factores de riesgo más importantes son: espasticidad, edad avanzada, hemiplejia izquierda, alteraciones en la propiocepción en la extremidad dolorosa, aparición temprana, dolor a la abducción pasiva del hombro cuando el brazo está girado internamente y sensibilidad a la palpación sobre el tendón del bíceps y el supraespinoso 79.
Durante la fase aguda del ACV, el dolor en el hombro se relaciona más con la subluxación, mientras que en la fase más crónica, existen cambios osteodegenerativos a nivel articular como rigidez de la cápsula. Es por esto que resulta necesario educar al paciente y acompañantes sobre ejercicios de movilidad y posicionamiento del hombro 5, 6, 80. Se debe evitar tironear del mismo durante los traslados y mantener la correcta posición del brazo durante el reposo. El brazo no debe moverse más allá de los 90 grados de flexión o abducción del hombro, a menos que la escápula se gire hacia arriba y el húmero sea rotado lateralmente. También deben evitarse ejercicios de polea superior 5, 6, 80.
Los movimientos que deben realizarse son los que favorezcan la rotación y abducción de forma gradual, conjunto a la restauración de la alineación y fortalecimiento de los músculos débiles en la cintura escapular 5, 6, 80. El uso de toxina botulínica sobre ciertos músculos (pectoral mayor, bíceps, subescapular) puede ser necesario en aquellos con espasticidad grave 81. Los resultados con el uso de corticoides intra-articulares a corto y largo plazo son controvertidos; puede utilizarse para aliviar el dolor de forma aguda, principalmente cuando hay signos de inflamación de la región subacromial (manguito rotador o bolsa) 5, 6, 82.
El bloqueo del nervio supraescapular puede ser considerado en pacientes con hemiplejía, siendo superior al uso de corticoides intrarticulares a largo plazo 83. En aquellos hemipléjicos con importantes restricciones en el rango de movimiento del hombro, puede ser considerada la tenotomía quirúrgica del pectoral mayor, latissimus dorsi, teres major o subscapularis 84.
El dolor neuropático central se asocia clásicamente con el ACV talámico (síndrome de Dejerine-Roussy), pero puede resultar de una lesión en cualquier lugar a lo largo de los tractos espinotalámico y las conexiones tálamocorticales.
La incidencia es del 7-8% y suele ocurrir de manera temprana (dentro del primer mes de presentado el ACV). Como ocurre en muchas ocasiones con los dolores neuropáticos, el diagnóstico es dificultoso, por lo que se han propuestos criterios diagnósticos estrictos, siendo necesario en todos los casos excluir otras causas (Tabla 4) 85. La elección del agente farmacológico para el tratamiento debe individualizarse a las necesidades del paciente, considerando sus efectos adversos. Algunas guías proponen utilizar amitriptilina y lamotrigina como fármacos de primera línea 5, relegando a la pregabalina y al gabapentin como segunda línea 5. Sin embargo, otras guías proponen pregabalina o gabapentin como primera línea, relegando a una segunda línea a la amitriptilina y a los inhibidores de la recaptación de serotonina, en especial duloxetina 6. En aquellos refractarios a estos tratamientos, se podría utilizar tramadol u otro opioide como rescate, manteniendo una farmacovigilancia estrecha 6.
La estimulación nerviosa eléctrica transcutánea y la colocación de electrodos cerebrales profundos no han
demostrado ser lo suficientemente efectivas 5. La TMS aplicada sobre la corteza motora podría ser razonable para el dolor neuropático central refractario 86.
Las calcificaciones u osificación heterotópica, definidas como la presencia de hueso ectópico en las articulaciones, es otra causa de dolor en pacientes con ACV e inmovilización prolongada (prevalencia 0.5-1.5%) 87. Su aparición suele ocurrir durante los primeros meses (1-6 meses; pico: 2 meses) 87 y son más frecuentes en jóvenes, sexo masculino, espasticidad, requerimientos de ventilación mecánica y deterioro cognitivo 87. Además, ocasionan limitación del rango de movilidad articular, por lo que el diagnóstico y rastreo temprano radiológico está indicado cuando se sospecha 87. La movilidad pasiva y activa de forma cuidadosa resulta necesaria para prevenirlas, aunque una vez instaladas el tratamiento es quirúrgico 87.
Depresión y comportamiento
La depresión post-ACV es una condición común e invalidante que requiere un diagnóstico rápido para proporcionar el tratamiento adecuado 88. Los factores de riesgo para el desarrollo de depresión post-ACV incluyen: historial previo de depresión, discapacidad grave, deterioro cognitivo, ACV previo, historial familiar de trastorno psiquiátrico y el sexo femenino. La depresión puede afectar negativamente la capacidad para participar activamente en terapias de rehabilitación, por lo que se recomienda realizar un screening de depresión a todos los pacientes luego de un ACV 5. Se recomienda tratar con antidepresivos a aquellos con diagnóstico de depresión post-ACV, en ausencia de contraindicaciones 5. Aquellos pacientes que tenían depresión previa al ACV y recibían antidepresivos, requieren del reinicio del tratamiento, pero no se recomienda su uso de manera profiláctica 5. No hay evidencia suficiente para priorizar algún tipo particular de antidepresivo, aunque los inhibidores de la recaptación de la serotonina (IRSS) son los más utilizados y generalmente bien tolerados 5. Otra razón para utilizar IRSS como la fluoxetina, es el posible efecto positivo sobre la función motora en pacientes hemipléjicos 16. Como medida no farmacológica, un programa de ejercicio adecuado al menos por 4 semanas, podría ser beneficioso 89.
Los trastornos de ansiedad y el ánimo pseudobulbar son otras comorbilidades psiquiátricas. La correcta sospecha y diagnóstico preciso del ánimo pseudobulbar, pueden ayudar a mejorar el tratamiento y reducir el uso de medicamentos inapropiados, incluidos los antipsicóticos.
En estos casos, puede utilizarse de manera razonable IRSS o la combinación dextrometorfano/quinidina 5.
Manejo de osteoporosis
El ACV es un factor de riesgo mayor de osteoporosis (prevalencia de 17-40%) debido a la pérdida sustancial de densidad mineral ósea, dificultad en la marcha e inmovilización.
La pérdida de densidad mineral ósea ocurre desde los primeros días de producido el ACV, hasta por lo menos el primer año, principalmente en lado parético (> 10% en el primer año)90. Valores reducidos de vitamina D se observan hasta en el 71% de los casos. Por lo tanto, la osteoporosis y el mayor riesgo de caídas, aumenta frecuencia de fracturas.
Resulta razonable realizar densitometría mineral ósea, evaluar los requerimientos de suplementos de calcio y vitamina D. Debe considerarse la necesidad de utilizar bifosfonatos, fármacos antiresortivos y anabólicos aprobados5. Además de las medidas farmacológicas, el aumento de los niveles de actividad física está indicado para reducir el riesgo y gravedad de la osteoporosis post-ACV.
Retorno a las actividades de la vida diaria
La reinserción en la comunidad es una tarea compleja. Por dicho motivo, resulta importante realizar planes individualizados previos al alta hospitalaria o del centro de rehabilitación 91. La planificación necesaria no solo debe ser dirigida al paciente, sino también considerar a sus acompañantes, contexto familiar y socioeconómico.
Los aspectos más importantes a tener en cuenta para la reinserción en su entorno son las actividades básicas de la vida diaria (ABVD), actividades instrumentales de la vida diaria, descanso y sueño, educación, trabajo, juego, ocio y participación social.
Las ABVD están orientadas al cuidado del propio cuerpo y son fundamentales para vivir en un mundo social. Incluyen actividades de aseo, arreglo personal, alimentación, movilidad funcional y actividad sexual. La recuperación más significativa ocurre durante los primeros 6 meses posteriores al ACV. La edad avanzada es una de las variables con mayor efecto negativo sobre las ABVD.
Funcionamiento sexual
La función sexual debe ser considerada como la capacidad de participar en actividades que busquen la satisfacción sexual, encuentro relacional y/o necesidad reproductiva. Los pacientes que han sufrido un ACV suelen experimentar declinamiento del funcionamiento sexual debido a múltiples factores: déficit neurológico, condiciones comórbidas (ej., diabetes mellitus) y utilización de diversos fármacos (ej., beta-bloqueantes) 92. En aquellos con lesiones derechas, predominan los trastornos de la eyaculación, mientras que en las izquierdas, los involucrados en la libido. En muchas ocasiones, los pacientes piensan que la actividad sexual está contraindicada luego del ACV 92. Por dicho motivo podría resultar útil impartir educación sexual 5,6. El modelo PLISSIT (Permission, Limited Information, Specific Suggestions, Intensive Therapy) de intervención, es uno de los más utilizados por los profesionales de la salud encargados en el tratamiento de las disfunciones sexuales en pacientes con discapacidades adquiridas o enfermedades crónicas 93.
Retorno al manejo vehicular y movilidad en la comunidad
La conducción vehicular es una actividad compleja que requiere habilidades motoras, cognitivas y psicológicas. Según datos de otros países, solo el 61% logra conducir luego del año del ACV. Sin embargo, muchos de los que retoman la conducción vehicular no están lo suficientemente aptos para ello, lo que implica un riesgo aumentado de potenciales accidentes 94. Los factores de riesgo que reducen la posibilidad de retornar al manejo son: edad avanzada, sexo femenino, ACV hemorrágico, mayor compromiso motor, fatiga y deterioro cognitivo 94.
Es necesaria la correcta valoración neuropsicológica, motora y visual previo al retorno a la conducción vehicular.
Se utilizan diferentes pruebas neuropsicológicas cognitivas para predecir la capacidad de conducir 95. El Trail Making B es uno de los predictores significativos para evaluar dicha aptitud. Los simuladores de conducción podrían ser una herramienta útil para evaluar tanto cognitiva como motrizmente a los pacientes 96, pero solo deberían considerarse como pruebas de apoyo, dado que no permiten excluir a la totalidad de individuos incapaces de manejar 97. Además, se recomienda una prueba en carretera o pista, supervisada por una persona autorizada 97.
Las evaluaciones sistematizadas permiten identificar y realizar las adaptaciones vehiculares que fueran necesarias para que el paciente pueda volver a conducir.
El rol que debe cumplir el médico y el grupo interdisciplinario especialista en rehabilitación es realizar el diagnóstico que permita discernir qué pacientes podrían estar en condiciones de conducir de forma segura. Sin embargo, la licencia de conducir debe ser expedida por el órgano estatal correspondiente que, en última instancia, es el encargado de corroborar legalmente si la persona se encuentra apta para manejar. En Argentina, la Ley Nacional de Tránsito N° 24.449 regula y establece los requisitos legales para poder conducir luego de sufrir una lesión discapacitante. El conocimiento de dicha ley es importante desde el punto de vista legal, dado que los seguros vehiculares no cubren los siniestros de conductores que no tengan la licencia correspondiente en regla acorde a su situación psicofísica.
La correcta indicación del retorno al manejo vehicular influye de manera favorable sobre la calidad de vida del paciente, mejorando su autoestima, confianza e independencia. El uso del transporte público también representa una ABVD de gran relevancia para la mantención de la autonomía. Por dicho motivo, es importante trabajar sobre tres etapas secuenciales 98: la de preparación, que incluye acciones anticipatorias que buscan asegurar un desempeño adaptativo, proyectando dificultades o compensando factores individuales (ej., organizar rutas, disponer de medio de pago, estudiar sistema de transporte); la segunda, de acceso, involucra acciones de movilización hacia las fuentes de transporte (ej., paradas de colectivo, estaciones de tren o, subterráneo), así como el acceso al medio de transporte utilizado (ej., subir al colectivo o vagón del tren o subterráneo) y finalmente, la tercera, la de uso, que evalúa los aspectos propios del transporte (arquitectura del medio de transporte y disposición de sus elementos físicos), el sistema de pago del mismo y las actitudes de otros hacia la persona con movilidad reducida durante el desempeño de la actividad (del conductor del transporte y de otras personas que se encuentren en el contexto de la actividad).
Actividades instrumentales de la vida diaria – Reinserción laboral
Un gran porcentaje de pacientes en Argentina y en el mundo presenta un ACV durante su edad laboral 1,4, muchos de los cuales no pueden reincorporarse a su trabajo luego del mismo, implicando grandes pérdidas económicas. Algunos informes indican que sería razonable implementar terapias de rehabilitación vocacional 99. Para esto, resulta necesario tener una correcta evaluación previa, cognitiva y motriz. Una vez evaluado el rendimiento en las mejores condiciones posibles, debe realizarse de forma adicional en condiciones de fatiga y estrés que imiten las posibles situaciones laborales, a fin de determinar si el paciente se encuentra apto para regresar a su trabajo o puede reincorporarse al mismo mediante alguna ayuda o cambio de posición 5, 99.
Actividades de recreación y ocio
Un gran número de pacientes que han sufrido un ACV presentan restricciones en las actividades recreativas, lo que afecta el aspecto emocional e impacta en cambios de hábitos, haciendo que se tomen conductas más sedentarias (ej., mayor tiempo de ver TV). Por lo tanto, resulta razonable implementar terapias de rehabilitación que favorezcan la educación y la autogestión de desarrollo de habilidades recreativas y de ocio, incluso en etapas tempranas del ACV 100.
En ocasiones, las terapias grupales donde el paciente se encuentre rodeado de pares puede ser estimulante 6.
Agradecimientos: Al Comité de Docencia e Investigación del Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI) por la aprobación de la realización del trabajo y la financiación de la publicación del mismo.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Bahit MC, Coppola ML, Riccio PM, et al. First-ever stroke and transient ischemic attack incidence and 30-day casefatality rates in a population-based study in Argentina. Stroke 2016; 47: 1640-2.
2. Sposato LA, Esnaola MM, Zamora R, et al. Quality of ischemic stroke care in emerging countries: the Argentinian National Stroke Registry (ReNACer). Stroke 2008; 39: 3036-41.
3. Zuin DR, Nofal P, Tarulla A, et al. National epidemiological survey about neurological resources: availabilty of stroke centers and IV thrombolysis in Argentina. Neurol Arg 2015; 7: 261-5.
4. Melcon CM, Melcon MO. Prevalence of stroke in an Argentine community. Neuroepidemiol 2006; 27: 81-8.
5. Winstein CJ, Stein J, Arena R, et al. Guidelines for adult stroke rehabilitation and recovery: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2016; 47(6): e98-e169.
6. Hebert D, Lindsay MP, McIntyre A, et al. Canadian stroke best practice recommendations: stroke rehabilitation practice guidelines, update 2015. Int J Stroke 2016; 11: 459-84.
7. AVERT Trial Collaboration Group. Efficacy and safety of very early mobilisation within 24 h of stroke onset (AVERT): a randomised controlled trial. Lancet 2015; 386: 46-55.
8. Quinn TJ, Paolucci S, Sunnerhagen KS, et al. Evidencebased stroke rehabilitation: an expanded guidance document from the European Stroke Organisation (ESO) guidelines for management of ischaemic stroke and
transient ischaemic attack 2008. J Rehabil Med 2009; 41: 99-111.
9. Rousseaux M, Daveluy W, Kozlowski R. Value and efficacy of early supported discharge from stroke units. Ann Phys Rehabil Med 2009; 52: 224-33.
10. Brady BK, McGahan L, Skidmore B. Systematic review of economic evidence on stroke rehabilitation services. Int J Technol Assess Health Care 2005; 21: 15-21.
11. Langhorne P, Coupar F, Pollock A. Motor recovery after stroke: a systematic review. Lancet Neurol 2009; 8: 741-54.
12. Ada L, Dean CM, Vargas J, Ennis S. Mechanically assisted walking with body weight support results in more independent walking than assisted overground walking in non-ambulatory patients early after stroke: a systematic review. J Physiother 2010; 56: 153-61.
13. Bonan IV, Marquer A, Eskiizmirliler S, Yelnik AP, Vidal PP. Sensory reweighting in controls and stroke patients. Clin Neurophysiol 2013; 124: 713-22.
14. Tyson SF, Kent RM. Orthotic devices after stroke and other nonprogressive brain lesions. Cochrane Database Syst Rev 2009: CD003694.
15. Ambrosini E, Ferrante S, Pedrocchi A, Ferrigno G, Molteni F. Cycling induced by electrical stimulation improves motor recovery in postacute hemiparetic patients: a randomized controlled trial. Stroke 2011; 42: 1068-73.
16. Chollet F, Tardy J, Albucher JF, et al. Fluoxetine for motor recovery after acute ischaemic stroke (FLAME): a randomised placebo-controlled trial. Lancet Neurol 2011; 10: 123-30.
17. Scheidtmann K, Fries W, Müller F, Koenig E. Effect of levodopa in combination with physiotherapy on functional motor recovery after stroke: a prospective, randomised, double-blind study. Lancet 2001; 358: 787-90.
18. Moreira MC, de Amorim Lima AM, Ferraz KM, Benedetti Rodrigues MA. Use of virtual reality in gait recovery among post stroke patients: a systematic literature review. Disabil Rehabil Assist Technol 2013; 8: 357-62.
19. Hubbard IJ, Parsons MW, Neilson C, Carey LM. Taskspecific training: evidence for and translation to clinical practice. Occup Ther Int 2009; 16: 175-89.
20. Harris JE, Eng JJ. Strength training improves upper-limb function in individuals with stroke: a meta-analysis. Stroke 2010; 41: 136-40.
21. Mehrholz J, Hadrich A, Platz T, Kugler J, Pohl M. Electromechanical and robot-assisted arm training for improving generic activities of daily living, arm function, and arm muscle strength after stroke. Cochrane Database Syst Rev 2012; 6: CD006876.
22. Price CI, Pandyan AD. Electrical stimulation for preventing and treating post-stroke shoulder pain: a systematic Cochrane review. Clin Rehabil 2001; 15: 5-19.
23. Pomeroy VM, King LM, Pollock A, Baily-Hallam A, Langhorne P. Electrostimulation for promoting recovery of movement or functional ability after stroke: systematic review and meta-analysis. Cochrane Database Syst Rev 2006; (2): CD003241.
24. Foley N, Pereira S, Salter K, et al. Treatment with botulinum toxin improves upper-extremity function post stroke: a systematic review and metaanalysis. Arch Phys Med Rehabil 2013; 94: 977-89.
25. Kaji R, Osako Y, Suyama K, Maeda T, Uechi Y, Iwasaki M; GSK1358820 Spasticity Study Group. Botulinum toxin type A in post-stroke lower limb spasticity: a multicenter, double-blind, placebo-controlled trial. J Neurol 2010; 257: 1330-7.
26. Francisco GE, Yablon SA, Schiess MC, Wiggs L, Cavalier S, Grissom S. Consensus panel guidelines for the use of intrathecal baclofen therapy in poststroke spastic hypertonia. Top Stroke Rehabil 2006; 13: 74-85.
27. Noma T, Matsumoto S, Shimodozono M, Etoh S, Kawahira K. Anti-spastic effects of the direct application of vibratory stimuli to the spastic muscles of hemiplegic limbs in post-stroke patients: a proof-of-principle study. J Rehabil Med 2012; 44: 325-30.
28. Lannin NA, Cusick A, McCluskey A, Herbert RD. Effects of splinting wrist contracture after stroke: a randomized controlled trial. Stroke 2007; 38:111-6.
29. Robinson W, Smith R, Aung O, Ada L. No difference between wearing a night splint and standing on a tilt table in preventing ankle contracture early after stroke: a randomized trial. Australian J Physiotherapy 2008; 54: 33-8.
30. Ada L, Goddard E, McCully J, Stavrinos T, Bampton J. Thirty minutes of positioning reduces the development of shoulder external rotation contracture after stroke: a randomized controlled trial. Arch Phys Med Rehabil 2005; 86: 230-4.
31. Namdari S, Horneff JG, Baldwin K, Keenan MA. Muscle releases to improve passive motion, relieve pain in patients with spastic hemiplegia, and elbow flexion contractures. J Shoulder Elbow Surg 2012; 21: 1357-62.
32. Batchelor F, Hill K, Mackintosh S, Said C. What works in falls prevention after stroke? A systematic review and meta-analysis. Stroke 2010; 41:1715-1722.
33. Tinetti ME, Kumar C. The patient who falls: “It’s always a trade-off.” JAMA 2010; 303: 258-66.
34. Morse JM, Morse RM, Tylko SJ. Development of a scale to identify the fall-prone patient. Can J Aging 1989; 8: 366-77.
35. Maeda N, Kato J, Shimada T. Predicting the probability for fall incidence in stroke patients using the Berg Balance Scale. J Int Med Res 2009; 37: 697-704.
36. Gillespie LD, Robertson MC, Gillespie WJ, et al. Interventions for preventing falls in older people living in the community. Cochrane Database Syst Rev 2012; 9: CD007146.
37. Taylor-Piliae RE, Hoke TM, Hepworth JT, Latt LD, Najafi B, Coull BM. Effect of Tai Chi on physical function, fall rates and quality of life among older stroke survivors. Arch Phys Med Rehabil 2014; 95: 816-24.
38. Jutai J, Coulson S, Teasell R, et al. Mobility assistive device utilization in a prospective study of patients with first-ever stroke. Arch Phys Med Rehabil 2007; 88: 1268-75.
39. Mountain AD, Kirby RL, MacLeod DA, Thompson K. Rates and predictors of manual and powered wheelchair use for persons with stroke: a retrospective study in a Canadian rehabilitation center. Arch Phys Med Rehabil 2010; 91: 639-43.
40. Hinchey JA, Shephard T, Furie K, Smith D, Wang D, Tonn S. Stroke Practice Improvement Network Investigators. Formal dysphagia screening protocols prevent pneumonia. Stroke 2005; 36: 1972-6.
41. Jauch EC, Saver JL, Adams HP Jr, et al; on behalf of the American Heart Association Stroke Council; Council on Cardiovascular Nursing; Council on Peripheral Vascular Disease; Council on Clinical Cardiology. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2013; 44: 870-947.
42. White JV, Guenter P, Jensen G, Malone A, Schofield M; Academy of Nutrition and Dietetics Malnutrition Work Group; A.S.P.E.N. Malnutrition Task Force; A.S.P.E.N. Board of Directors. Consensus statement of the Academy of Nutrition and Dietetics/American Society for Parenteral and Enteral Nutrition: characteristics recommended for the identification and documentation of adult malnutrition (undernutrition). J Acad Nutr Diet 2012; 112: 730-8.
43. National Collaborating Centre for Chronic Conditions. Stroke: National Clinical Guideline for Diagnosis and Initial Management of Acute Stroke and Transient Ischaemic Attack (TIA). London: Royal College of Physicians (UK); 2008. National Institute for Health and Clinical Excellence: Guidance.
44. Broadley S, Cheek A, Salonikis S, et al. Predicting prolonged dysphagia in acute stroke: The Royal Adelaide Prognostic Index for Dysphagic Stroke (RAPIDS). Dysphagia 2005; 20: 303-10.
45. Powers WJ, Rabinstein AA, Ackerson T, et al. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2018; 49: e46-99.
46. Gomes F, Hookway C, Weekes CE. Royal College of Physicians Intercollegiate Stroke Working Party evidencebased guidelines for the nutritional support of patients who have had a stroke. Hum Nutr Diet 2014; 27: 107-21.
47. Geeganage C, Beavan J, Ellender S, Bath PM. Interventions for dysphagia and nutritional support in acute and subacute stroke. Cochrane Database Syst Rev 2012; 10: CD000323.
48. Rowat A Enteral tube feeding for dysphagic stroke patients. Br J Nurs 2015; 24: 138-45.
49. Buchholz AC. Weaning patients with dysphagia from tube feeding to oral nutrition: a proposed algorithm. Can J Diet Pract Res 1998; 59: 208-14.
50. FOOD Trial Collaboration. Poor nutritional status on admission predicts poor outcomes after stroke: observational data from the FOOD trial. Stroke 2003; 34: 1450-6.
51. Leys D, Hénon H, Mackowiak-Cordoliani MA, Pasquier F. Poststroke dementia. Lancet Neurol 2005; 4: 752-9.
52. Zedlitz AM, Rietveld TC, Geurts AC, Fasotti L. Cognitive and graded activity training can alleviate persistent fatigue after stroke: a randomized, controlled trial. Stroke 2012; 43: 1046-51.
53. Sofi F, Valecchi D, Bacci D, et al. Physical activity and risk of cognitive decline: a meta-analysis of prospective studies. J Intern Med 2011; 269: 107-17.
54. Cicerone KD, Langenbahn DM, Braden C, et al. Evidencebased cognitive rehabilitation: updated review of the literature from 2003 through 2008. Arch Phy Med Rehabil 2011; 92: 519-30.
55. Das Nair R, Cogger H, Worthington E, Lincoln NB. Cognitive rehabilitation for memory deficits after stroke. Cochrane Database Syst Rev 2016; (16): CD002293.
56. Ballard C, Rowan E, Stephens S, Kalaria R, Kenny RA. Prospective follow-up study between 3 and 15 months after stroke: improvements and decline in cognitive function among dementia-free stroke survivors >75 years of age. Stroke 2003; 34: 2440-4.
57. Posner MI, Petersen SE. The attention system of the human brain. Annu Rev Neurosci 1990; 13: 25-42.
58. Brady MC, Kelly H, Godwin J, Enderby P. Speech and language therapy for aphasia following stroke. Cochrane Database Syst Rev 2012; 5: CD000425.
59. Simmons-Mackie N, Raymer A, Armstrong E, Holland A, Cherney LR. Communication partner training in aphasia: a systematic review. Arch Phys Med Rehabil 2010; 91: 1814-37.
60. Lanyon LE, Rose ML, Worrall L. The efficacy of outpatient and community-based aphasia group interventions: a systematic review. Int J Speech Lang Pathol 2013; 15: 359-74.
61. Cherney LR, van Vuuren S. Telerehabilitation, virtual therapists, and acquired neurologic speech and language disorders. Semin Speech Lang 2012; 33: 243-57.
62. Frankoff DJ, Hatfield B. Augmentative and alternative communication in daily clinical practice: strategies and tools for management of severe communication disorders. Top Stroke Rehabil 2011; 18: 112-9.
63. Bowen A, Hazelton C, Pollock A, Lincoln NB. Cognitive rehabilitation for spatial neglect following stroke. Cochrane Database Syst Rev 2013; 7:CD003586.
64. Salazar APS, Vaz PG, Marchese RR, Stein C, Pinto C, Pagnussat AS. Noninvasive brain stimulation improves hemispatial neglect after stroke: a systematic review and meta-analysis. Archi Phys Med Rehabil 2018; 99: 355-66.
65. Chung CS, Pollock A, Campbell T, Durward BR, Hagen S. Cognitive rehabilitation for executive dysfunction in adults with stroke or other adult non-progressive acquired brain damage. Cochrane Database Syst Rev 2013; 4: CD008391.
66. Eghdam A, Scholl J, Bartfai A, Koch S. Information and communication technology to support self-management of patients with mild acquired cognitive impairments: systematic review. J Med Internet Res 2012; 14: e159.
67. Hamilton RH, Chrysikou EG, Coslett B. Mechanisms of aphasia recovery after stroke and the role of noninvasive brain stimulation. Brain Lang 2011; 118: 40-50.
68. Kim BR, Chun MH, Kim LS, Park JY. Effect of virtual reality on cognition in stroke patients. Ann Rehabil Med 2011; 35: 450-9.
69. Särkämö T, Tervaniemi M, Laitinen S, et al. Music listening enhances cognitive recovery and mood after middle cerebral artery stroke. Brain 2008; 131(pt 3): 866-76.
70. Pollock A, Hazelton C, Henderson CA, et al. Interventions for disorders of eye movement in patients with stroke. Cochrane Database Syst Rev 2011; CD008389.
71. Keller I, Lefin-Rank G. Improvement of visual search after audiovisual exploration training in hemianopic patients. Neurorehabil Neural Repair 2010; 24: 666-73.
72. Poggel DA, Mueller I, Kasten E, Bunzenthal U, Sabel BA. Subjective and objective outcome measures of computerbased vision restoration training. NeuroRehabilitation 2010; 27: 173-87.
73. Keller I, Lefin-Rank G. Improvement of visual search after audiovisual exploration training in hemianopic patients. Neurorehabil Neural Repair 2010; 24: 666-73.
74. CLOTS (Clots in Legs Or sTockings after Stroke) Trials Collaboration, Dennis M, Sandercock P, Reid J, Graham C, Forbes J, Murray G. Effectiveness of intermittent pneumatic compression in reduction of risk of deep vein thrombosis in patients who have had a stroke (CLOTS 3): a multicentre randomised controlled trial. Lancet 2013; 382: 516-24.
75. Dennis M, Caso V, Kappelle LJ, Pavlovic A, Sandercock P. European Stroke Organisation (ESO) guidelines for prophylaxis for venous thromboembolism in immobile patients with acute ischaemic stroke. Eur Stroke J 2016; 1: 6-19.
76. CLOTS Trials Collaboration, Dennis M, Sandercock PA, et al. Effectiveness of thighlength graduated compression stockings to reduce the risk of deep vein thrombosis after stroke (CLOTS trial 1): a multicentre, randomised controlled trial. Lancet 2009; 373: 1958-65.
77. Sandercock PA, Counsell C, Kane EJ. Anticoagulants for acute ischaemic stroke. Cochrane Database Syst Rev 2015; CD000024.
78. Miller EL, Murray L, Richards L, et al; on behalf of the American Heart Association Council on Cardiovascular Nursing and the Stroke Council. Comprehensive overview of nursing and interdisciplinary rehabilitation care of the stroke patient: a scientific statement from the American Heart Association. Stroke 2010; 41: 2402-48.
79. O’Donnell MJ, Diener HC, Sacco RL, Panju AA, Vinisko R, Yusuf S; PRoFESS Investigators. Chronic pain syndromes after ischemic stroke: PRoFESS trial. Stroke 2013; 44: 1238-43.
80. Management of Patients With Stroke: Rehabilitation, Prevention and Management of Complications, and Discharge Planning: A National Guideline. Edinburgh, Scotland: Scottish Intercollegiate Guidelines Network, 2010.
81. Marciniak CM, Harvey RL, Gagnon CM, et al. Does botulinum toxin type A decrease pain and lessen disability in hemiplegic survivors of stroke with shoulder pain and spasticity? A randomized, double-blind, placebo-controlled trial. Am J Phys Med Rehabil 2012; 91: 1007-19.
82. Chae J, Jedlicka L. Subacromial corticosteroid injection for poststroke shoulder pain: an exploratory prospective case series. Arch Phys Med Rehabil 2009; 90: 501-6.
83. Yasar E, Vural D, Safaz I, Balaban B, Yilmaz B, Goktepe AS, Alaca R. Which treatment approach is better for hemiplegic shoulder pain in stroke patients: intra-articular steroid or suprascapular nerve block? A randomized controlled trial. Clin Rehabil 2011; 25: 60-8.
84. Namdari S, Alosh H, Baldwin K, Mehta S, Keenan MA. Shoulder tenotomies to improve passive motion and relieve pain in patients with spastic hemiplegia after upper motor neuron injury. J Shoulder Elbow Surg 2011; 20: 802-6.
85. Klit H, Finnerup NB, Jensen TS. Central post-stroke pain: clinical characteristics, pathophysiology, and management. Lancet Neurol 2009; 8: 857-68.
86. Nguyen JP, Lefaucher JP, Le Guerinel C, et al. Motor cortex stimulation in the treatment of central and neuropathic pain. Arch Med Res 2000; 31: 263-5.
87. Cunha DA, Camargos S, Passos VMA, Mello CM, Vaz LS, Lima LRS. Heterotopic ossification after stroke: clinical profile and severity of ossification. J Stroke Cerebrovasc Dis 2019; 28: 513-20.
88. Paolucci S, Gandolfo C, Provinciali L, Torta R, Toso V; DESTRO Study Group. The Italian multicenter observational study on post-stroke depression (DESTRO). J Neurol 2006; 253: 556-62.
89. Mead GE, Morley W, Campbell P, Greig CA, McMurdo M, Lawlor DA. Exercise for depression. Cochrane Database Syst Rev 2009; CD004366.
90. Beaupre GS, Lew HL. Bone-density changes after stroke. Am J Phys Med Rehabil 2006; 85: 464-72.
91. Shepperd S, Lannin NA, Clemson LM, McCluskey A, Cameron ID, Barras SL. Discharge planning from hospital to home. Cochrane Database Syst Rev 2013; 1: CD000313.
92. Schmitz MA, Finkelstein M. Perspectives on poststroke sexual issues and rehabilitation needs. Top Stroke Rehabil 2010; 17: 204-13.
93. Taylor B, Davis S. The extended PLISSIT model for addressing the sexual wellbeing of individuals with an acquired disability or chronic illness. Sex Disabil 2007; 25: 135-9.
94. Perrier MJ, Korner-Bitensky N, Mayo NE. Patient factors associated with return to driving poststroke: findings from a multicenter cohort study. Arch Phys Med Rehabil 2010; 91: 868-73.
95. Devos H, Akinwuntan AE, Nieuwboer A, Truijen S, Tant M, De Weerdt W. Screening for fitness to drive after stroke: a systematic review and meta-analysis. Neurology 2011; 76: 747-56.
96. Akinwuntan AE, De Weerdt W, Feys H, et al. Effect of simulator training on driving after stroke: a randomized controlled trial. Neurology 2005; 65: 843-50.
97. Lundqvist A, Gerdle B, Rönnberg J. Neuropsychological aspects of driving after stroke: in the simulator and on the road. Appl Cogn Psychol 2000; 14: 135-50.
98. Gajardo JJ, Aravena JM. Una escala para la valoración del desempeño en uso de transporte público en el adulto mayor: EVADUT-AM. Revista Chilena de Terapia Ocupacional 2015; 15(2).
99. Baldwin C, Brusco NK. The effect of vocational rehabilitation on return to-work rates post stroke: a systematic review. Top Stroke Rehabil 2011; 18: 562-72.
100. Walker MF, Leonardi-Bee J, Bath P, et al. Individual patient data meta-analysis of randomized controlled trials of community occupational therapy for stroke patients. Stroke 2004; 35: 2226-32.
– – – –
En los últimos tiempos, con la prolongación de la vida, se ha acentuado el miedo a los achaques de la tercera edad, caracterizada por una notable decadencia física y una disminución gradual de las capacidades intelectuales. Pero la hipótesis de una decadencia irreversible de estas propiedades no se ha sometido a la confirmación de su carácter inevitable. En el juego “a cartas tapadas” de la vida, para ganar en la fase crítica del hombre, que es la vejez, lo decisivo no es un truco o la deslealtad de un tahúr, sino la capacidad de previsión y habilidad para manejar el raciocinio. La apuesta de la partida que juega el hombre es alta: transformar la vejez de la etapa más temida y penosa de la vida en la más serena, y no menos productiva que las anteriores.
Rita Levi Montalcini (1909-2012)
El as en la manga. Barcelona: Crítica, 1999, p 162-3 (traducción de L´asso nella manga a brandelli. Milán: Baldini & Castoldi, 1998)
