FERNANDO J. VAZQUEZ 1, JORGE KORIN 2, ENRIQUE M. BALDESSARI 3, FEDERICO J. CAPPARELLI 4, PAULA GUTIERREZ 5, CARLOS PALE 6, FLORENCIA BOCANEGRA 7, BEATRIZ GRAND 8, ALICIA VILASECA 9, DIANA PENCHASKY 10, MARIA MONICA GONZALEZ ALCANTARA 11, MARÍA SOL PRÉMOLI 12, ALDO TABARES 13, NESTOR WAINSZTEIN 14, DIEGO ODETTO 15, CARLOS VACCARO 16, ELENO MARTINEZ AQUINO 17, OLGA CUMPIAN 18, VERÓNICA FALABELLA 19, SANTIAGO ANTUEL GARCÍA 20, JOSÉ SAADI 21, MARIANA SICCARDI 22, ESTEBAN GANDARA 23
1Servicio de Clínica Médica, Hospital Italiano de Buenos Aires, 2 Hematología, Sanatorio Los Arcos, Buenos Aires, 3 Departamento de Medicina Interna, Fundación Favaloro, Buenos Aires, 4 Departamento de Medicina Interna, FLENI, Buenos Aires, 5 Servicio de Clínica Médica, Hospital Italiano de Buenos Aires, 6 Clínica Médica, Sanatorio Las Lomas, San Isidro, 7 Clínica Médica, Hospital Italiano de Mendoza, 8 Departamento Materno Infantil, Hospital Juan A. Fernández, Buenos Aires, 9 Hematología, Clínica San Camilo, Buenos Aires, 10 Sección Hematología, Servicio de Clínica Médica del Hospital Italiano de Buenos Aires, 11 División Obstetricia, Hospital Juan A. Fernández, 12 Hospital Español de Rosario, Santa Fe, 13 Servicio de Medicina Vascular y Trombosis, Hospital Privado Universitario de Córdoba, 14 Medicina Interna y Terapia Intensiva, Instituto FLENI, Buenos Aires, 15 Sección de Oncología Ginecológica, Servicio de Ginecología del Hospital Italiano de Buenos Aires, 16 Servicio de Cirugía General, Hospital Italiano de Buenos Aires, 17 Servicio de Clínica Médica, Sanatorio Franchin, Buenos Aires, 18 Servicio de Hematología, Hospital Español de Mendoza, 19 Clínica Médica, Sanatorio Santa Isabel, Buenos Aires, 20 Hematología y Hemoterapia, Clínica 25 de Mayo, Mar del Plata, 21 Servicio de Ginecología sección Oncológica, Hospital Italiano de Buenos Aires, 22 Hospital Español de Rosario, Santa Fe, 23 Servicio de Clínica Médica, Hospital Privado de la Comunidad, Mar del Plata, Argentina
Resumen La enfermedad tromboembólica venosa (ETV) en adultos hospitalizados posee elevada morbimortalidad, es origen de complicaciones crónicas y determina incrementos de costos para el sistema de salud. Desde la publicación de recomendaciones de tromboprofilaxis en pacientes internados en 2013, han surgido nuevas alternativas y estrategias, que nos motivaron a actualizar nuestras recomendaciones. A pesar de que existen diferentes consensos y guías de práctica clínica la adherencia a las mismas es subóptima. Se han actualizado las diferentes alternativas terapéuticas para los adultos hospitalizados (clínicos no quirúrgicos, quirúrgicos no ortopédicos, con y sin cáncer, ortopédicos y embarazadas), poniendo particular atención en los fármacos disponibles en Argentina.
Palabras clave: profilaxis, trombosis venosa, tromboembolismo de pulmón, anticoagulantes, heparina, anticoagulantes orales
Abstract Venous thromboembolic disease (VTE) in hospitalized adults has high morbidity and mortality, is the origin of chronic complications and increased cost for the health system. Since the publication of recommendations for thromboprophylaxis in hospitalized patients in 2013, new alternatives and strategies have emerged, which motivated us to update our recommendations. Although there are different consensus and clinical practice guidelines, adherence to them is suboptimal. The different therapeutic alternatives for hospitalized adult patients (non-surgical, surgical non-orthopedic, with and without cancer, orthopedic an d pregnant) have been updated, paying particular attention to the drugs available in Argentina.
Key words: prophylaxis, venous thrombosis, pulmonary embolism, anticoagulant drugs, heparin, oral anticoagulants
Dirección postal: Dr. Fernando J. Vázquez, Servicio de Clínica Médica, Hospital Italiano de Buenos Aires, Tte. Gral. J. D. Perón 4190, 2° piso, (1199) Buenos Aires, Argentina
e-mail: fernando.vazquez@hospitalitaliano.org.ar
La enfermedad tromboembólica venosa (ETV) se manifiesta más frecuentemente como trombosis venosa profunda (TVP) y tromboembolismo de pulmón (TEP)1.
Su incidencia poblacional se encuentra muy vinculada a la edad, es aproximadamente 1 cada 1000 personas de la población general 2-9 y es la tercera causa más frecuente de muerte cardiovascular, detrás del infarto de miocardio (IM) y el accidente cerebrovascular (ACV) 10.
Sin embargo, en los pacientes internados su incidencia se incrementa 10 veces y es la causa prevenible más frecuente de muerte intrahospitalaria. Por este motivo, existen diferentes consensos y guías para optimizar su prevención. A pesar de las mismas, la profilaxis es utilizada de forma subóptima 11, 12.
Una de las principales recomendaciones en la mayoría de los consensos es que cada país, y eventualmente cada centro asistencial, desarrolle sus propias guías de profilaxis, teniendo en cuenta las barreras locales y las alternativas terapéuticas disponibles. En 2013 desarrollamos y publicamos la primera versión de las guías para la profilaxis de la enfermedad tromboembólica en Argentina 13.
En los últimos años han surgido nuevas estrategias que hacen necesaria la actualización de esas guías.
Las presentes guías están destinadas a médicos clínicos, internistas, emergentólogos, generalistas, hospitalistas, hematólogos, cardiólogos, cirujanos, ortopedistas, obstetras, farmacólogos, y contiene la información más actualizada y sintetizada, para su rápida consulta. Está orientada a la profilaxis en los pacientes adultos hospitalizados.
Métodos de búsqueda bibliográfica
Se realizó una búsqueda bibliográfica de estudios haciendo particular hincapié en las publicaciones de los últimos 5 años y en las de mejor calidad metodológica disponibles.
Se priorizaron esos diseños cuando existían (revisiones sistemáticas con meta análisis, ensayos controlados aleatorizados) y otros (cohortes, recomendaciones y guías de práctica clínica de las diferentes sociedades científicas internacionales), cuando no existiera evidencia de mejor calidad. Se utilizaron las bases de datos Medline, Cochrane y Tripdatabase sin restricción de idioma.
Los autores se dividieron en grupos de trabajo, según su área de mayor experiencia, para revisar la evidencia bibliográfica en los diferentes tipos de poblaciones (con afección médica, obstétrica, cirugía en el paciente oncológico, cirugía no oncológica y ortopédica).
Después de la recopilación se realizó una categorización de la calidad de la evidencia según el método GRADE y se confeccionaron dos niveles de recomendaciones: fuertes (F) que son aquellas con alto grado de evidencia, en las cuales según la opinión de los pacientes la mayoría de los individuos en esta situación deberían beneficiarse de esa estrategia, y según la opinión de los médicos, en la mayoría de aquellos en estas condiciones se debe seguir esa estrategia; recomendaciones condicionales (C) para las que hay menor grado de evidencia. Estas últimas son aquellas en las cuales, según la opinión de los pacientes, la mayoría de los individuos en esta situación querrían recibir tratamientos según esta estrategia, pero algunos tal vez no, y en las que, según la opinión de los médicos, esas estrategias disponibles serán apropiadas para los pacientes individuales, y por lo tanto deben ayudar a cada uno a llegar a una decisión coherente con sus valores y preferencias individuales.
Los niveles de certeza según el origen de la evidencia disponible se clasifican en: Alto (⊕⊕⊕⊕) que provienen de estudios aleatorizados controlados o meta-análisis; Moderado (⊕⊕⊕) que provienen de estudios de subgrupo o con limitaciones; Bajo (⊕⊕) que provienen de estudios observacionales o con limitaciones importantes o Muy bajo (⊕) que provienen de recomendaciones de expertos.
Luego de que cada grupo redactó las recomendaciones, las mismas fueron discutidas y consensuadas por todos los expertos, para finalmente elaborar este texto.
Las medidas de tromboprofilaxis evaluadas fueron heparina no fraccionada, heparinas de bajo peso molecular, anticoagulantes orales de acción directa (DOACs), antagonistas de la vitamina K (AVK) y aspirina. Como la intención de las recomendaciones es su utilidad local, siempre se consideraron aquellas disponibles en el país en este momento. También se evaluaron las medidas profilácticas mecánicas, como compresión neumática intermitente y medias de compresión graduada.
Para facilitar su consulta, las recomendaciones más relevantes y de uso más frecuente se presentan en Tablas.
Estas recomendaciones no tienen como intención sustituir el juicio profesional, sino intentar difundir localmente buenas prácticas clínicas, de forma sencilla y resumida.
Conceptos generales sobre profilaxis
– Estas guías no deben ser utilizadas en niños (F⊕⊕⊕⊕).
– Estas guías solo aplican a pacientes que no se encuentran recibiendo anticoagulación oral previamente a su hospitalización (F⊕⊕⊕⊕).
– Se sugiere que cada institución tenga una política consensuada para la tromboprofilaxis y, cuando sea posible, que la tromboprofilaxis sea parte de los pedidos electrónicos o las instrucciones estén disponibles en papel para su uso rutinario (C⊕⊕) 15.
– Previo al inicio de la profilaxis se debe obtener de todos un hemograma, tiempo de protrombina, kPTT, recuento de plaquetas y estimación de la función renal con la fórmula de Cockcroft-Gault. (C⊕) 16.
– Todas las recomendaciones para pacientes quirúrgicos asumen que no hubo complicaciones hemorrágicas
intraoperatorias y que se obtuvo una hemostasia aceptable (F⊕) 17, 18.
– En quienes reciben heparina de bajo peso molecular no se recomienda el monitoreo de los niveles de anticuerpo antifactor X activado (anti-Xa) en forma rutinaria (C⊕⊕) 19.
– La profilaxis en aquellos con pesos extremos (<40kg o >100kg) o falla renal con clearance menor a 30 ml/min debe ser evaluada por profesionales con experiencia en situaciones complejas en trombosis (C⊕).
– Le deambulación temprana debe ser recomendada en todos en forma rutinaria, siempre que sea segura
(F⊕⊕) 20.
– No se recomienda realizar rastreo ecográfico de trombosis venosa profunda asintomática previo al alta (F⊕⊕⊕) 17, 18.
La incidencia de ETV en internados es variable pero ronda el 1% 21, 22. Existen 2 escalas de riesgo de ETV validadas para categorizar el riesgo en internados por motivos clínicos. La escala de Padua 23 (Tabla 1) y la escala IMPROVE-VTE 24 (Tabla 2). El riesgo de sangrado mayor o no mayor pero clínicamente relevante, aumenta con la profilaxis farmacológica. El sangrado mortal es 10 veces menos frecuente que el TEP fatal. El riesgo de sangrado en esta población puede evaluarse con la escala IMPROVE-Bleed 25 (Tabla 3).
Factores de riesgo en pacientes hospitalizados con enfermedades no quirúrgicas
Los principales factores de riesgo asociados a ETV durante la hospitalización son la inmovilidad prolongada (más de 2 días en cama), neoplasias activas, accidente cerebrovascular, insuficiencia cardíaca, enfermedad pulmonar obstructiva crónica, infecciones agudas, artritis reumatoidea, vasculitis con ANCA (+) y enfermedad inflamatoria intestinal.
En el grupo con afecciones clínicas se produce un 75% de los TEP fatales y es un área donde la utilización inadecuada de profilaxis antitrombótica es más frecuente.
Existe sobre-indicación en pacientes de bajo riesgo, con menor reducción de eventos trombóticos y aumento de hemorragias y una subutilización de profilaxis prolongada en los de alto riesgo, en los que la profilaxis indicada únicamente durante la internación es insuficiente
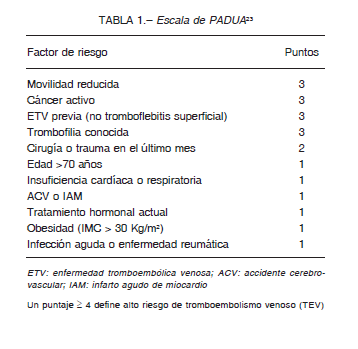
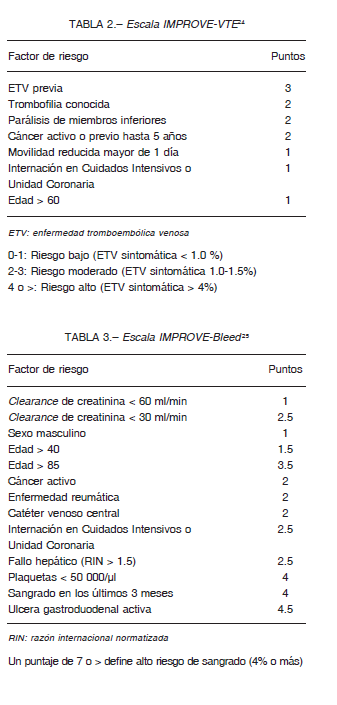
Dos escalas de riesgo han sido validadas para este grupo: la de Padua, en la que los pacientes con puntaje mayor o igual a 4 son de alto riesgo y la IMPROVE-VTE, que categoriza a los casos con puntaje mayor a 2 como de alto riesgo y como de muy alto riesgo a los que tienen > 4 puntos y/o a > 2 puntos, asociados con alguno de los siguientes criterios: valores de dímero D del doble del valor normal, edad de 75 años o mayor, antecedentes de cáncer activo y/o ETV previa. El 10-25% del total de los pacientes clínicos pertenecen al subgrupo de muy alto riesgo. Si bien el riesgo de sangrado mayor o no mayor, pero clínicamente relevante, en esta población es considerable y aumenta con profilaxis farmacológica, el riesgo de sangrado mortal es 10 veces inferior al del TEP fatal. El riesgo de sangrado puede evaluarse con la escala IMPROVE-Bleed, un puntaje mayor a 7 puntos define alto riesgo hemorrágico (4% o mayor).
En aquellos con riesgo de ETV muy alto, alto y bajo riesgo de sangrado (35-50% de los casos) al ingreso tienen indicación de recibir profilaxis hasta la externación.
Por otro lado, aquellos con alto riesgo (10-25% de los casos) deben recibir la indicación de profilaxis extendida al ser externados, para cumplirla con una duración de hasta 45 días 26.
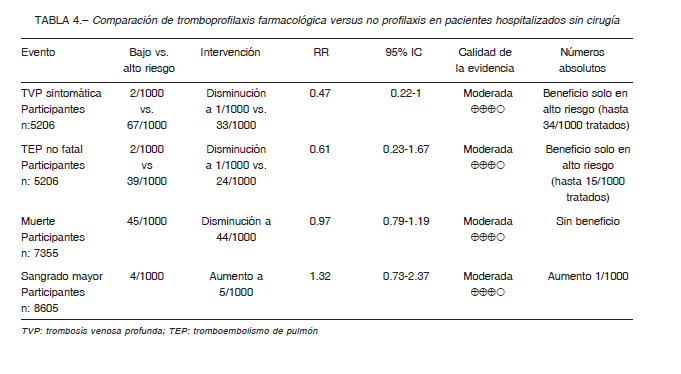
En la Tabla 4 se describen los riesgos absolutos y relativos de TVP, TEP, muerte global y sangrado mayor en la población de pacientes clínicos, comparando la profilaxis con heparina de bajo peso molecular (HBPM) contra placebo.
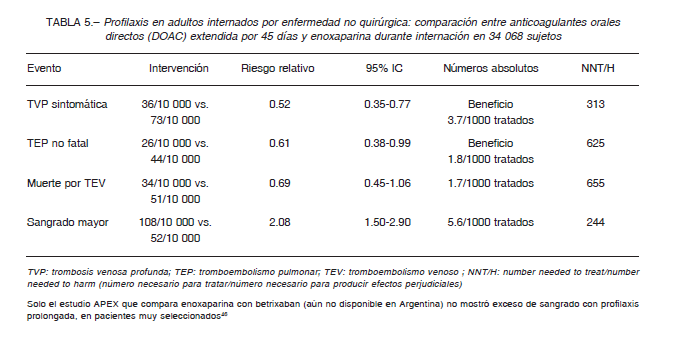
La profilaxis con anticoagulantes orales de acción directa (DOAC) en pacientes clínicos durante 45 días, ha sido comparada con la enoxaparina recibida solo durante la internación. En la Tabla 5 se muestran los resultados de un meta-análisis que incluyó 34 068 pacientes.
La profilaxis extendida en los pacientes clínicos en conjunto, sin considerar grupos de riesgo, se asocia con una reducción significativa de TVP (0.3% vs. 0.6%; OR 0.50), disminución no significativa de TEP (0.3% vs. 0.4%; OR 0.63) y de la mortalidad por TEP (0.2% vs. 0.3%; OR 0.68), pero a expensas de un incremento significativo del sangrado mayor (0.8% vs. 0.4%; OR 2.09).
Por lo tanto, actualmente el uso de profilaxis luego de la hospitalización no se considera en pacientes clínicos.
Cabe destacar como excepción al estudio APEX, que comparó a la enoxaparina con betrixaban (no disponible en nuestro país), que demostró no presentar exceso de sangrado con profilaxis prolongada con DOAC.
En accidente cerebrovascular isquémico (ACV) se recomienda iniciar la tromboprofilaxis con HBPM (como alternativa la heparina no fraccionada) dentro de las primeras 24 horas. En caso de presentar alguna contraindicación (CI) debe utilizarse profilaxis mecánica 27.
La hemorragia intracraneana (HIC) se asocia a TEP (2%), TVP sintomática (4%) y asintomática (hasta 16%)28 y por lo tanto requiere estrategias de profilaxis 29-30. El 70% de los sujetos con HIC presentan algún grado de expansión en las primeras 24 h, y por eso deben ser reevaluados con tomografía antes de iniciar la profilaxis farmacológica. Los microsangrados múltiples por angiopatía amiloide y los hematomas lobares extensos tienen mayor riesgo de resangrado 31.
En estos se recomienda indicar profilaxis mecánica con compresión neumática intermitente -CNI- (o medias de compresión graduada -MCG- como alterativa) en las primeras 48 a 72 horas del cese del sangrado y a partir de ese momento agregar profilaxis farmacológica 29.
En los aquellos con hemorragia subaracnoidea aneurismática se recomienda indicar CNI o MCG hasta 48 a 72 h después de la resolución de exclusión vascular o quirúrgica del aneurisma, y posteriormente agregar profilaxis farmacológica 32.
Las contraindicaciones de la tromboprofilaxis farmacológica (que se aplican a todos los hospitalizados) son hemorragia activa clínicamente importante, plaquetopenia < 30 000/ml, trastorno hemorrágico mayor, hemorragia intracraneal activa, hemorragia peri espinal reciente y cirugía reciente de alto riesgo de sangrado.
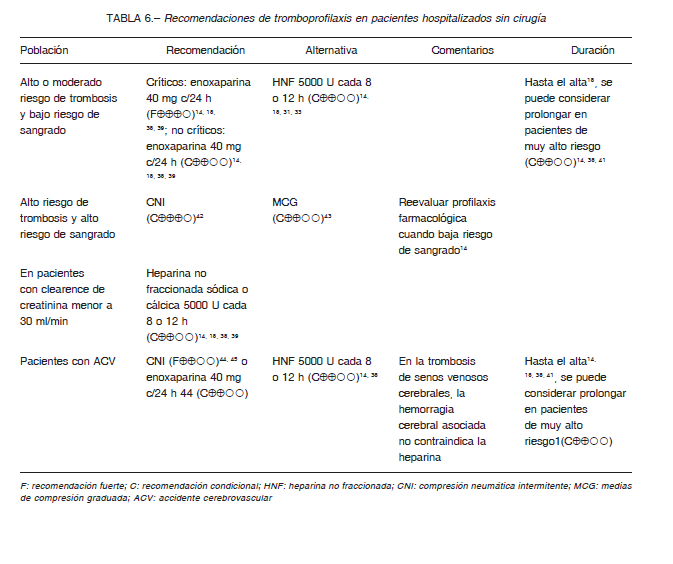
Recomendaciones generales de tromboprofilaxis en pacientes hospitalizados por enfermedades clínicas (Tabla 6)
– En los no quirúrgicos internados con riesgo aumentado de ETV se recomienda la evaluación del riesgo de trombosis y hemorragia con las escalas de riesgo disponibles (F⊕⊕⊕) 23, 40, 41 .
– La tromboprofilaxis farmacológica está recomendada por sobre la mecánica en la mayoría de los que puedan recibirla (C⊕) 14, 18-41 y debe iniciarse dentro de las primeras 12 horas de la admisión.
– Se debe considerar profilaxis extendida individualizando a aquellos con riesgo muy alto (C⊕) 14, 35.
– Los internados por enfermedad psiquiátrica aguda deben ser evaluados de la misma manera que los que son internados por enfermedad médica aguda ( C⊕)14, 35.
– Los pacientes con persistencia indefinida de factores de riesgo [inmovilidad, edad avanzada, antecedentes de tromboembolismo venoso (TEV)] deben ser evaluados en forma individualizada para decidir el tiempo total de profilaxis.
– Los anticoagulantes de acción directa deben ser evitados en esta población, salvo que sean por otra indicación (F⊕⊕⊕)29, 37,47.
– Se recomienda evaluar el uso de compresión neumática intermitente (CNI) o medias de compresión graduada (MCG) (F⊕⊕⊕) 23, 33,34.
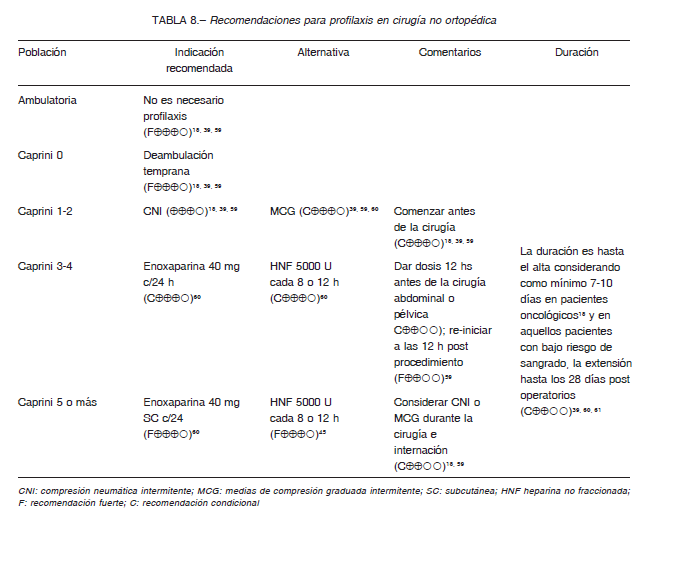
Profilaxis en pacientes quirúrgicos no ortopédicos
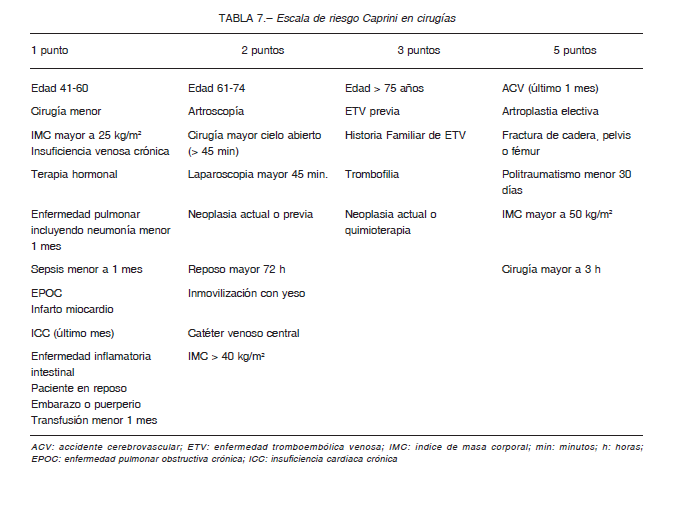
En los procedimientos quirúrgicos no ambulatorios el riesgo de ETV, cuando no se utiliza tromboprofilaxis, es variable y depende de la combinación de los factores de riesgo propios del paciente y del tipo de cirugía. Por ese motivo, siempre se debe estratificar el riesgo individual. Se recomienda utilizar la escala de Caprini (Tabla 7). Los enfermos sometidos a cirugía general con riesgo trombótico moderado o mayor (3 puntos o más) y sin riesgo incrementado de sangrado deben recibir tromboprofilaxis farmacológica (los detalles se muestran en la Tabla 8).
Algunas situaciones especiales
No requieren profilaxis farmacológica los procedimientos transuretrales y las cirugías laparoscópicas de corta duración (menos de 45 minutos).
La cirugía del sistema nervioso central tiene riesgo elevado de ETV (hasta el 30%) 47-49, en particular aquellos casos con cáncer, edad avanzada, déficit motor de miembro inferior y cirugías prolongadas y también riesgo elevado de de HIC (1%)50 en las primeras 24 horas. En la craniectomía por enfermedad vascular o benigna se debe indicar la profilaxis con CNI y a las 48 horas, si no hay riesgo adicional de sangrado, iniciar la profilaxis con HBPM. En casos de craneotomía por neoplasia o factores de riesgo adicionales propios del paciente (cáncer fuera del SNC, parálisis de miembros inferiores, ETV previa, asistencia respiratoria mecánica) indicar CNI las primeras 24 horas y luego combinar con HBPM
En la cirugía espinal de alto riesgo (neoplasia, ETV previa, obesidad, intervención anterior y posterior, parálisis motora o asistencia respiratoria mecánica) indicar CNI y combinar a las 48 horas, con adecuada hemostasia, HBPM.
En quienes presentan una lesión medular aguda, se sugiere realizar profilaxis con CNI (o MCG como alternativa) las primeras 72 horas para evitar la transformación hemorrágica y luego agregar HBPM.
En los enfermos sometidos a cirugía laparoscópica se debe utilizar la escala de Caprini para individualizar el riesgo de ETV.
Los que reciben anestesia epidural o raquídea y analgesia epidural tienen riesgo bajo de desarrollar complicaciones hemorrágicas, pero sus consecuencias son graves (isquemia medular y paraplejía) y el riesgo puede incrementarse con los antitrombóticos51-54. Si el paciente se encuentra recibiendo HBPM, el procedimiento se debe realizar 12 horas después de la última dosis profiláctica y 24 horas después en caso de dosis terapéuticas. El retiro del catéter se debe realizar inmediatamente antes de la dosis de HBPM y se debe esperar como mínimo 2 horas para reiniciarla. En el caso de recibir profilaxis con heparina no fraccionada (HNF), se debe realizar la colocación del catéter 12 horas después de la última dosis y removerlo una hora antes de la siguiente dosis.
Recomendaciones para profilaxis en pacientes quirúrgicos no ortopédicos
– En los sometidos a cirugía se debe valorar el riesgo de trombosis y sangrado (F⊕).
– Se debe individualizar la profilaxis con la escala de Caprini (Tabla 8) para estratificar el riesgo de trombosis (F⊕⊕) 18, 56-58. La tromboprofilaxis está recomendada en todos los casos con riesgo moderado (C⊕⊕) o alto (F⊕⊕⊕) 18, 49-55.
– Evaluar el inicio de tromboprofilaxis en todos los que ingresen de urgencia, al momento de ser admitidos, y periódicamente hasta la externación (F⊕) 18.
– Los modelos para predecir sangrado no se encuentran correctamente validados (C⊕⊕).
– La deambulación temprana está recomendada en todos los pacientes (F⊕⊕).
En la Tabla 9 se describen las recomendaciones para profilaxis en las cirugías no ortopédicas.
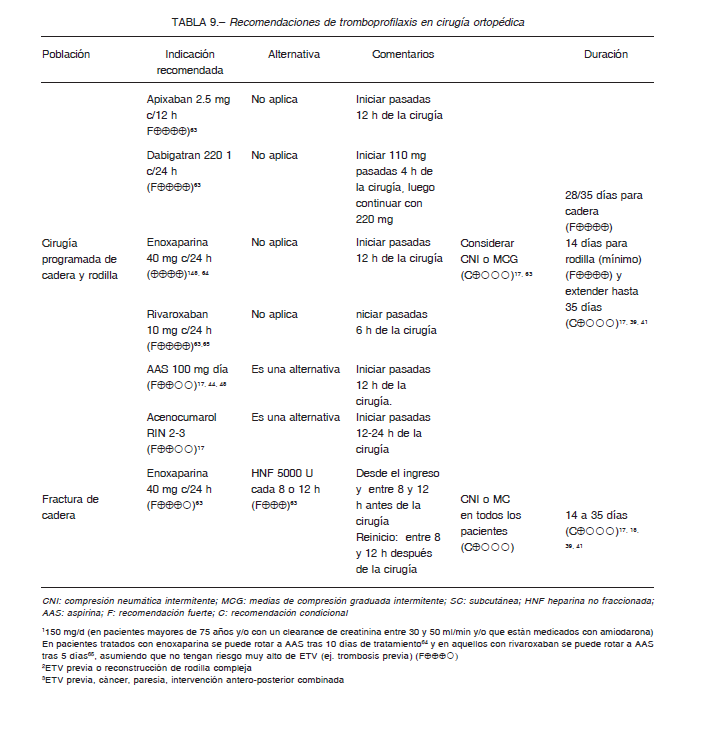
Recomendaciones para profilaxis en pacientes con enfermedad ortopédica
La cirugía ortopédica mayor engloba a la artroplastia total de cadera (ATC) y rodilla (ATR) y a la cirugía por fractura de cadera (CFC), que tienen elevado riesgo de complicaciones trombóticas (40-60%) sin la tromboprofilaxis adecuada. El riesgo inherente a estos tipos de cirugía es tan elevado que requieren siempre profilaxis farmacológica, independientemente de los factores de riesgo individuales. Los esquemas de profilaxis para estas cirugías se presentan en la Tabla 9.
La artroscopía de rodilla diagnóstica y/o terapéutica es un procedimiento habitualmente ambulatorio y se
recomienda la deambulación precoz; solo se debe considerar profilaxis con HBPM durante por lo menos 7 días, en aquellos portadores de mayor riesgo trombótico por una neoplasia, por antecedentes de ETV, por obesidad, embarazo o puerperio.
En las fracturas, ruptura tendinosa, cartilaginosa o de partes blandas infrapatelares con o sin cirugía, pero con inmovilización prolongada (mayor a 7 días) y algunos de los factores de riesgo mencionados anteriormente, se recomienda indicar profilaxis farmacológica con HBPM, debido a la reducción significativa de eventos de ETV y al bajo riesgo de sangrados (0.3%) 55.
En los operados de la columna se debe indicar siempre profilaxis mecánica con MCG y deambulación precoz. En aquellos enfermos con procedimientos prolongados (mayor de una hora) e intervención anterior y/o con factores de riesgo de ETV propios, se debe indicar profilaxis a partir de las 24 horas del postoperatorio con enoxaparina 40 mg por día, nadroparina 0.6 ml por día o HNF 5000 UI SC, cada 8-12 h, hasta la externación.
Los pacientes con traumatismos mayores deben recibir profilaxis mecánica con CNI (alternativamente con MCG) y enoxaparina, 40 mg por día, si no presentan incremento en el riesgo de sangrado, desde el ingreso y hasta el alta (con rehabilitación incluida).
Recomendaciones de tromboprofilaxis en obstetricia
La hemorragia postparto es la primera causa de muerte materna en países en vías de desarrollo y la ETV es la primera en los desarrollados 70-72. La embarazada tiene 4 a 10 veces incrementado el riesgo de ETV con respecto a una mujer en edad fértil no embarazada 72. Actualmente, la edad materna al embarazo se ha incrementado por la utilización de las técnicas de reproducción asistida (TRA). La incidencia de ETV es de 1-2 × 1000 embarazos, si bien la incidencia es baja, la ETV es una causa prevenible de muerte materna 73-75. El incremento del riesgo de ETV durante el embarazo se relaciona con cambios hormonales fisiológicos y de la coagulación, y disminución del retorno venoso desde los miembros inferiores por el efecto compresivo del útero sobre las venas pelvianas. El riesgo comienza a aumentar desde el principio del embarazo y se incrementa en las últimas semanas y hasta la sexta semana del puerperio.
El riesgo de recurrencia durante el embarazo aumenta entre 3 y 4 veces (RR, 3.5; IC 95% 1.6-7.8). Entre 15 y 25% de todos los casos de ETV durante el embarazo son eventos recurrentes.
La calidad de la evidencia de tromboprofilaxis es baja y como no hay escalas predictivas validadas para el embarazo, la identificación de la población que debe recibirla se basa en la identificación de factores de riesgo trombótico individuales.
Los factores de riesgo mayor (con uno de ellos presente, el riesgo de ETV es de 3% o mayor) son el
reposo estricto (> 1 semana), hemorragia postparto con necesidad de cirugía de urgencia, preeclampsia con retardo del crecimiento intrauterino, obesidad con índice de masa corporal (IMC) > 40 kg/m2, diabetes con síndrome nefrotico, requerimiento de transfusión de glóbulos rojos, infección postparto, síndrome antifosfolipídico (SAF), enfermedad inflamatoria intestinal, lupus eritematoso sistémico, enfermedad oncológica, insuficiencia cardíaca grave y drepanocitosis.
Los factores de riesgo menores son obesidad con IMC > a 30 kg/m2, edad mayor a 35 años, diabetes, inmovilidad mayor a 3 días, retardo del crecimiento intrauterino, preeclampsia grave, placenta previa, feto muerto, tabaquismo, insuficiencia venosa con várices, hemorragia mayor a 1 litro con parto vaginal, embarazo gemelar, fertilización in vitro e hiperemésis gravídica.
Se requieren dos factores de riesgo menores o uno asociado a cesárea de urgencia para alcanzar 3% de riesgo de ETV.
Recomendaciones
En las mujeres que tienen parto vaginal o cesárea sin factores de riesgo agregados se sugiere indicar la deambulación precoz (C⊕⊕).
Después de la cesárea en una paciente con 1 factor de riesgo mayor o 2 menores (en aquellas mujeres con un riesgo trombótico de 3% o mayor) se sugiere indicar enoxaparina 40 mg por día o como alternativa HNF (cada 8 12 horas SC) (C⊕⊕).
En aquellas con antecedente de ETV no provocada o asociada a embarazo o tratamiento hormonal se recomienda indicar enoxaparina 40 mg por día durante el embarazo (C⊕⊕) 18, 39, 76 y 6 semanas postparto (C⊕⊕) 18, 39, 76-77. La HNF cada 12 horas es una alternativa, pero se sugiere aumentar la dosis en el tercer trimestre a 15000 o 20000 UI por día (C⊕) 18, 39, 76-77.
En las pacientes con antecedente de ETV provocada, no asociada a embarazo o tratamiento hormonal, no se
recomienda profilaxis antes del parto (C⊕) 18, 39, 70, 76-77, e indicar enoxaparina 40 mg cada 24 horas después del parto y hasta 6 semanas postparto (C⊕⊕) 18, 39, 70, 76-77.
Se recomienda no indicar profilaxis en mujeres en trabajo de parto o que esperan una cesárea en las próximas 12 horas (C⊕) 18, 39, 70, 76-77.
La profilaxis en pacientes ambulatorias portadoras de trombofilias sin trombosis previas y con múltiples factores de riesgo con antecedentes familiares de ETV, deben ser evaluadas por expertos en trombosis y embarazo (F⊕) para evaluar la profilaxis anteparto 18, 39, 70, 76-77.
Conflicto de intereses: Fernando Vazquez, Enrique Baldessari, Diana Penchasky y Aldo Tabares declaran haber recibido becas de Sanofi Aventis para asistir a congresos médicos y honorarios como oradores de capacitación; Esteban Gándara declara haber recibido becas de Sanofi SA para asistir a congresos médicos y honorarios de Bayer como orador sobre rivaroxaban; Jorge Korin es miembro del Advisory Board de Bayer para rivaroxaban en la Argentina; Beatriz Grand declara que ha participado del Advisory Board Nacional (Noviembre,2018) e Internacional (Marzo,2019) de heparinas de bajo peso molecular; honorarios por charlas docentes y becas para congresos de Sanofi Aventis. El resto de los autores no tienen conflicto de intereses para declarar.
Bibliografía
1. Hirsh J, Hoak J. Management of deep vein thrombosis and pulmonary embolism. A statement for healthcare professionals. Council on Thrombosis (in consultation with the Council on Cardiovascular Radiology), American Heart Association. Circulation 1996; 93: 2212-45.
2. Vazquez FJ, Posadas-Martinez ML, Vicens J, et al. Incidence rate of symptomatic venous thromboembolic disease in patients from a medical care program in Buenos Aires, Argentina: a prospective cohort. Thromb J 2013; 11:16-21.
3. Spencer FA, Emery C, Lessard D, et al. The Worcester Venous Thromboembolism study: a population-based study of the clinical epidemiology of venous thromboembolism. J Gen Intern Med 2006; 21: 722-7.
4. Oger E. Incidence of venous thromboembolism: a community-based study in Western France. EPI-GETBP Study Group. Groupe d’Etude de la Thrombose de Bretagne Occidentale. Thromb Haemost 2000; 83: 657-60.
5. Silverstein MD, Heit JA, Mohr DN, Petterson TM, O’Fallon WM, Melton LJ, 3rd. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch Intern Med 1998; 158: 585-93.
6. Guyatt GH, Akl EA, Crowther M, Schunemann HJ, Gutterman DD, Zelman Lewis S. Introduction to the ninth
edition: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: 48S-52S.
7. Mordeglia F, Gandulla L, Bertorello M, O’Flaherty E, Gil M. Tromboembolismo pulmonar agudo. Estudio de 140 casos con confirmación por necropsia. Medicina (B Aires) 1977; 37:112-26.
8. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353: 1386-9.
9. Anderson FA Jr, Wheeler HB, Goldberg RJ, et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT Study. Arch Intern Med 1991; 151: 933-8.
10. Wendelboe AM, Raskob GE. Global burden of thrombosis: Epidemiologic aspects. Circulation research 2016; 118: 1340-7.
11. Korin JD, Sanchez Avalos JC. Profilaxis del tromboembolismo venoso, si pero… Medicina (B Aires) 1996; 56: 299-307.
12. Cohen AT, Tapson VF, Bergmann JF, et al. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational crosssectional study. Lancet 2008; 371: 387-94.
13. Vazquez FJ, Lifschitz E, Watman R, et al. Guía de recomendaciones para la profilaxis de la enfermedad tromboembólica venosa en adultos en la Argentina. Medicina (B Aires) 2013; 73 Suppl 2: 1-26.
14. Schunemann HJ, Cushman M, Burnett AE, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: prophylaxis for hospitalized and nonhospitalized medical patients. Blood Advances 2018; 2: 3198-225.
15. Kahn SR, Morrison DR, Diendere G, et al. Interventions for implementation of thromboprophylaxis in hospitalized patients at risk for venous thromboembolism. Cochrane Database Syst Rev 2018; 4: CD008201.
16. Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018; 39: 1330-93.
17. Falck-Ytter Y, Francis CW, Johanson NA, et al. Prevention of VTE in orthopedic surgery patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e278S-e325S.
18. Clinical Guideline Thrombosis Canada – Thrombose Canada. Thromboprophylaxis. En: https://thrombosiscanada.ca/clinicalguides/#; consultado junio 2019.
19. Garcia DA, Baglin TP, Weitz JI, Samama MM. Parenteral anticoagulants: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e24S-e43S.
20. Munin MC, Rudy TE, Glynn NW, Crossett LS, Rubash HE. Early inpatient rehabilitation after elective hip and knee arthroplasty. JAMA 1998; 279: 847-52.
21. Grande Ratti MF, Posadas-Martinez ML, Vicens J, Gonzalez Bernaldo de Quiros F, Vazquez FJ, Giunta DH. Incidence of hospital-acquired venous thromboembolic disease. Revista de la Facultad de Ciencias Médicas 2018; 75: 82-7.
22. Stubbs JM, Assareh H, Curnow J, Hitos K, Achat HM. Incidence of in-hospital and post-discharge diagnosed hospital-associated venous thromboembolism using linked administrative data. Int Med J 2018; 48: 157-65.
23. Barbar S, Noventa F, Rossetto V, et al. A risk assessment model for the identification of hospitalized medical patients at risk for venous thromboembolism: the Padua Prediction Score. J Thromb Haemost 2010; 8: 2450-7.
24. Rosenberg D, Eichorn A, Alarcon M, McCullagh L, McGinn T, Spyropoulos AC. External validation of the risk assessment model of the International Medical Prevention Registry on Venous Thromboembolism (IMPROVE) for medical patients in a tertiary health system. J Am Heart Assoc 2014; 3: e001152.
25. Rosenberg DJ, Press A, Fishbein J, et al. External validation of the IMPROVE Bleeding Risk Assessment Model in medical patients. Thromb Haemost 2016; 116: 530-6.
26. Spyropoulos AC1, Raskob GE. New paradigms in venous thromboprophylaxis of medically ill patients.Thromb Haemost 2017; 117: 1662-70.
27. Sherman DG, Albers GW, Bladin C, et al. The efficacy and safety of enoxaparin versus unfractionated heparin for the prevention of venous thromboembolism after acute ischaemic stroke (PREVAIL Study): an openlabel randomised comparison. Lancet 2007; 369: 1347-55.
28. Goldstein JN1, Greenberg SM. Should anticoagulation be resumed after intracerebral hemorrhage? Cleve Clin J Med 2010; 77: 791-9.
29. Kahn SR, Lim W, Dunn AS, et al. Prevention of VTE in nonsurgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e195S-e226S.
30. Morgenstern LB, Hemphill JC 3rd, Anderson C, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2010;41: 108-29.
31. Lukovits TG, Goddeau RP Jr. Critical care of patients with acute ischemic and hemorrhagic stroke: update on recent evidence and international guidelines. Chest 2011; 139: 694-700.
32. Paciaroni M, Agnelli G, Venti M, Alberti A, Acciarresi M, Caso V. Efficacy and safety of anticoagulants in the prevention of venous thromboembolism in patients with acute cerebral hemorrhage: a meta-analysis of controlled studies. J Thromb Haemost 2011; 9: 893-8.
33. Spyropoulos AC, Anderson FA Jr, FitzGerald G, et al. Predictive and associative models to identify hospitalized medical patients at risk for VTE. Chest 2011;140: 706-14.
34. Decousus H, Tapson VF, Bergmann JF, et al. Factors at admission associated with bleeding risk in medical patients: findings from the IMPROVE investigators. Chest 2011;139: 69-79.
35. Patel R. Venous thromboembolism prophylaxis in mental healthcare: do the benefits outweigh the risks? BJ Psych Bulletin 2015; 39: 61-4.
36. Spyropoulos AC, Ageno W, Albers GW, et al. Rivaroxaban for thromboprophylaxis after hospitalization for medical iIlness. N Engl J Med 2018;379: 1118-27.
37. Goldhaber SZ, Leizorovicz A, Kakkar AK, et al. Apixaban versus enoxaparin for thromboprophylaxis in medically ill patients. N Engl J Med 2011;365: 2167-77.
38. Qaseem A, Chou R, Humphrey LL, Starkey M, Shekelle P. Clinical Guidelines Committee of the American College of P. Venous thromboembolism prophylaxis in hospitalized patients: a clinical practice guideline from the American College of Physicians. Ann Intern Med 2011;155: 625-32.
39. NG. Venous thromboembolism in over 16s: reducing the risk of hospital-acquired deep vein thrombosis or pulmonary embolism. 2018. En: https://www.nice.org.uk › guidance, consultado junio 2019.
40. Qaseem A, Chou R, Humphrey LL, Starkey M, Shekelle P. Venous thromboembolism prophylaxis in hospitalized patients: a clinical practice guideline from the American College of Physicians. Ann Intern Med 2011;155: 625-32.
41. Tao DL, Bien JY, DeLoughery TG, Shatzel JJ. Extended thromboprophylaxis with direct oral anticoagulants for medical patients: a systematic review and meta-analysis. Blood 2017;129: 653-55.
42. Lauvrak V, Hafstad E, Fure B. Intermittent pneumatic compression to prevent venous thromboembolism in
hospitalized patients: Systematic Scoping Review. NIPH Systematic Reviews: Executive Summaries. Oslo, Norway, 2016.
43. Sachdeva A, Dalton M, Lees T. Graduated compression stockings for prevention of deep vein thrombosis. Cochrane Database Syst Rev 2018;11: CD001484.
44. Dennis M, Caso V, Kappelle LJ, Pavlovic A, Sandercock P; European Stroke Organistacion. European Stroke Organisation (ESO) guidelines for prophylaxis for venous thromboembolism in immobile patients with acute ischaemic stroke. Eur Stroke J 2016; 1: 6-19.
45. Zhang D, Li F, Li X, Du G. Effect of intermittent pneumatic compression on preventing deep vein thrombosis among stroke patients: a systematic review and meta-analysis. Worldviews Evid Based Nurs 2018;15: 189-96.
46. Cohen AT, Harrington RA, Goldhaber SZ, et al. Extended thromboprophylaxis with betrixaban in acutely Ill medical patients. N Engl J Med 2016; 375: 534-44.
47. Hamilton MG, Hull RD, Pineo GF. Prophylaxis of venous thromboembolism in brain tumor patients. J Neurooncol 1994; 22: 111-26.
48. Hamilton MG, Hull RD, Pineo GF. Venous thromboembolism in neurosurgery and neurology patients: a review. Neurosurgery 1994; 34: 280-96; Discussion p 296.
49. Semrad TJ, O’Donnell R, Wun T, et al. Epidemiology of venous thromboembolism in 9489 patients with malignant glioma. J Neurosurg 2007;106: 601-8.
50. Ganau M, Prisco L, Cebula H, et al. Risk of deep vein thrombosis in neurosurgery: State of the art on prophylaxis protocols and best clinical practices. J Clin Neurosci 2017;45: 60-66.
51. Horlocker TT, Wedel DJ, Rowlingson JC, et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Third Edition). Reg Anesth Pain Med 2010; 35: 64-101.
52. Horlocker TT. Regional anaesthesia in the patient receiving antithrombotic and antiplatelet therapy. Br J Anaesth 2011; 107 Suppl 1: 96-106.
53. Horlocker TT. Complications of regional anesthesia and acute pain management. Anesthesiol Clin 2011; 29: 257-78.
54. Horlocker TT, Neal JM, Rathmell JP. Practice advisories by the American Society of Regional Anesthesia and Pain Medicine: grading the evidence and making the grade. Reg Anesth Pain Med 2011; 36: 1-3.
55. Testroote M, Stigter W, de Visser DC, Janzing H. Low molecular weight heparin for prevention of venous thromboembolism in patients with lower-leg immobilization. Cochrane Database Syst Rev 2008; 8: CD006681.
56. Caprini JA. Thrombosis risk assessment as a guide to quality patient care. Disease-a-month DM 2005; 51: 70-8.
57. Pannucci CJ, Bailey SH, Dreszer G, et al. Validation of the Caprini risk assessment model in plastic and reconstructive surgery patients. J Am Coll Surg 2011; 212: 105-12.
58. Obi AT, Pannucci CJ, Nackashi A, et al. Validation of the Caprini venous thromboembolism risk assessment model in critically Ill surgical patients. JAMA Surgery 2015; 150: 941-8.
59. Gould MK, Garcia DA, Wren SM, et al. Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e227S-77.
60. Mismetti P, Laporte S, Darmon JY, Buchmuller A, Decousus H. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery. Br J Surg 2001; 88: 913-30.
61. Felder S, Rasmussen MS, King R, et al. Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. Cochrane Database Syst Rev 2018; 11: CD004318.
62. Di Nisio M, Peinemann F, Porreca E, Rutjes AW. Primary prophylaxis for venous thromboembolism in patients undergoing cardiac or thoracic surgery. Cochrane Database Syst Rev 2015: CD009658.
63. Balk EM, Ellis AG, Di M, Adam GP, Trikalinos TA. Venous thromboembolism prophylaxis in major orthopedic surgery: systematic review update. AHRQ Comparative Effectiveness Reviews 2017.
64. Anderson DR, Dunbar MJ, Bohm ER, et al. Aspirin versus low-molecular-weight heparin for extended venous thromboembolism prophylaxis after total hip arthroplasty: a randomized trial. Ann Intern Med 2013; 158: 800-6.
65. Anderson DR, Dunbar M, Murnaghan J, et al. Aspirin or rivaroxaban for VTE prophylaxis after hip or knee arthro-plasty. N Engl J Med 2018; 378: 699-707.
66. Haldane CE, Ekhtiari S, de Sa D, et al. Venous thromboembolism events after hip arthroscopy: A systematic review. Arthroscopy 2018; 34:321-30 e1.
67. Zheng G, Tang Q, Shang P, Pan XY, Liu HX. No effectiveness of anticoagulants for thromboprophylaxis after non-major knee arthroscopy: A systemic review and meta-analysis of randomized controlled trials. J Thromb Thrombolysis 2018; 45:562-70.
68. Zee AA, van Lieshout K, van der Heide M, Janssen L, Janzing HM. Low molecular weight heparin for prevention of venous thromboembolism in patients with lower-limb immobilization. Cochrane Database Syst Rev 2017; 8: CD006681.
69. Mosenthal WP, Landy DC, Boyajian HH, et al. Thromboprophylaxis in spinal surgery. Spine 2018; 43: E474-81.
70. NICE RCoOG-. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. 2015;
Guideline N° 37. En: https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
71. Greer IA. Prevention of venous thromboembolism in pregnancy. Eur J Med Res 2004; 9: 135-45.
72. Pomp ER, Lenselink AM, Rosendaal FR, Doggen CJ. Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. J Thromb Haemost 2008; 6: 632-7.
73. Virkus RA, Lokkegaard EC, Bergholt T, Mogensen U, Langhoff- Roos J, Lidegaard O. Venous thromboembolism in pregnant and puerperal women in Denmark 1995-2005. A national cohort study. Thromb Haemost 2011;106: 304-9.
74. James AH, Abel DE, Brancazio LR. Anticoagulants in pregnancy. Obstet Gynecol Surv 2006; 61: 59-69; quiz 70-72.
75. Gherman RB, Goodwin TM, Leung B, Byrne JD, Hethumumi R, Montoro M. Incidence, clinical characteristics, and timing of objectively diagnosed venous thromboembolism during pregnancy. Obstet Gynecol 1999; 94: 730-4.
76. Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e691S-736.
77. Bates SM, Rajasekhar A, Middeldorp S, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood advances 2018; 2: 3317-59.
