HERNÁN COHEN ARAZI 1, 2, RICARDO IGLESIAS 1, ERNESTO DURONTO 3, ADRIÁN LESCANO 4, ROXANA CAMPISI 5, ALEJANDRO DEVIGGIANO 5, CHRISTIAN CAROLI 6, SEBASTIÁN NANI 7, JAVIER MARIANI 8, DANIEL COMTESSE 9, SILVIA ZANOTTI 10, JUAN CARLOS KASKI 11
1 Servicio de Cardiología, Sanatorio Trinidad Mitre, 2 Servicio de Cardiología, Centro Médico Lezica, 3 Servicio de Cardiología, Fundación Favaloro, 4 Área de Investigación, Sociedad Argentina de Cardiología, 5 Servicio de Imágenes, Diagnóstico Maipú, 6 Unidad Médica Presidencial Argentina, 7 Servicio de Cardiología, Clínica Olivos, 8 Servicio de Cardiología, Hospital del Cruce Florencio Varela, 9 Servicio de Cardiología, Sanatorio las Lomas, 10 Consejo de Prevención, Sociedad Argentina de Cardiología, Buenos Aires, Argentina, 11 St George’s, University of London, United Kingdom
Resumen Una de cada 4 coronariografías realizadas por isquemia miocárdica presenta lesiones menores al 50% Este dato desencadenó un creciente interés en la comunidad médica. La Sociedad Americana de Cardiología publicó recientemente un artículo que describe la posición consensuada de un grupo de expertos sobre la fisiopatología, el diagnóstico y el tratamiento de esta entidad. Nuestro trabajo refleja una revisión narrativa y la posición de un grupo de expertos pertenecientes a diferentes instituciones con servicios de Cardiología jerarquizados. Aborda aspectos fisiopatológicos y diagnósticos para comprender el enfoque actual del tratamiento, tanto en pacientes que ingresan con diagnóstico de MINOCA (infa rto de miocardio con lesiones angiográficas no graves) o de INOCA (angina e isquemia demostradas, pero sin lesiones coronarias que justifiquen este síndrome).
Palabras clave: MINOCA, INOCA, coronarias, cinecoronariografía
Abstract Review for decision making. One in every four coronarographies performed to study myocardial ischemia shows coronary angiographic stenosis less than 50%. This data triggered an increasing interest in the medical community. The American Society of Cardiology recently published a position paper about the pathophysiology, diagnosis and treatment of this entity. Our group performed a narrative review reflecting the opinion of cardiology experts from different centers in Argentina. It aims physiopatologic and diagnostic aspect to understand the current approach in patients with MINOCA (myocardial infarction with non-obstructive coronary arteries) e INOCA (demonstrated angina and ischemia but without coronary lesions that justify this syndrome).
Key words: MINOCA, INOCA, coronary, cinecoronariography
Dirección postal: Hernán Cohen Arazi, Servicio de Cardiología, Sanatorio Trinidad Mitre, Bartolomé Mitre 2553, 1039 Buenos Aires, Argentina
e-mail: H_c_arazi@yahoo.com
La presencia de isquemia miocárdica, aguda o crónica, tradicionalmente es atribuida a una disminución de la perfusión miocárdica causada por una placa coronaria que provoca una obstrucción significativa del vaso epicárdico (> 70%). Sin embargo, la evidencia actual muestra que la disfunción microvascular coronaria (DMC) es frecuentemente la causa de angina e isquemia miocárdica, junto a la enfermedad coronaria obstructiva y el vasoespasmo de los vasos epicárdicos 1, 2.
Es importante incorporar el concepto de angina microvascular en la práctica clínica, ya que datos del registro del American College of Cardiology-National Cardiovascular Data Registry (y las bases de datos WISE (Women’s Ischemic Syndrome Evaluation) patrocinadas por el Instituto Nacional del Corazón, Pulmón y Sangre en EE.UU., sugieren que al menos 3 a 4 millones de mujeres y hombres con signos o síntomas sugestivos de isquemia miocárdica no tienen obstrucción coronaria significativa 3. Los síndromes clínicos caracterizados por “angina con coronarias sin lesiones angiográficas significativas “(ACAnoS), enmarcan globalmente dos diagnósticos denominados con los acrónimos INOCA y MINOCA, según se presente como un cuadro crónico o un síndrome coronario agudo (SCA), respectivamente.
INOCA (ischemia and non-obstructive coronary artery disease) agrupa un conjunto de enfermedades heterogéneas, caracterizadas por presentar signos y síntomas de isquemia miocárdica crónica, en ausencia de lesiones coronarias obstructivas mayores al 50% evaluadas por angiografía convencional. La importancia de este síndrome radica en la complejidad del cuadro clínico, la pobre calidad de vida del paciente y en que los pacientes tienen mayor riesgo de sufrir eventos cardiovasculares, incluyendo internaciones por insuficiencia cardíaca, muerte súbita e infarto de miocardio 4-6.
Existen diferentes hipótesis sobre el mecanismo que ocasiona INOCA, pero la DMC juega un papel primordial.
La DMC puede presentarse como una alteración de la capacidad vasodilatora de la microcirculación coronaria (causando angina de esfuerzo primordialmente) o como espasmo microvacular (desencadenando angina en reposo); la combinación de estos mecanismos en el mismo individuo no es infrecuente. Se han sugerido varias causas para la DMC, entre ellas la disfunción endotelial asociada a mecanismos inflamatorios de diverso tipo 7, alteración del tono autonómico 8, alteración del transporte de iones a través de las membranas celulares 9, aumentos de la liberación de endotelina-1 10, y deficiencia de estrógenos 11.
MINOCA (myocardial infarction with non-obstructed coronary arteries) incluye un conjunto de enfermedades caracterizadas por daño miocárdico patognomónico de infarto agudo de miocardio, con o sin alteraciones del electrocardiograma (ECG), en ausencia de lesiones coronarias obstructivas mayores del 50% en la angiografía convencional 12, 13.
Causas de MINOCA:
1. Condiciones cardíacas asociadas a isquemia miocárdica:
a. Ruptura o erosión de placa
b. Embolia coronaria
c. Espasmo coronario
d. Puente muscular
e. Disección coronaria espontánea
f. Angina microvascular
g. Flujo coronario lento (síndrome Y)
2. Condiciones cardíacas no asociadas a isquemia:
a. Miocarditis
b. Síndrome de Takotsubo
3. Causas no cardíacas:
a. Tromboembolismo pulmonar (TEP)
b. Accidente cerebrovascular (ACV)
c. Sepsis
Este articulo presenta una revisión del tema “angina e infarto de miocardio con arterias coronarias angiográficamente normales” y propone modalidades de diagnóstico y tratamiento que pueden ser de utilidad en la práctica clínica. Con excepción de los datos de prevalencia, que se presentan conjuntamente para INOCA y MINOCA, otros aspectos de estas enfermedades se presentan separadamente ya que, aunque en algunos casos ellas comparten mecanismos fisiopatológicos 14, son entidades con presentación clínica diferente y requieren un enfoque diagnóstico y terapéutico especifico.
Prevalencia de INOCA y MINOCA
La mitad o más de los pacientes sometidos a cinecoronariografía (CCG) indicada por signos o síntomas sugestivos de isquemia miocárdica estable, no presentan lesiones angiográficamente significativas 15-18. Dependiendo de la población investigada, hasta un 60% podría tener DMC 1, 19.
La prevalencia de INOCA varía de acuerdo a la fuente consultada. Un registro que incluyó 397954 pacientes
sometidos a angiografía por sospecha de enfermedad coronaria obstructiva en 663 hospitales mostró que, aunque el 69% tenía una prueba funcional con isquemia, el 37.6% no presentaba lesiones mayores al 50% 20. Esta población es representativa de pacientes con INOCA, tenía una edad media de 58 años (50-68), 56% con antecedentes de dislipidemia, 65% eran hipertensos, 20% tabaquistas y 22% diabéticos. El 50% de los pacientes con prueba funcional con isquemia y el 40% sin evidencia de isquemia referían angina.
El American College of Cardiology-National Cardiovascular Data Registry muestra que 51% de las mujeres y 32% de los hombres sometidos a angiografía coronaria por consideraciones clínicas, no tiene lesiones coronarias obstructivas 21.
Entre 4.4% y 14% de los pacientes que presentan un SCA y marcadores de daño miocárdico, no tienen lesiones angiográficas coronarias > 50% 1. En los estudios que incluyeron pacientes con supradesnivel del segmento ST la prevalencia de MINOCA varió entre 2.6 y12.6% 22.
En el estudio CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines) el 9% de los pacientes con SCA sin supra desnivel del segmento ST presentaban una angiografía sin lesiones significativas 23. Un meta-análisis posterior que incluyó 176 mil pacientes consecutivos de 27 ensayos clínicos, que presentaban un infarto de miocardio sometidos a angiografía, describe una prevalencia de MINOCA de 1 a 14%, con un promedio de 6% 24.
La prevalencia varía de acuerdo al punto de corte del porcentaje de estenosis coronaria. Es entre 1 y 4% cuando la definición se restringe a coronarias completamente normales (0% de estenosis) pero llega a 5-14% cuando se considera un umbral de estenosis de < 50% 25, 26.
INOCA
Presentación clínica
La presentación clínica clásica es el dolor anginoso de esfuerzo – típico de isquemia miocárdica- aunque en estos pacientes puede ser “atípico” en muchos casos o presentarse como equivalentes anginosos, particularmente disnea. El dolor puede presentarse como una sensación retroesternal de opresión, inducido por el ejercicio, aparecer o persistir luego del ejercicio o aun aparecer en reposo 3, 27. En un porcentaje variable de pacientes con angina microvascular, el tratamiento con nitroglicerina no alivia rápidamente o de manera suficiente el dolor anginoso 28.
Predisponentes: factores de riesgo cardiovascular
La correlación entre la DMC (disfunción microvascular coronaria) y los factores de riesgo tradicionales no parece tan clara como en la enfermedad ateroscleótica 29.
Aunque existen alteraciones de la reserva coronaria (RC) asociadas con el tabaquismo 30, hipertensión arterial 31, diabetes 32 y niveles elevados de LDL colesterol 33, menos del 20% de la variabilidad de la respuesta microvascular a la adenosina pudo ser explicada por factores de riesgo tradicionales, sugiriendo el papel de factores aún no completamente identificados 29.
Los niveles de proteína C reactiva (PCR) se relacionaron con el grado de DMC 34, e incluso hubo correlación entre PCR elevada y detección de episodios de isquemia en electrocardiogramas continuos 35. Se observaron también niveles elevados de otros marcadores de inflamación como CD 40l, IL6, o la endotelina-17, en pacientes con DMC en comparación con controles sanos 36. Esto indicaría una asociación entre inflamación sistémica y DMC.
Déficit estrogénico – La predominancia femenina en las series de pacientes con angina microvascular (alrededor del 70% son mujeres postmenopáusicas) sugiere que la deficiencia de estrógenos podría tener un papel causal.
La administración de 17b-estradiol mejora la función endotelial en mujeres postmenopáusicas, lo que sugiere que la disfunción endotelial es uno de los mecanismos de la DMC en este grupo 37.
Pronóstico en pacientes con INOCA
El pronóstico de los pacientes con INOCA es peor en mujeres que en hombres. El riesgo es intermedio respecto a las pacientes con enfermedad coronaria aterosclerótica y a las personas sin enfermedad coronaria obstructiva.
A 10 años, las mujeres con INOCA tienen un 12.8% de mortalidad cardiovascular o infarto de miocardio 38.
Respecto a los hombres también tienen 4 veces mayor tasa de reinternaciones por angina o SCA a 180
días 39. Se observan recurrentes visitas a emergencias, y repetidos estudios diagnósticos, incluyendo cinecoronariografias 40, que incrementan significativamente los costos en salud.
La edad, hipertensión, diabetes y tabaquismo se asocian a mayor mortalidad. El género, la dislipidemia,
los antecedentes coronarios en la familia y el pre-test con valores elevados para coronariopatía no parecen relacionados con mortalidad en INOCA 41.
La coexistencia de enfermedad coronaria no-obstructiva confiere mayor riesgo de mortalidad 41.
Disfunción microvascular coronaria
El mecanismo responsable por la aparición de angina e isquemia en INOCA es generalmente secundario a alteraciones funcionales y/o estructurales de la microcirculación coronaria, denominado disfunción microvascular coronaria (DMC).
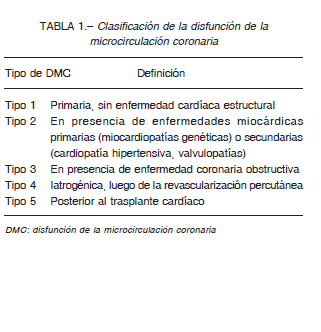
La DMC puede clasificarse de acuerdo al contexto clínico en el que ocurre (Tabla 1). Es la responsable del cuadro clínico en pacientes con angina microvascular “primaria” (aquella que ocurre sin enfermedades cardíacas ni sistémicas asociadas) 11, 42. DMC puede expresarse como alteración de la vasodilatación coronaria o espasmo microvascular, o una combinación de ambas 2.
Anatomía y fisiología microvascular coronaria (Fig. 1)
Para comprender los mecanismos responsables de la angina microvascular es fundamental conocer detalladamente las características anatómicas y funcionales de los distintos componentes de la circulación coronaria.
El sistema arterial coronario está conformado por arterias epicárdicas, pre-arteriolas y arteriolas. Las arterias epicárdicas son, esencialmente, vasos de conducción y en condiciones fisiológicas son responsables de menos del 10% de la resistencia total al flujo de sangre coronaria.
Las arterias se dividen en ramas más pequeñas y éstas dan origen a las pre-arteriolas, que son vasos de 200 a 500 μm de diámetro localizados en la superficie epicárdica. Estos vasos mantienen la presión al ingreso de la sangre a las arteriolas, son capaces de responder a la tensión de cizallamiento (shear stress) y a la presión intravascular para mantener la presión de perfusión dentro de límites apropiados. Son responsables de aproximadamente el 25% de la resistencia coronaria total 43. Las arteriolas son vasos intramiocárdicos de menos de 200 μm de diámetro y son las responsables de aproximadamente el 55% de la resistencia coronaria total, por lo que constituyen el principal componente en la resistencia al flujo sanguíneo en condiciones normales.
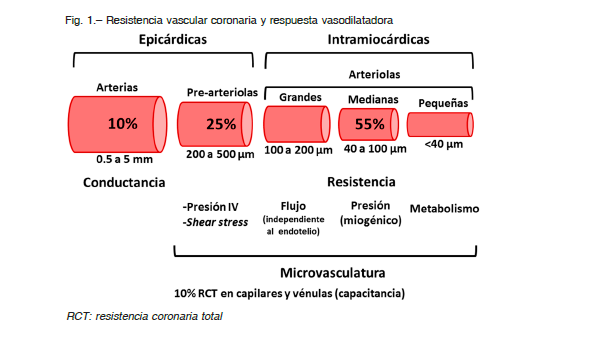
Las arteriolas, a su vez, se pueden subdividir de acuerdo a su diámetro en: grandes (100-200 μm), intermedias (40-100 μm) y pequeñas (< 40 μm). En las primeras predomina la vaso-reactividad dependiente del endotelio, presentan vasodilatación ante aumentos del flujo sanguíneo y vasoconstricción cuando se reduce el flujo 7, 11.
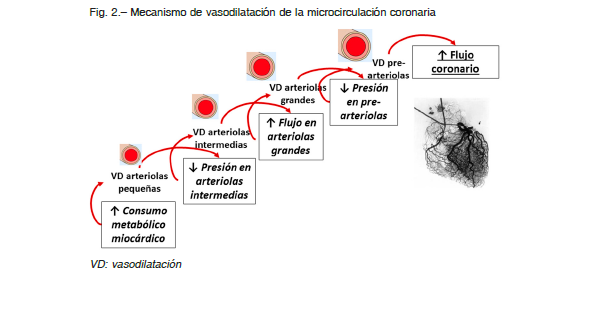
Las arteriolas de tamaño intermedio responden a cambios de la presión intraluminal, que son detectados por receptores de estiramiento localizados en las células musculares lisas vasculares (control miogénico). Se contraen ante aumentos de la presión y se relajan con las disminuciones de la presión. Por su parte, las arteriolas pequeñas responden a la actividad metabólica del miocardio que las rodea, desarrollando vasodilatación con el aumento de la actividad metabólica 7, 11.
De esta manera, un incremento de la demanda metabólica miocárdica provoca dilatación de las arteriolas pequeñas, la consecuente caída de la presión en las arteriolas de tamaño intermedio causa su dilatación, lo que a su vez aumenta el flujo (y determina vasodilatación dependiente del endotelio) en las arteriolas de mayor tamaño (Fig. 2).
Además de los estímulos metabólicos y hemodinámicos, las señales conducidas a lo largo de la pared vascular mediante uniones gap (conexinas) contribuyen a mantener una adecuada perfusión en la red microvascular 45, 46.
Finalmente, los capilares y vénulas son responsables de aproximadamente el 10% de la resistencia coronaria total y son vasos de capacitancia. Las pre-arteriolas, arteriolas, capilares y vénulas integran la microcirculación coronaria.
La DMC puede ocurrir cuando existen alteraciones a cada uno de los niveles de la microcirculación coronaria.
Por ejemplo, disfunción endotelial, disfunción de músculo liso vascular, espasmo microvascular y remodelado microvascular.
Además, hay factores intramiocárdicos que pueden afectar la función de la microcirculación 2.
La disfunción endotelial, es provocada por disminución de la biodisponibilidad de óxido nítrico (ON) y aumento de los niveles de endotelina1. Se manifiesta por una menor respuesta vasodilatadora o aun vasoconstrictora ante estímulos que, en condiciones normales, provocarían vasodilatación dependiente del endotelio. Se puede evaluar mediante la medición de la respuesta del flujo coronario a la administración intracoronaria de acetilcolina (ACh).
En condiciones normales, la ACh produce vasodilatación microvascular y aumento del flujo coronario. En pacientes con angina microvascular se observa una reducción del flujo sanguíneo coronario en ausencia de cambios en el diámetro de las arterias coronarias epicárdicas 3, 5.
La disfunción del músculo liso vascular se manifiesta como alteraciones en la relajación del músculo liso y se detecta por una reducción en la respuesta del flujo coronario a vasodilatadores independientes del endotelio (adenosina, papaverina, dipiridamol) 5, 47, 48. Recientemente se demostró que ocurre una respuesta exagerada al neuropéptido Y (un potente vasoconstrictor endógeno) en pacientes con angina microvascular, pero no en controles ni en pacientes con enfermedad coronaria epicárdica 49.
El espasmo microvascular podría estar relacionado con una respuesta excesiva a la estimulación a-adrenérgica, fundamentalmente a través de receptores a2. El BHT 933 (agonista a2-selectivo) provoca constricción microvascular, sin cambios en las arterias epicárdicas. El neuropéptido Y es co-secretado con la noradrenalina en las terminales nerviosas simpáticas y podría participar en la DMC por este mecanismo 5, 50.
Además de las alteraciones funcionales, algunos estudios describieron cambios estructurales de la microcirculación, entre los cuales se encuentran la esclerosis de arteriolas, con fibrosis perivascular, edema nuclear en el endotelio capilar y proliferación de células musculares lisas en pequeñas arterias y arteriolas 51.
En pacientes con angina microvascular, podrían ocurrir combinaciones variables de los mecanismos mencionados como responsables de la DMC y es posible que intervengan de manera diferente en distintos
pacientes, o aun en distintos momentos en un mismo paciente 5, 11.
Mecanismos de isquemia miocárdica en INOCA
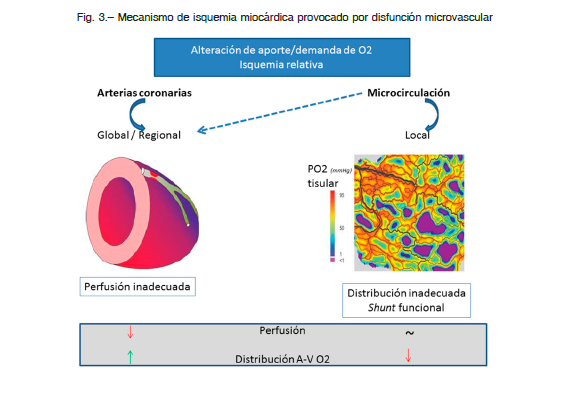
La DMC puede estar asociada o no a enfermedad aterosclerótica, a enfermedad miocárdica o puede ser iatrogénica. La DMC provoca una reducción en la reserva coronaria, generando alteraciones locales en la relación entre la oferta y la demanda miocárdica de oxígeno y nutrientes. La correlación del dolor anginoso con cambios isquémicos en el ECG en pruebas evocadoras de isquemia, sugiere que las alteraciones microvasculares provocan síntomas como consecuencia de la inducción de isquemia miocárdica. La evidencia metabólica de isquemia, incluyendo la liberación de lactato y productos de la peroxidación lipídica en el seno coronario, la reducción en el contenido de O2 de sangre extraída en el seno coronario y cambios en el metabolismo miocárdico de fosfatos de alta energía en la espectroscopía por resonancia magnética, se detecta solamente en un 20 a 30% de los pacientes9. La distribución parcheada de la DMC en una red microvascular con flujo sanguíneo de distribución espacial y temporalmente heterogénea, en la cual pueden coexistir pequeñas áreas isquémicas con otras con hiperflujo, podría explicar la dificultad de estos métodos para detectar isquemia en los pacientes con angina microvascular 6, 27.
Por su parte, los métodos convencionales podrían no detectar trastornos de la contractilidad debido a la distribución parcheada de pequeñas áreas de isquemia rodeadas por miocardio no isquémicos y con contractilidad normal (Fig. 3).
Nocicepción cardíaca anormal
Los pacientes con angina microvascular pueden presentar una percepción anormal de estímulos dolorosos cardíacos. Se ha descrito la inducción de dolor precordial durante la coronariografía o el cateterismo derecho en pacientes con angina microvascular, pero no en pacientes valvulares (con y sin enfermedad coronaria), ni en receptores de trasplante cardíaco. El dolor no se relacionó con caída de la reserva coronaria con papaverina, sugiriendo un mecanismo independiente del hemodinámico 2.
Por otro lado, la tomografía por emisión de positrones cerebral detectó aumento de la actividad neuronal en la unión de la ínsula anterior derecha con el opérculo frontal durante el ecocardiograma estrés con dobutamina en pacientes con angina microvascular pero no en controles 53.
Estos resultados sugieren que la nocicepción cardíaca anormal podría ser la consecuencia de una alteración en el manejo central de señales aferentes 43.
Diagnóstico
El diagnostico de angina microvascular requiere la presencia de los siguientes criterios 54 :
Angina
Isquemia
Ausencia de estenosis coronarias mayores a 50% o hemodinámicamente significativas (FFR > 0.80)
Reducción de la reserva coronaria/presencia de espasmo microvascular
Medición de reserva de flujo coronario
La medición de la reserva de flujo coronario (RFC) puede realizarse mediante diferentes métodos utilizando adenosina o análogos para obtener parámetros de flujo coronario en reposo y en hiperemia.
Por ecocardiograma se miden las velocidades en la arteria descendente anterior (ADA) y se calcula un cociente entre las velocidades basales y en el pico de una dosis de 0.84 mg/kg/min de dipiridamol administrado en 4 minutos. El punto de corte para predecir pronóstico se estableció en 2.32. Aquellos pacientes con INOCA y RFC < 2.32 tuvieron una tasa de eventos 3 veces mayor que los casos con RFC ≥ 2.32 (MACE a 5 años: 27 vs. 9%, p = 0.01) 2.
La tomografía por emisión de positrones (PET) permite evaluar, además de la perfusión miocárdica relativa y la función ventricular, el flujo sanguíneo miocárdico en términos absolutos (en ml/min/gramo de tejido) 55. Estas mediciones de flujo se realizan tanto en reposo como en estrés (habitualmente farmacológico) en forma global, por territorio vascular (descendente anterior, circunfleja y coronaria derecha, respectivamente) y por segmento del ventrículo izquierdo. Del cociente entre el flujo coronario pico y el flujo en reposo se obtiene la reserva coronaria 56.
La reserva coronaria es un parámetro que conjuga los efectos de la enfermedad coronaria epicárdica, de la
enfermedad ateroesclerótica difusa y de la DMC sobre la perfusión del tejido miocárdico 56. Cuando se toman en cuenta parámetros como el flujo miocárdico absoluto y la reserva de flujo mediante PET, se obtiene información confiable in vivo sobre el estado funcional del miocardio y del árbol vascular 57.
Una reserva coronaria normal (> 2.5) excluye la enfermedad epicárdica de alto riesgo. Una reserva coronaria disminuida no predice la gravedad de la anatomía, ya que las reducciones en la reserva coronaria están relacionadas con el incremento en las resistencias en los vasos epicárdicos y en la microcirculación 58 (Fig. 4).
Sin embargo, estudios recientes han demostrado que la medición absoluta del flujo coronario, en mililitros por minuto por gramo de miocardio, es predictor de MACE (muerte cardíaca, infarto de miocardio, revascularización u hospitalización por insuficiencia cardíaca) a tres años (con punto de corte de RFC de 2). La reserva coronaria por PET se considera normal cuando es mayor a 2.5, borderline (zona gris) entre 2 a 2.5 y disminuida cuando es menor a 2. De todas maneras, la reserva coronaria parece asociada a un patrón de “riesgo de tipo continuo” 59.
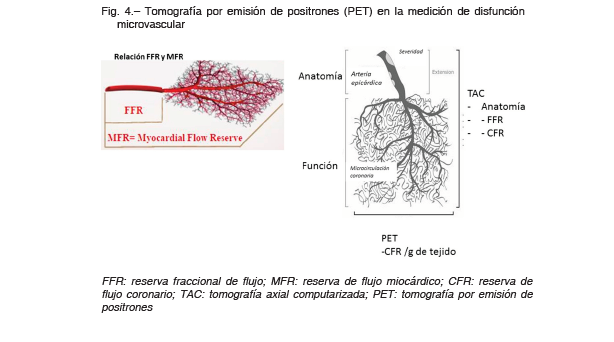
Se requieren estudios prospectivos y aleatorizados para definir el significado clínico de la evaluación de rutina de la reserva coronaria en los pacientes con sospecha de INOCA.
A diferencia del PET, la resonancia nuclear magnética (RNM) cardíaca permite mediciones semicuantitativas del índice de reserva de perfusión coronaria en pacientes con DMC 60.
Otros métodos de imágenes que frecuentemente contribuyen al diagnóstico de cardiopatía isquémica tienen
una utilidad menor en esta enfermedad.
Ecocardiograma: estrés, hiperventilación/frío y strain rate
El ecocardiograma estrés con ejercicio o apremio farmacológico presenta limitaciones en la determinación de isquemia en esta enfermedad.
Las técnicas de hiperventilación y frío son poco utilizadas y tienen sensibilidad y especificidad muy variables (58-90%), debido a la escasa reproducibilidad y protocolización del apremio. El objetivo es provocar vasoespasmo coronario a través de la disminución de la PCO2 e incremento del pH sérico, con la variación de la concentración de calcio intracelular e incremento del reflejo miogénico vascular. El protocolo incluye hiperventilación durante 6 minutos, con 30 respiraciones por minuto y posteriormente frío en las manos durante 2 minutos. Se evalúa la aparición de angina, cambios del ST en el electrocardiograma y disinergias regionales de novo como manifestación de espasmo coronario 61.
El strain rate permite analizar la deformación ventricular y adjudicarle un valor numérico. Las fibras miocárdicas cambian en forma constante su tamaño y su forma. Durante una contracción cardiaca normal el miocito cambia su tamaño simultáneamente en varias direcciones: longitudinal (base-ápex), circunferencial y radial. Además, se “tuercen” y rotan. Cada una de estas deformaciones puede estudiarse por separado, de manera que se puede medir strain y strain rate de los ventrículos y aun de las aurículas. Es de utilidad en las enfermedades miocárdicas segmentarias, como por ejemplo en la enfermedad coronaria.
En condiciones normales el valor de la strain sistólica longitudinal global (promedio de 17 segmentos vistos desde proyecciones apicales) debe ser más negativo que -18% y en la mayoría de la población adulta está entre -18 y -25%. El valor promedio de la strain radial es de 44.5%, en tanto que para la strain rate longitudinal y radial los valores promedio son 1 y 2.5 seg-1, respectivamente.
Este método podría detectar pequeños montos de parches de isquemia miocárdica en los pacientes con angina microvascular 62.
Tomografía computarizada por emisión de fotón único convencional
La presencia de isquemia parcheada y distribuida de manera heterogénea –espacial y temporalmente– en
pequeñas áreas del miocardio podría explicar la dificultad de los métodos complementarios convencionales para detectar isquemia en los pacientes con INOCA 63. La tomografía computarizada por emisión de fotón único (SPECT) en reposo y estrés puede no presentar alteraciones de la distribución del radiotrazador y la función ventricular izquierda por técnica gatillada puede estar preservada, a pesar de que el paciente presente DMC 58.
Los métodos invasivos son los más específicos. Permiten medir directamente el flujo coronario y la respuesta vasodilatadora mediada por el endotelio (con acetilcolina) e independiente del endotelio (con adenosina o nitroprusiato de sodio) 63.
El test de acetilcolina consiste en la inyección intracoronaria de este fármaco luego de descartar lesiones angiográficas significativas. Puede provocar espasmo de arterias epicárdicas asociadas a síntomas y cambios del ECG64. El espasmo microvascular se diagnostica cuando la angina y los cambios del segmento ST no correlacionan con constricción del vaso epicárdico 64.
Tratamiento
Podríamos dividir las indicaciones de tratamiento en:
1. Medidas generales para mejorar función endotelial y vasodilatación coronaria
Ejercicio físico – Estatinas – Estrógenos – Tratamiento de factores de riesgo: hipertensión, diabetes, síndrome metabólico, obesidad.
2. Tratamiento de la isquemia dependiendo del mecanismo fisiopatológico prevalente.
Los fármacos a considerar son los siguientes: – Nitratos sublinguales – Bloqueantes cálcicos – Beta bloqueantes- Alfa bloqueantes – Nitratos – Ranolazine – Trimetazidina – Cilostazol – Fasudil
3. Tratamiento de la nocicepción alterada – Antidepresivos tricíclicos – TENS – SCS
4. Tratamiento de la enfermedad de base que puede ser responsable de los síntomas
Una revisión sistemática demuestra el beneficio de la rehabilitación cardiovascular en pacientes con INOCA 65.
El ejercicio físico mejora los síntomas, la isquemia en los estudios de perfusión, la capacidad de ejercicio y la calidad de vida.
Las estatinas parecen mejorar la reserva de flujo coronario a corto 66 y mediano plazo 67 y los IECA demostraron no solamente mejoría sintomática sino también reducción de la fibrosis peri-arteriolar 68. La adición de inhibidores del receptor de aldosterona se asoció a mejoría de la DMC en pacientes diabéticos 69.
El tratamiento con 17 b-estradiol en mujeres postmenopáusicas con déficit estrogénico de mejora la función endotelial 70 en algunas series. Existen pocos datos sobre los efectos de los nitratos sobre la función endotelial y microvascular. Sin embargo, son utilizados para intentar aliviar los síntomas anginosos por su efecto venodilatador y vasodilatador coronario. Existen descripciones de empeoramiento de la disfunción endotelial y estrés oxidativo con tratamientos prolongados 71.
Los bloqueantes cálcicos ejercerían su efecto a través de la vasodilatación de arterias epicárdicas y mejoraron la tolerancia al ejercicio 72, a pesar de no mostrar disminución de la DMC.
La trimetazidina, un fármaco modificador del metabolismo miocárdico, mostró resultados favorables en un estudio de pequeñas dimensiones de pacientes con angina microvascular 73.
Los antidepresivos tricíclicos en bajas dosis tienen un efecto anticolinérgico y modulador de la captación de norepinefrina, que podría causar analgesia en pacientes que tienen nocicepción alterada 74. Sin embargo, los efectos adversos se asociaron a falta de mejoría en la calidad de vida.
Existen otros tratamientos farmacológicos y no farmacológicos con resultados disímiles. Algunos de ellos
como la ranolazina, el nicorandil y el fasudil no están disponibles en Argentina.
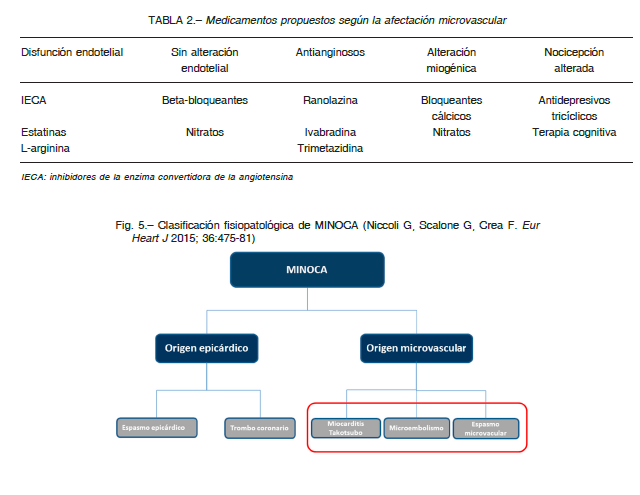
Una revisión sistemática de 35 estudios aleatorizados en pacientes predominantemente de sexo femenino, demuestra que la evidencia disponible sobre el tratamiento de INOCA es de moderada a baja calidad. La ranolazina y los IECA parecen mejorar la calidad de vida. Los IECA, β bloqueantes, calcio-antagonistas, nicorandil, ranolazina, y estatinas disminuyen la angina y retrasan la aparición de isquemia en los test de esfuerzo. El riesgo de eventos trombo-embólicos determina que los tratamientos hormonales se desaconsejen en mujeres postmenopáusicas (Tabla 2) 74.
MINOCA
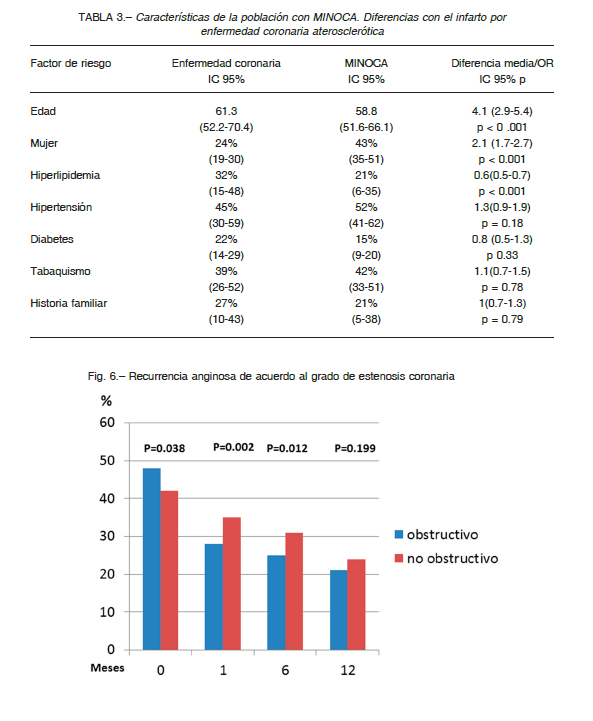
Esta denominación incluye un mosaico de afecciones que se presentan como un síndrome coronario agudo (SCA) en ausencia de estenosis coronarias.
Dentro de las posibles causas de un cuadro clínico con características similares se encuentran: la miocarditis, el vasoespasmo coronario (micro o macro), eventos de placa (con trombolisis espontánea o embolia distal), disección coronaria, y el síndrome de takotsubo, el cual requiere una mención especial.
El síndrome de discinesia apical transitoria o síndrome de takotsubo, que representa alrededor del 1-2% de los síndromes coronarios agudos, es más frecuente en mujeres que en hombres 24. Existen cuatro hipótesis fisiopatológicas principales: estenosis coronaria transitoria, alteraciones de la microcirculación, toxicidad por catecolaminas y contusión miocárdica neurogénica 25.
Aunque actualmente se lo incluye dentro de las “cardiopatías de estrés” que comprende también a las
derivadas de enfermedad intracraneal, feocromocitoma, neuroblastoma, administración exógena de catecolaminas, beta-agonistas, cocaína, anfetaminas, sepsis y secundaria a procedimientos quirúrgicos 25, 39, algunos autores consideran que el síndrome de takotsubo es un SCA causado fundamentalmente por DMC y/o liberación masiva de catecolaminas.
Frente a un infarto con coronarias angiográficamente sin lesiones significativas, también debe considerarse una larga lista de causas probables, aunque infrecuentes: embolia coronaria, miocardiopatías (hipertrófica, dilatada), amiloidosis, trombofilias, factor V Leiden76, deficiencia de proteína C 77 y trombofilia asociada a malignidad 78.
Todas estas afecciones deben tenerse presentes como diagnósticos diferenciales para optimizar las estrategias de búsqueda de la causa que provoca el cuadro.
Los síndromes que conforman MINOCA podrían dividirse de la siguiente manera siguiendo una clasificación
fisiopatológica:
– Vasculares epicárdicos
– Microvasculares
(Fig. 5)
Características de los pacientes con MINOCA
La edad promedio de la población con MINOCA es menor a la descripta para la enfermedad aterosclerótica y con una proporción mayor de mujeres (alrededor de 40%) que la que se observa en el SCA aterotrombóticos,
pero con un perfil de riesgo cardiovascular similar 3,79 (Tabla 3).
Pronóstico
Los pacientes con MINOCA tienen similar tasa global de recurrencia anginosa que los pacientes con enfermedad aterotrombótica durante el primer año posterior al evento (Fig. 6) 8.
La mortalidad total al año es de 4.7 %, menor al 6.7% de la enfermedad aterotrombótica 9. Cuando se excluyen los pacientes con takotsubo y miocarditis y se estudian pacientes más jóvenes, la mortalidad es menor, pero similar a los de pacientes con enfermedad coronaria, > 50%, y por encima de la esperada para población sana 80.
Diagnóstico
El diagnóstico se basa en una serie de evaluaciones que frecuentemente se inician en la sala de emergencias o en la sala de hemodinamia:
Historia clínica
La anamnesis puede orientar el diagnóstico hacia causas específicas. Debe interrogarse la historia de fibrilación auricular, miocardiopatias previas, presencia de válvulas protésicas, factores protrombóticos, historia de trombosis venosa o embolia pulmonar como posibles causas de cardioembolias.
La presencia de fiebre o un cuadro viral reciente podrían alertar sobre la posibilidad de una miocarditis.
Electrocardiograma
En el electrocardiograma (ECG) se deben buscar, además de los signos de isquemia miocárdica, signos orientativos de otras enfermedades, como cambios difusos del ST que no respetan territorios (orientativo de miopericarditis) y arritmias con potencial embolígeno (fibrilación/aleteo auricular).
Análisis de laboratorio
Además de la troponina y la rutina habitual, para un diagnóstico más específico son útiles: el dosaje de péptido natriurético auricular (BNP), dímero D, marcadores de inflamación, factores protrombóticos, proteína V Leiden, proteína C, proteína S, factor lúpico, anticuerpos anticardiolipina y hemocultivos en caso de fiebre.
Los métodos de diagnóstico con imágenes permiten orientar sobre el diagnóstico.
Existen alteraciones patognomónicas que orientan al diagnóstico. El síndrome de Takotsubo se presenta con
disfunción sistólica del ventrículo izquierdo y disinergias regionales de los segmentos apicales o medio ventriculares, con baloneamiento e hiperquinesia basal, detectables por ecocardiograma o ventriculograma en la sala de hemodinamia. Puede presentar un trombo en la región apical que obliga a la administración de anticoagulación en forma inmediata.
El ecocardiograma también es útil para detectar trombos intraventriculares, masas cardiacas (mixoma, fibroelastoma papilar, etc.), vegetaciones, alteraciones valvulares, placas en aorta ascendente y shunts derechaizquierda que pueden causar embolias coronarias.
Métodos diagnósticos invasivos específicos
En la sala de hemodinamia, cuando se constata ACAnoS durante la angiografía y se plantea el diagnóstico de MINOCA, se requiere la realización de test específicos, que deben consensuarse con el cardiólogo intervencionista, incluso en el momento de la coronariografía diagnóstica.
Idealmente se recomiendan:
1. Ventriculograma: De utilidad para definir patrones de alteración de motilidad parietal.
2. Eco intra-coronario (IVUS) especialmente cuando existen lesiones consideradas no significativas en el
angiograma.
3. Tomografía intra-coronaria (OCT) para diagnosticar ruptura, erosión de placas, o disección coronaria.
4. Test de acetilcolina para detección de vasoespasmo.
Este estudio podrá diferirse si el paciente está inestable o presenta compromiso isquémico extenso, arritmias o falla de bomba.
La seguridad de realizar un test de inducción de vasoespasmo en el contexto de un infarto reciente, fue
evaluada recientemente por Montone et al. en un estudio prospectivo de 80 pacientes con MINOCA. En pacientes con MINOCA se realizó el test de acetilcolina (20-200 μg en descendente anterior y 20-50 μg en coronaria derecha) dentro de las 48 horas del infarto, inmediatamente después de constatar por angiografía que no existían lesiones coronarias > 50% o FFR ≤ 0.80. El 46.2% de los pacientes estudiados tuvo un resultado positivo del test, y solamente 2 pacientes tuvieron bradiarritmia, sin ningún caso de taquicardia ventricular. Este estudio, aunque de pequeñas dimensiones, demostró la seguridad del test y arrojó algunos resultados relevantes que deberán reproducirse en estudios de mayores dimensiones 81.
Por un lado, los pacientes con test positivo tuvieron en su mayoría (64.9%) espasmo epicárdico y solamente el 35.1% presentó espasmo microvascular. Por otro lado, se observó que los pacientes con test positivo tuvieron mayor recurrencia de angina y mayor mortalidad a 36 meses 82.
En la sala de cuidados intensivos: el ingreso del paciente con diagnóstico de MINOCA a la sala de cuidados intensivos, representa una oportunidad para revisar los métodos ya realizados y establecer un algoritmo de estudio.
La re-evaluación de la angiografía coronaria permite detectar lesiones o imágenes sugestivas de embolia o disección que pudieron pasar desapercibidos en el examen inicial, especialmente si no se realizó IVUS (ultrasonido intravascular) ni OCT (tomografía de coherencia óptica).
Hasta 25% de pacientes con diagnóstico de MINOCA presentan disrupción de placa cuando se realiza IVUS 83.
La revisión de la motilidad parietal del ventriculograma y/o el ecocardiograma permitirán diferenciar patrones de alteración de la motilidad: – epicárdicos (sigue a un territorio coronario), presentes en un infarto de miocardio por ruptura o erosión de placa, vasoespasmo, embolia o disección coronaria, – difusos (no siguen la distribución del árbol coronario), que obligan a la realización de otros estudios de imágenes, – o el patrón típico del síndrome de takotsubo.
Evaluaciones complementarias
Las evaluaciones complementarias pueden realizarse durante la misma internación (cuando estén disponibles) o luego del alta, cuando el paciente se encuentre estable.
Resonancia magnética cardíaca
En pacientes con MINOCA la resonancia magnética cardíaca (RMC) permite la aproximación diagnóstica en el 70% de los casos. Este método en ocasiones modifica el diagnóstico inicial y cambia la conducta terapéutica 84 (Fig. 7). La RMC normal se asocia a un buen pronóstico alejado 8,85. Permite evaluar alteraciones de la motilidad en la secuencia cines, la presencia de edema miocárdico en las secuencias ponderadas en T2 y la presencia de inflamación y fibrosis a nivel miocárdico mediante la secuencia de tardío (RT).
A la secuencia ponderada en T2 es conveniente efectuarla de forma temprana, dentro de 2 semanas del inicio de los síntomas a fin de aumentar la performance diagnóstica, antes que la injuria miocárdica resuelva o revierta.
Esto resulta fundamental en el caso de la miocarditis y el síndrome de takotsubo 74. La presencia de realce tardío y sus distintos patrones de distribución a nivel miocárdico brindan la mejor certeza diagnóstica de la RMC 86,87.
El infarto agudo de miocardio (Fig. 8 a) representa un cuarto de los diagnósticos de MINOCA 85. Es reconocido por alteraciones de la motilidad (hipocinesia, acinesia o discinesia), edema y realce tardío subendocárdico o transmural en segmentos relacionados con un territorio coronario 87. Si se observa este patrón en la RMC se debe revisar la angiografía coronaria en búsqueda de lesiones significativas o vasos amputados no reconocidos en la lectura inicial. Si existe la sospecha de una lesión de causa embólica se profundizará la detección de fuentes embolígenas como el foramen oval permeable, el fibroelastoma papilar y el mixoma 88.
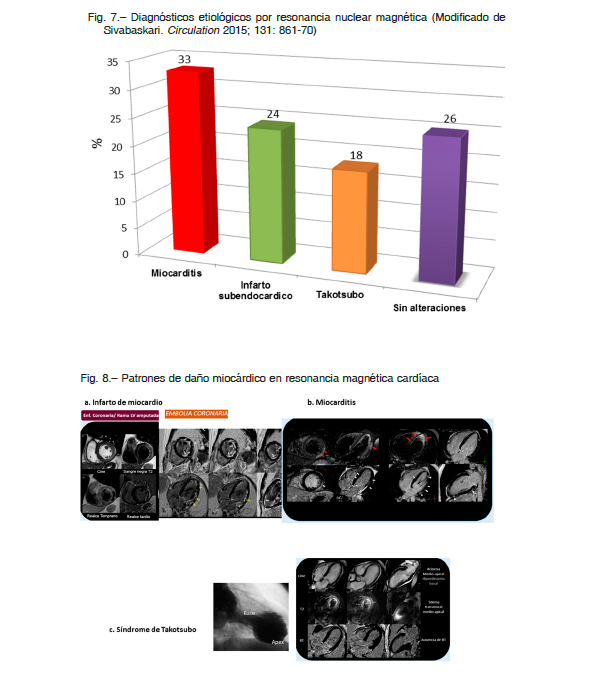
La miocarditis (Fig. 8b) representa un 27-33% de los casos de infarto con coronarias sin lesiones angiográficas significativas 85,89. La RMN cardíaca tiene una sensibilidad y una especificidad del 100% y 90% respectivamente 90.
Algunos pacientes pueden presentar alteraciones regionales o globales de la motilidad parietal. El edema puede ser localizado o difuso en las secuencias ponderadas en T2. El edema difuso puede no detectarse visualmente, por lo que se recomienda realizar el análisis cuantitativo de la intensidad de señal del musculo cardíaco y el esquelético, considerando patológico un valor mayor a 1.9 de la razón entre ambos 90. Esta secuencia es conveniente realizarla dentro de las 2 semanas del evento, a fin de aumentar el rédito diagnóstico, ya que el edema desaparece con la resolución del cuadro 85.
El realce tardío miocárdico se manifiesta con dos patrones comunes de presentación en la miocarditis: – intramiocárdico a predominio septal y – epicárdico/intramiocárdico, generalmente parcheado a nivel de la pared lateral del ventrículo izquierdo. Por regla general, el subendocardio no se halla comprometido en la miocarditis, a diferencia de la fibrosis característica del infarto de miocardio 90.
El síndrome de takotsubo (Fig. 8 c) representa el 9-11% del MINOCA y en algunas series es aún más alto 86,91.
En las secuencias cine es característica la hipocinesia o acinesia de los segmentos medios y apicales, asociada a hiperdinamia de los segmentos basales. En las secuencias ponderadas en T2 se evidencia edema miocárdico transmural, circunferencial a nivel medio y apical que no respeta un territorio coronario, coincidente con los segmentos disfuncionantes. Otra característica distintiva del takotsubo es la ausencia de defectos de perfusión en reposo y realce tardío 92.
Por último, ocasionalmente las miocardiopatías se manifiestan como MINOCA. Entre ellas se encuentran la
miocardiopatía dilatada y la miocardiopatía hipertrófica 85.
La RMN cardíaca colabora en el diagnóstico diferencial en estas entidades principalmente a través de la evaluación morfológica y la presencia de realce tardío.
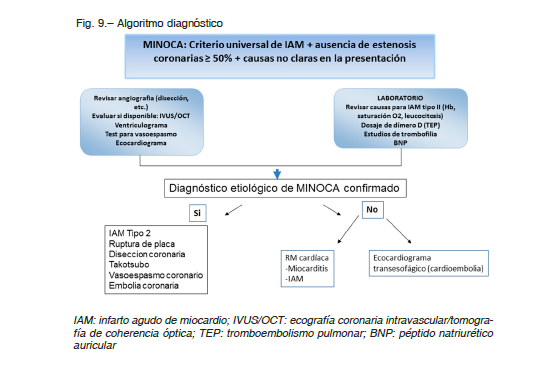
Algoritmo diagnóstico
La diversidad de afecciones que conforman el MINOCA obliga a una evaluación sistemática y ordenada. Es
aconsejable seguir un algoritmo que permita incluir una cascada de estudios para llegar al diagnóstico correcto.
Este algoritmo se inicia cuando se detecta elevación de troponina en un paciente con angor y ACAnoS. Se
sugiere realizar los siguientes estudios (Fig. 9).
Tratamiento del MINOCA
Tratamiento inicial en Unidad Coronaria (Fig. 10)
El tratamiento del MINOCA se inicia al ingreso y se relaciona con el diagnóstico final. Se recomienda el siguiente esquema:
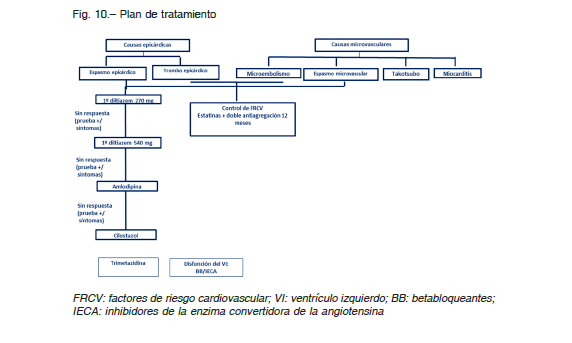
Antiplaquetarios
Los pacientes con angor y elevación de troponina son tratados inicialmente con terapia antiplaquetaria simple o doble desde el ingreso (aspirina y clopidogrel o ticagrelor) y anticoagulados con heparina. De acuerdo a los resultados de la coronariografía, podrían considerarse dos posibilidades:
1. Si se realizó ecografía coronaria intravascular/tomografía de coherencia óptica (IVUS/OCT) y se detectaron placas accidentadas, se recomienda mantener la doble terapia antiagregante durante un año. Si no se detectaron placas: suspender.
2. Si no se realizó IVUS/OCT se evaluarán diagnósticos diferenciales. Si no puede descartarse un evento de placa se recomienda continuar con doble antiagregación durante un año.
Lindhal y col. ponen en duda el beneficio con el tratamiento con DAPT en un análisis de pacientes incluidos en el registro SWEDEHEART (The Swedish Web System for Enhancement and Development of Evidence-based Care in Heart disease Evaluated According to Recommended Therapy). No detectaron diferencias en MACE en un análisis 1:1 ajustado por propensidad entre pacientes tratados con y sin DAPT durante un año 13.
Se recomienda el uso de estatinas en estos pacientes para disminuir la progresión de aterosclerosis y estabilizar las placas, especialmente en pacientes con lesiones visibles en la CCG, y por su efecto protector del endotelio. El tratamiento puede suspenderse al alta, si se llega a un diagnostico alternativo (por ejemplo, miocarditis).
Anti-isquémicos
En los pacientes con vasoespasmo, se recomienda el tratamiento con bloqueantes cálcicos 93. Deberían evitarse los beta-bloqueantes, excepto los que tienen acción vasodilatadora asociada o son donadores de óxido nítrico.
Tratamiento al alta
Considerando el rol esencial de la aterosclerosis en la modalidad clásica de la enfermedad, y trasladando la evidencia consolidada de sus beneficios, se considera que los dos objetivos terapéuticos primordiales son el tratamiento anti aterosclerótico y anti isquémico.
– Estatinas: existen evidencias de que altas dosis de estatinas mejoran la disfunción endotelial. Se demostró reducción del volumen y estabilización de la placa. Se considera que existe un efecto de clase por lo que no puede recomendarse una estatina en especial.
– Inhibición del eje neurohormonal: se recomienda el uso de IECA / ARA II. Tanto los IECA como los ARAII
mejoran la reserva de flujo y favorecen la regresión de la fibrosis periarteriolar 94,95.
– Aspirina: no está claro su rol en esta población, por lo que se recomienda solamente en pacientes con alguna sospecha o evidencia de accidente de placa 13.
– Beta bloqueantes: se sugieren los de última generación por sus propiedades vasodilatadoras, metabólicas
(carvedilol), o por ser dadores de óxido nítrico (nevibolol)
– Bloqueantes cálcicos: cuando se sospecha vasoespasmo de la microcirculación, se sugieren como primera
elección.
-La terapia combinada entre beta-bloqueantes y dihidropiridínicos, suele ser beneficiosa por sus efectos
farmacológicos complementarios, aunque se requiere un cuidado especial para evitar trastornos de conducción.
– Ivabradine: podría ser de utilidad por su efecto sobre la FC manteniendo la vasodilatación coronaria durante el ejercicio y mejorando la circulación colateral 96.
– Nitritos: útiles en episodios de angor de reposo y prolongados. Se pueden asociar a bloqueantes cálcicos.
Sin embrago, se han descripto casos de efecto paradojal con exacerbación de síntomas 97.
– Trimetazidina: en pacientes con dolor refractario al tratamiento antiisquémico, se asocia a menor número de episodios isquémicos 98, 99.
Temas no resueltos
A pesar del creciente desarrollo de investigación en esta área, se requieren futuros estudios que permitan aclarar puntos que aún quedan pendientes. Para ello será necesario realizar registros y bases de datos con adecuado seguimiento en diferentes países, estableciendo criterios unificados de investigación.
En este campo resulta fundamental establecer algoritmos que permitan arribar a diagnósticos precisos.
Se requieren estudios complejos y costosos para alcanzar diagnósticos inequívocos por lo que debería establecerse cómo y cuándo utilizar métodos de detección invasiva de reserva de flujo y de reserva coronaria por eco Doppler o termodilución, la implementación del test de acetilcolina en la sala de hemodinamia y métodos de imágenes como RMC y PET/CT. Se propugna la elaboración de algoritmos locales ajustados a la disponibilidad y experiencia de cada centro.
El conocimiento más preciso del mecanismo fisiopatológico subyacente permitirá un uso racional y ajustado
de la terapéutica disponible y la exploración de nuevos fármacos, tanto para el tratamiento sintomático como para la evolución pronóstica.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Chen C, Wei J, AlBadri A, Zarrini P, Bairey Merz CN. Coronary microvascular dysfunction ― Epidemiology, pathogenesis, prognosis, diagnosis, Risk Fact Ther Circ J 2017; 81: 3-11.
2. Kaski JC, Crea F, Gersh BJ, Camici PG. Reappraisal of ischemic heart disease. Circulation 2018; 138: 1463-80.
3. Bairey Merz CN, Shaw LJ, Reis SE, et al. Insights from the NHLBI-sponsored Women’s Ischemia Syndrome
Evaluation (WISE) Study, part II: gender differences in presentation, diagnosis, and outcome with regard to gender-based pathophysiology of atherosclerosis and macrovascular and microvascular coronary disease. J Am Coll Cardiol 2006;47(suppl): S21-9.
4. Suwaidi JA, Hamasaki S, Higano ST, Nishimura RA, Holmes DR Jr, Lerman A. Long-term follow-up of patients with mild coronary artery disease and endothelial dysfunction. Circulation 2000; 101: 948-54.
5. Pepine CJ, Anderson RD, Sharaf BL,et al. Coronary microvascular reactivity to adenosine predicts adverse outcome in women evaluated for suspected ischemia: Results from the National Heart, Lung and Blood Institute WISE (Women’s Ischemia Syndrome) STUDY. J Am Coll Cardiol 2010; 55: 2825-32.
6. Murthy VL, Naya M, Foster CR, et al. Association between coronary vascular dysfunction and cardiac mortality in patients with and without diabetes mellitus. Circulation 2012; 126: 1858-68.
7. Hasdai D, Gibbons RJ, Holmes DR Jr, Higano ST, Lerman A. Coronary endothelial dysfunction in humans is associated with myocardial perfusion defects. Circulation 1997; 96: 3390-5.
8. Frobert O, Molgaard H, Botker HE, Bagger JP. Autonomic balance in patients with angina and a normal coronary angiogram. Eur Heart J 1995; 16: 1356-60.
9. Gaspardone A, Ferri C, Crea F, et al. Enhanced activity of sodium-lithium countertransport in patients with cardiac syndrome X. A potential link between cardiac and metabolic syndrome X. J Am Coll Cardiol 1998; 32: 2031-4.
10. Kaski JC, Elliott PM, Salomone O, et al. Concentration of circulating plasma endothelin in patients with angina and normal coronary angiograms. Br Heart J 1995; 74: 620-4.
11. Lanza GA, Luscher TF, Pasceri V,et al . Effects of atrial pacing on arterial and coronary sinus endothelin-1 levels in syndrome X. Am J Cardiol 1999; 84:1187-91.
12. Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation 2015; 131: 861-70.
13. Lindahl B, Baron T, Erlinge D, et al. Medical therapy for secondary prevention and long-term outcome in patients with myocardial infarction with nonobstructive coronary artery disease. Circulation 2017; 135: 1481-9.
14. Maseri A, Crea F, Kaski JC, Crake T. Mechanisms of angina pectoris in syndrome X. J Am Coll Cardiol 1991; 17:4 99-506.
15. Patel MR, Chen AI, Peterson ED et al. Prevalence, predictors, and outcomes of patients with non-ST-segment elevation myocardial infarction and insignificant coronary artery disease: Results from the Can Rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with Early implementation of the ACC/AHA Guidelines (CRUSADE) initiative. Am Heart J 2006; 152: 6412.
16. Bradley SM, Maddox TM, Stanislawski MA. Normal coronary rates for elective angiography in the Veterans Affairs healthcare system: Insights from the VA CART program (Veterans Affairs Clinical Assessment Reporting and Tracking). J Am Coll Cardiol 2014; 63: 417-26.
17. Douglas PS, Patel MR, Bailey SR, et al. Hospital variability in the rate of finding obstructive coronary artery disease at elective, diagnostic coronary angiography. J Am Coll Cardiol 2011; 58: 801-9.
18. Camici PG, Crea F, Coronary microvascular dysfunction, N Engl J Med 2007; 356: 830-40.
19. Valenzuela-Garcia LF, Matsuzawa Y, Sara JD, et al. Lack of correlation between the optimal glycaemic control and coronary micro vascular dysfunction in patients with diabetes mellitus: a cross sectional study. Cardiovasc Diabetol 2015; 14: 106.
20. Patel MR, Peterson ED, Dai D, et al. Low diagnostic yield of elective coronary angiography. N Engl J Med 2010; 362; 10: 886.
21. Izquierdo Coronel B, Lopez País J, Galan Gil D, et al. Myocardal infarction with non-obstructive coronary arteries (MINOCA) according to definitions of 2016 ESC position paper, perfil clinic. J American Col Cardiol 2018; 71:19.
22. Sean Gallagher, Dan A Jones, Vijay Anand, Saidi Mohiddin. Diagnosis and management of patients with acute cardiac symptoms, troponin elevation and culprit-free angiograms. Heart 2012; 98: e974-81.
23. Patel MR, Chen AY, Peterson ED, et al. Prevalence, predictors, and outcomes of patients with non-ST-segment elevation myocardial infarction and insignificant coronary artery disease: Results from the Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Eearly implementation of the ACC/AHA Guidelines (CRUSADE) initiative. Am Heart J 2006; 152: 641-7.
24. Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation 2015; 131: 861-70.
25. DeWood MA, Spores J, Notske R, et al. Prevalence of total coronary occlusion during the early hours of transmural myocardial infarction. N Engl J Med 1980; 303: 897-902.
26. DeWood MA, Stifter WF, Simpson CS, et al. Coronary arteriographic findings soon after non-q-wave myocardial infarction. N Engl J Med 1986; 315: 417-23.
27. Kaski JC. Pathophysiology and management of patients with chest pain and normal coronary arteriograms (cardiac syndrome X). Circulation 2004; 109: 568-72.
28. Kanatsuka H, Eastham CL, Marcus ML, Lamping KG. Effects of nitroglycerin on the coronary microcirculation in normal and ischemic myocardium. J Cardiovasc Pharmacol 1992; 19: 755-63.
29. Wessel TR, Arant CB, McGorray SP, et al. Coronary microvascular reactivity is only partially predicted by atherosclerosis risk factors or coronary artery disease in women evaluated for suspected ischemia: Results from the NHLBI Women’s Ischemia Syndrome Evaluation (WISE). Clin Cardiol 2007; 30: 69-74.
30. Kaufmann PA, Gnecchi-Ruscone T, di Terlizzi M, Schafers KP, Luscher TF, Camici PG. Coronary heart disease in smokers: Vitamin C restores coronary microcirculatory function. Circulation 2000; 102: 1233 – 8.
31. Rizzoni D, Palombo C, Porteri E, et al. Relationships between coronary flow vasodilator capacity and small artery remodeling in hypertensive patients. J Hypertens 2003; 21: 625-31.
32. Pitkanen OP, Nuutila P, Raitakari OT, et al. Coronary flow reserve is reduced in young men with IDDM. Diabetes 1998; 47: 248-54.
33. Tamai O, Matsuoka H, Itabe H, Wada Y, Kohno K, Imaizumi T. Single LDL apheresis improves endothelium-dependent vasodilatation in hypercholesterolemic humans. Circulation 1997; 95: 76-82.
34. Recio-Mayoral A, Mason JC, Kaski JC, Rubens MB, Harari OA, Camici PG. Chronic inflammation and coronary microvascular dysfunction in patients without risk factors for coronary artery disease. Eur Heart J 2009; 30: 1837- 43
35. Cosín-Sales J, Pizzi C, Brown S, Kaski JC. C-reactive protein, clinical presentation, and ischemic activity in patients with chest pain and normal coronary angiograms. J Am Coll Cardiol 2003; 41: 1468-74.
36. Domínguez A, González A, Avanzas P, Gómez MA, Kaski JC. Elevated circulating soluble form of CD40 ligand in patients with cardiac Syndrome X. Atherosclerosis 2010; 213: 637-41.
37. Kaski JC. Cardiac syndrome X in women: the role of oestrogen deficiency. Heart 2006; 92 Suppl 3: iii5-9.
38. Sharaf B, Wood T, Shaw L, et al. Adverse outcomes among women presenting with signs and symptoms of
ischemia and no obstructive coronary artery disease: findings from the National Heart, Lung, and Blood Institute-sponsored Women’s Ischemia Syndrome Evaluation (WISE) angiographic core laboratory. Am Heart J 2013; 166: 134-41.
39. Kothawade K, Bairey Merz CN. Microvascular coronary dysfunction in women: pathophysiology, diagnosis, and management. Curr Probl Cardiol 2011; 36: 291-318.
40. Pedersen F, Hojberg S, Prescott E. Burden of hospital admission and repeat angiography in angina pectoris patients with and without coronary artery disease: a registry-based cohort study. PLoS One 2014; 9: e93170.
41. Cademartiri F, Callister TQ, Chang HJ; CONFIRM Investigators. Age- and sex-related differences in all-cause mortality risk based on coronary computed tomography angiography findings: results from the International Multicenter CONFIRM (Coronary CT Angiography Evaluation for Clinical Outcomes: An International Multicenter Registry) of 23,854 patients without known coronary artery disease. J Am Coll Cardiol 2011; 58: 849-60.
42. Lanza GA, Crea F. Primary coronary microvascular dysfunction: clinical presentation, pathophysiology, and management. Circulation 2010; 121: 2317-25.
43. Patel B, Fisher M. Therapeutic advances in myocardial microvascular resistance: unravelling the enigma. Pharmacol Ther 2010; 127: 131-47.
44. Kuo L, Davis MJ, Chilian WM. Longitudinal gradients for endothelium-dependent and -independent vascular responses in the coronary microcirculation. Circulation 1995; 92: 518-52.
45. Pries AR, Reglin B, Secomb TW. Remodeling of blood vessels: responses of diameter and wall thickness to hemodynamic and metabolic stimuli. Hypertension 2005; 46: 725-31.
46. Pries AR, Reglin B. Coronary microcirculatory pathophysiology: can we afford it to remain a black box? Eur Heart J 2017; 38: 478-88.
47. Panting JR, Gatehouse PD, Yang GZ, et al. Abnormal subendocardial perfusion in cardiac syndrome X detected by cardiovascular magnetic resonance imaging. N Engl J Med 2002; 346: 1948-53.
48. Phan A, Shufelt C, Merz CN. Persistent chest pain and no obstructive coronary artery disease. JAMA 2009; 301: 1468-74.
49. Rosano GMC, Tousoulis D, McFadden E, Clarke J, Davies GJ, Kaski JC. Effects of neuropeptide Y on coronary artery vasomotion in patients with microvascular angina. Int J Cardiol 2017; 238: 123-7.
50. Heusch G, Baumgart D, Camici P, et al. Alpha-adrenergic coronary vasoconstriction and myocardial ischemia in humans. Circulation 2000; 101: 689-94.
51. Suzuki H, Takeyama Y, Koba S, Suwa Y, Katagiri T. Small vessel pathology and coronary hemodynamics in patients with microvascular angina. Int J Cardiol 1994; 43: 139-50.
52. Chauhan A, Mullins PA, Thuraisingham SI, Taylor G, Petch MC, Schofield PM. Abnormal cardiac pain-perception in syndrome X. J Am Coll Cardiol 1994; 24: 329-35.
53. Rosen SD, Paulesu E, Wise RJ, Camici PG. Central neural contribution to the perception of chest pain in cardiac syndrome X. Heart 2002; 87: 513-9.
54. Ong P., Camici PC, Beltrame JF, et al. Coronary Vasomotion Disorders International Study Group (COVADIS). International standardization of diagnostic criteria for microvascular angina. Int J Cardiol 2018; 250: 16-20.
55. Campisi R, Marengo FD. Coronary microvascular dysfunction in women with nonobstructive ischemic heart disease as assessed by positron emission tomography. Cardiovasc Diagn Ther 2017; 7: 196-205.
56. Gould KL, Johnson NP, Bateman TM, Beanlands RS, Bengel FM, Bober R. Anatomic versus physiologic assessment of coronary artery disease. Role of coronary flow reserve, fractional flow reserve, and positron emission tomography imaging in revascularization decision-making. J Am Coll Cardiol 2013; 62: 1639-53.
57. Naya M, Murthy VL, Taqueti VR, et al. Preserved coronary flow reserve effectively excludes high-risk coronary artery disease on angiography. J Nucl Med 2014; 55: 248-55.
58. Taqueti VR, Hachamovitch R, Murthy VL, et al. Global coronary flow reserve is associated with adverse cardiovascular events independently of luminal angiographic severity and modifies the effect of early revascularization. Circulation 2015; 131: 19-27.
59. Taqueti VR, Di Carli MF. Clinical significance of noninvasive coronary flow reserve assessment in patients with ischemic heart disease. Curr Opin Cardiol 2016; 31: 662-9.
60. Thomson LE, Wei J, Agarwal M, et al. Cardiac magnetic resonance myocardial perfusion reserve index is reduced in women with coronary microvascular dysfunction. A National Heart, Lung, and Blood Institute-sponsored study from the Women’s Ischemia Syndrome Evaluation. Circ Cardiovasc Imaging 2015; 8: e002481.
61. Yutaka H, Hisakazu U, Hajime N, et al. Diagnosis of vasospastic angina: Comparison of hyperventilation and coldpressor stress echocardiography, hyperventilation and cold-pressor stress coronary angiography, and coronary angiography with intracoronary injection of acetylcholine. Int JCard2007; 116: 331-7.
62. Antoni ML, Mollema SA, Delgado V, Atary JZ, Boersma E. Prognostic importance of strain and strain rate after acute myocardial infarction. Eur Heart J 2010; 31: 1640-7.
63. Bairey Merz CN, Pepine CJ, Walsh MN, Fleg JL. Ischemia and No Obstructive Coronary Artery Disease (INOCA): Developing evidence-based therapies and research agenda for the next decade. Circulation 2017; 135: 1075.
64. Ong P, Athanasiadis A, Sechtem U, et al. Coronary vasomotion disorders international study group (COVADIS). International standardization of diagnostic criteria for vasospastic angina. Eur Heart J 2017; 38: 2565-8.
65. Kissel Ch K, NiKoletou D. Cardiac rehabilitation and exercise prescription in symptomatic patients with nonobstructive coronary artery disease:A systematic review. Curr Treat Options Cardio Med 2018; 20: 78.
66. Caliskan M, Erdogan D, Gullu H, et al. Effects of atorvastatin on coronary flow reserve in patients with slow coronary flow. Clin Cardiol 2007; 30:475-9.
67. Eshtehardi P, McDaniel MC, Dhawan SS, et al. Effect of intensive atorvastatin therapy on coronary atherosclerosis progression, composition, arterial remodeling, and microvascular function. J Invasive Cardiol 2012; 24: 522-9.
68. Schwartzkopff B, Brehm M, Mundhenke M, Strauer BE. Repair of coronary arterioles after treatment with perindopril in hypertensive heart disease. Hypertension 2000; 36: 220-5.
69. Garg R, Rao AD, Baimas-George M, et al. Mineralocorticoid receptor blockade improves coronary microvascular function in individuals with type 2 diabetes. Diabetes 2015; 64: 236-42.
70. Kaski JC. Cardiac syndrome X in women: the role of oestrogen deficiency. Heart 2006; 92 Suppl 3: iii5-9.
71. Oelze M, Knorr M, Kroller-Scho S, et al. Chronic therapy with isosorbide-5-mononitrate causes endothelial dysfunction, oxidative stress, and a marked increase in vas -cular endothelin-1 expression. European Heart Journal 2013; 34: 3206-16.
72. Cannon RO 3rd, Watson RM, Rosing DR, Epstein SE. Efficacy of calcium channel blocker therapy for angina pectoris resulting from small-vessel coronary artery disease and abnormal vasodilator reserve. Am J Cardiol 1985; 56: 242-6.
73. Nalbantgil S, Altintig A, Yilmaz H, Nalbantgil I I, Önder R. The effect of trimetazidine in the treatment of microvascular angina. Int J Angiol 1999; 8: 40-3.
74. Cannon RO 3rd, Quyyumi AA, Mincemoyer R,et al. Imipramine in patients with chest pain despite normal coronary angiograms. N Engl J Med 1994; 330: 1411-7.
75. Turgeon RD, Pearson GJ, Graham MM. Pharmacologic treatment of patients with myocardial ischemia with no obstructive coronary artery disease. Am J Cardiol 2018; 121: 888-95.
76. Mansourati J, Da Costa A, Munier S, et al. Prevalence of factor v Leiden in patients with myocardial infarction and normal coronary angiography. Thromb Haemost 2000; 83: 822-5.
77. Lande G, Dantec V, Trossaert M, Godin JF, Le Marec H. Do inherited prothrombotic factors have a role in myocardial infarction with normal coronary arteriogram? J Intern Med 1998; 244: 543-4.
78. Larsen AI, Galbraith PD, Ghali WA, Norris CM, Graham MM, Knudtson ML; APPROACH Investigators. Characteristics and outcomes of patients with acute myocardial infarction and angiographically normal coronary arteries. Am J Cardiol 2005; 95: 261-3.
79. Pasupathy S, Air T, Dreyer RP, Tavella R, Beltrame JF. Review of patients presenting with suspected myocardial infarction and nonobstructive coronary arteries. Circulation 2015; 131: 861-70.
80. Safdar B, Spatz ES, Dreyer RP, et al. Presentation, clinical profile, and prognosis of young patients with myocardial infarction with nonobstructive coronary arteries (MINOCA): Results from the VIRGO study. J Am Heart Assoc 2018; 7. pii: e009174. doi: 10.1161/JAHA.118.00917.
81. Montone RA, Niccoli G, Fracassi F, et al. Patients with acute myocardial infarction and non-obstructive coronary arteries: safety and prognostic relevance of invasive coronary provocative tests. Eur Heart J 2018; 39, 91-8.
82. Ong P, Athanasiadis A, Hill S, Vogelsberg H, Voehringer M, Sechtem U. Coronary artery spasm as a frequent cause of acute coronary syndrome: the CASPAR (Coronary Artery Spasm in Patients with Acute Coronary Syndrome) Study. J Am Coll Cardiol 2008; 52: 523-7.
83. Dastidar AG, Rodrigues JC, Johnson TW, et al. Myocardial infarction with nonobstructed coronary arteries: Impact of CMR early after presentation. JACC Cardiovasc Imaging 2017; 10: 1204-6.
84. Chopard R, Jehl J, Dutheil J, et al. Evolution of acute coronary syndrome with normal coronary arteries and normal cardiac magnetic resonance imaging. Arch Cardiovasc Dis 2011; 104: 509-17.
85. Agewall S, Beltrame JF, Reynolds HR,et al. Esc working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J 2017;38: 143-53.
86. Kim RJ, Fieno DS, Parrish TB,et al. Relationship of MRI delayed contrast enhancement to irreversible injury, infarct age, and contractile function. Circulation 1999; 100: 1992-2002.
87. Dastidar AG, Rodrigues JC, Ahmed N, Baritussio A, Bucciarelli- Ducci C. The role of cardiac mri in patients with troponin-positive chest pain and unobstructed coronary arteries. Curr Card Imag Rep 2015; 8: 28.
88. Tornvall P, Gerbaud E, Behaghel A, et al. Myocarditis or “true” infarction by cardiac magnetic resonance in patients with a clinical diagnosis of myocardial infarction without obstructive coronary disease: A meta-analysis of individual patient data. Atherosclerosis 2015; 2 41: 87-91.
89. Doltra A, Stawowy P, Dietrich T, Schneeweis C, Fleck E, Kelle S. Magnetic resonance imaging of cardiovascular fibrosis and inflammation: from clinical practice to animal studies and back. BioMed Res Intern 2013; 2013: 676489.
90. Friedrich MG, Sechtem U, Schulz-Menger J,et al. International Consensus Group on Cardiovascular Magnetic Resonance in M. Cardiovascular magnetic resonance in myocarditis: A jacc white paper. Journal Amer Coll Card 2009; 53:1475-87.
91. Fernandez-Perez GC, Aguilar-Arjona JA, de la Fuente GT,et al. Takotsubo cardiomyopathy: Assessment with cardiac MRI. AJR Am J Roentgen 2010; 195: W139-45.
92. Mitchell JH, Hadden TB, Wilson JM, Achari A, Muthupillai R, Flamm SD. Clinical features and usefulness of cardiac magnetic resonance imaging in assessing myocardial viability and prognosis in takotsubo cardiomyopathy (transient left ventricular apical ballooning syndrome). Am J Cardiol 2007; 100: 296-301.
93. Antman E, Muller J, Goldberg S, et al. Nifedipine therapy for coronary artery spasm: experience in 127 patients. N Engl J Med 1980; 302: 1269-73.
94. Schwartzkopff B, Brehm M, Mundhenke M, Strauer BE. Repair of coronary arterioles after treatment with perindopril in hypertensive heart disease. Hypertension 2000; 36: 220-5.
95. Pauly DF, Johnson BD, Anderson RD, et al. In women with symptoms of cardiac ischemia, nonobstructive coronary arteries, and microvascular dysfunction, angiotensinconverting enzyme inhibition is associated with improved microvascular function: A double blind randomized study from the National Heart, Lung and Blood Institute Women’s Ischemia Syndrome Evaluation (WISE). Am Heart J 2011; 162: 678-84.
96. Werdan, K. Perings S, Köster R, et al. Effectiveness of ivabradine treatment in different subpopulations with stable angina in clinical practice: a pooled analysis of observational studies. Cardiology 2016; 135: 141-50.
97. Oelze M, Knorr M, Kröller-Schön S, et al. Chronic therapy with isosorbide-5-mononitrate causes endothelial dysfunction, oxidative stress, and a marked increase in vascular endothelin-1 expression. Eur Heart J 2013; 34: 3206-16.
98. Balla C, Pavasini R, Ferrari R Treatment of angina: Where are we?. Cardiology 2018; 140: 52-67.
99. Guarini G , Huqi A, Morrone D, Capozza PFG, Marzilli M. Trimetazidine and other metabolic modifiers. Eur Cardiol 2018; 13: 104-11.
