SOLEDAD E. GONZÁLEZ 1, LORENA REGAIRAZ 2, NOELIA S. FERRANDO 3, VERONICA V. GONZÁLEZ MARTÍNEZ 4, MARTÍN R. SALAZAR 5, ELISA ESTENSSORO 6
1 Ministerio de Salud de la Provincia de Buenos Aires, 2 Servicio de Inmunología, Hospital Interzonal de Agudos Especializado en Pediatría Sor María Ludovica, La Plata, 3 Instituto de Hemoterapia, Ministerio de Salud de la Provincia de Buenos Aires, 4 Dirección de Investigación y Cooperación Técnica, Ministerio de Salud de la Provincia de Buenos Aires, 5 Servicio de Docencia e Investigación, Hospital Interzonal de Agudos San Martín, La Plata, 6 Terapia Intensiva, Hospital Interzonal de Agudos San Martín, La Plata, Argentina
Resumen Se trata de un estudio multicéntrico de cohorte retrospectivo, observacional, desde 15/5 a 1/7, 2020, en 272 pacientes COVID-19 internados en hospitales de la provincia de Buenos Aires, incluidos en un programa de acceso expandido de plasma de convalecientes de COVID-19. Nuestros objetivos fueron analizar letalidad y sus factores de riesgo independientes, y evaluar la evolución favorable, definida como alta hospitalaria, permanencia en sala (PISO), o alta de la UTI. Los pacientes fueron estratificados en 4 subgrupos: ingreso a PISO (n = 100) con neumonía y/o requerimiento de oxígeno; a UTI (n = 87); a UTI con requerimiento de ventilación mecánica (UTI-VM; n = 56), y a UTI-VM con shock séptico (UTI-VM-SS; n = 29). La letalidad total a los 28 días fue 26.1%, (71/272), para PISO 14.0%; UTI, 18.4%; UTI-VM, 44.6%; y UTI-VM-SS, 55.2%. El tiempo medio de supervivencia (días): 25.6 ± 0.6 (PISO); 25.3 ± 0.7 (UTI); 20.8 ± 1.2 (UTI-VM) y 18.2 ± 1.8 (UTI- VMSS). Los predictores independientes de letalidad fueron VM, shock séptico y peso. Se registró una evolución favorable en 81.4% de los pacientes en PISO; 70.9% en UTI, 39.6% en UTI-VM, y en 27.6% de UTI-VM-SS. La gravedad al ingreso, edad, peso y frecuencia cardíaca fueron predictores independientes de evolución. No se registraron efectos adversos graves. Por falta de un grupo control, no fue posible evaluar la eficacia del plasma de convaleciente. La letalidad (26%) fue mayor que en otros ensayos clínicos con plasma convaleciente; esto podría deberse a mayor proporción de aquellos con VM y shock séptico en nuestra cohorte.
Palabras clave: COVID-19, plasma convaleciente, programa de acceso ampliado
Abstract This is a preliminary, multicenter, retrospective cohort study, including 272 consecutive patients with COVID-19 admitted to hospitals in Buenos Aires Province, between May 15th and July 1st, 2020, included in an expanded access program to convalescent plasma. Our objectives were to analyze mortality and its independent risk factors, and to assess the occurrence of a favorable evolution, defined as hospital discharge, or stay at the ward, or transfer from ICU to ward. Patients were stratified int o 4 subgroups: admission to the ward with pneumonia and/or oxygen requirement (WARD; n = 100); ICU admission (ICU; n = 87); ICU admission with requirement of mechanical ventilation (ICU-MV; n = 56), and ICU-MV plus septic shock (ICU-MV-SS; N = 29). Mortality at 28 days was 26.1% for the entire group, 14.0% for WARD group, 18.4% for ICU, 44.6% for ICU-MV, and 55.2% for ICU-MV-SS. Mean survival time (days) was 25.6±0.6 (WARD); 25.3±0.7 (ICU); 20.8±1.2 (ICU-MV) and 18.2 ± 1.8 (ICU-MV-SS). Independent predictors of mortality were MV, septic shock and weight. A favorable evolution
occurred in 81.4% of WARD patients; in 70.9% of ICU; in 39.6% of ICU-MV and in 27.6% of ICU-MV-SS patients. Severity of illness on admission, age, weight and heart rate were independently associated with evolution. No major adverse effects were recorded. The lack of a control group precluded the estimation of efficacy. However, our 26% mortality rate was higher than that of the treatment arm of clinical trials comparing plasma with usual treatment, which might be ascribed to higher proportion of patients with MV and septic shock in our cohort.
Key words: COVID-19, convalescent plasma, expanded access program
Dirección postal:Soledad González, Avenida 51 N° 1120 entre 17 y 18, 1900 La Plata, Argentina
e-mail: sole.estrella.gonzalez@gmail.com
• Existe amplia experiencia en la utilización de plasma en infecciones virales (ej.: sarampión, influenza y fiebre hemorrágica argentina). Se ha utilizado en infecciones por SARS-CoV y MERS-CoV, pero su beneficio no se ha demostrado en forma categórica. Teniendo esto en cuenta, se ha propuesto en distintos países, el uso de plasma de convalecientes en la infección por SARSCoV-2.
• En este estudio multicéntrico de cohorte, presentamos los resultados del uso plasma de convalecientes en la provincia de Buenos Aires, en 272 pacientes COVID-19 internados en sala y en UTI con y sin ventilación mecánica, con y sin shock séptico y se aportan datos cuantitativos de su evolución.
A fines de diciembre 2019, la Comisión Municipal de Salud de Wuhan (provincia de Hubei, China) notifica un conglomerado local de casos de neumonía. Posteriormente se determina que están causados por un nuevo coronavirus 1. La Organización Mundial de la Salud (OMS) declara el 11 de marzo el estado de pandemia debido a la infección por SARS-CoV-2. El COVID-19 se ha propagado ampliamente tras la rápida diseminación del virus en China y su introducción subsecuente en otros países, reportándose, hasta el 6 de agosto, 18 614 177 casos y 702 642 muertes relacionadas directamente con el virus en el mundo 2. En el ámbito de la provincia de Buenos Aires (PBA), hasta esa fecha, se confirmaron 134 127 casos y 2276 fallecidos. De acuerdo a la OMS, es esperable que cerca de un 15% de los casos experimente una enfermedad grave, y que el 5% padezca una enfermedad crítica.
Las complicaciones incluyen insuficiencia respiratoria, síndrome de distrés respiratorio agudo (SARS, por sus siglas en inglés), sepsis, shock séptico, tromboembolismo, falla múltiple de órganos incluyendo afección renal y cardíaca 3.
Más de 200 opciones terapéuticas están siendo investigadas en unos 1700 ensayos clínicos. El uso de dexametasona en adultos con hipoxemia ha demostrado disminuir la mortalidad 4, mientras que el remdesivir brindaría beneficios acortando la duración de los síntomas en pacientes graves 5. Actualmente, no existe evidencia procedente de ensayos clínicos controlados para recomendar un tratamiento específico.
En la búsqueda de un tratamiento eficaz y seguro de la enfermedad, atendiendo a su rápida propagación y a la necesidad apremiante de brindar una respuesta, se propuso la utilización de plasma de convalecientes en pacientes COVID-19 en la PBA, basado en antecedentes de otras enfermedades virales y en estudios provenientes de China que informaron sobre un potencial beneficio en infectados por SARS-CoV-2 6,7. El uso de inmunización pasiva ha sido utilizado ampliamente para la prevención o el tratamiento de enfermedades virales tales como poliomielitis, sarampión, paperas e influenza. Más recientemente, el plasma de convalecientes fue utilizado en los brotes de gripe H1N1 (2009-2010), otros virus gripales (H5N1 y H7N9) y Ébola (África, 2013) 8, 9. En enfermedades graves producidas por coronavirus, se ha utilizado para los brotes de SARS 1 (2003) y síndrome respiratorio de Oriente Medio (MERS, en 2012) por la falta de efectividad de tratamientos alternativos 10, 11. En nuestro país, el uso de la inmunización pasiva ha demostrado eficacia en el tratamiento de la fiebre hemorrágica argentina, que posee una tasa de letalidad sin tratamiento de hasta un 30%.
La administración temprana de plasma inmune en dosis estandarizadas de anticuerpos neutralizantes reduce la letalidad a menos del 1% 12.
En vista de este conocimiento, y en el marco de la emergencia sanitaria, a mediados de mayo de 2020 se creó el Registro Único de Donantes de Plasma Convaleciente de la Provincia de Buenos Aires (RUDPCBA) para la obtención, procesamiento, distribución y recomendaciones terapéuticas sobre su uso experimental en el tratamiento de pacientes con COVID-19 graves, o moderados con riesgo de progresión a formas de mayor gravedad 13.
En este trabajo se presentan los resultados preliminares de un estudio multicéntrico observacional retrospectivo que se enmarca dentro de las recomendaciones terapéuticas del citado RUDPCBA. El objetivo de este estudio preliminar fue analizar la letalidad y sus factores de riesgo determinantes en pacientes con COVID-19 moderado y grave que recibieron plasma de convalecientes.
Adicionalmente, se analizó la evolución de acuerdo a los estratos de gravedad inicial en ese grupo de enfermos.
Materiales y métodos
El presente es un estudio de cohorte retrospectivo multicéntrico, observacional efectuado en PBA (las instituciones participantes se presentan en Anexo), que incluye pacientes internados en forma consecutiva, con COVID-19 confirmados mediante RT-PCR para SARS CoV-2, desde el 15 de mayo hasta el 1 de julio del 2020, y con al menos 28 días de seguimiento desde la aplicación del plasma de acuerdo con el RUDPCBA. Se trata de un protocolo de acceso expandido al plasma como opción de tratamiento experimental, que no reemplaza otros tratamientos concomitantes que el médico tratante considere pertinentes 13.
La administración de plasma se efectuó a solicitud del médico tratante, a través de un procedimiento centralizado en la Dirección Provincial de Hospitales. Los datos fueron recolectados prospectivamente por medio de un formulario especialmente diseñado a tal fin. Para cada paciente se registraron las siguientes características epidemiológicas: edad, sexo, presencia de comorbilidades (hipertensión arterial, diabetes, obesidad, enfermedad cardiovascular, enfermedad pulmonar crónica e inmunodeficiencia)14,15, frecuencia cardíaca, duración de síntomas previos a la aplicación del plasma, uso de hidroxicloroquina, lopinavir/ritonavir, dexametasona, utilización de ventilación mecánica, shock séptico, y fecha de alta hospitalaria o fallecimiento. Adicionalmente, se registró la presencia de eventos adversos graves: lesión pulmonar aguda relacionada con la transfusión (TRALI, por sus siglas en inglés), sobrecarga cardíaca asociada a transfusión (TACO, por sus siglas en inglés)16 en las 72 horas de recibida la transfusión, mediante una planilla diseñada con ese fin.
Las personas recuperadas de COVID-19 fueron convocadas como donantes voluntarios de plasma convaleciente en centros habilitados según las especificaciones del RUDPCBA, cumpliendo con los principios de solidaridad, voluntariedad y compromiso social. La obtención del plasma fue por método de aféresis. Se realizó un dosaje cualitativo del nivel de anticuerpos IgG anti-SARS-2 mediante la técnica de ELISA COVIDAR IgG que utiliza como antígenos el trímero de proteína S nativa y su dominio de unión al receptor, RBD (receptor binding domain). Ambos antígenos se obtuvieron a través de técnicas de ADN recombinante producido en células humanas (desarrollado por el grupo COVIDAR, Fundación Instituto Leloir). Los dosajes de anticuerpos anti SARS-CoV-2 fueron realizados por el Servicio de Inmunoserología del Laboratorio Central del Hospital Sor María Ludovica de La Plata.
Cada unidad de plasma convaleciente transfundida consta de un volumen de 200-250 ml. La dosificación de las unidades de plasma convaleciente se calculó de acuerdo al peso del paciente (1 dosis para pacientes con peso < 70 kg y 2 dosis con peso ≥ 70 kg). La aplicación de plasma fue considerada como temprana (< 7 días del comienzo de síntomas) o tardía (≥ 7 días) 17.
De acuerdo a la gravedad inicial de los internados con COVID-19, la cohorte fue estratificada en 4 grupos de riesgo, excluyentes entre sí: 1. Internación en sala con neumonía y/o requerimiento de oxígeno (PISO). 2. Internación en unidad de terapia intensiva (UTI). 3. Internación en UTI con requerimiento de ventilación mecánica (UTI-VM). 4. Internación en UTI con requerimiento de ventilación mecánica y shock séptico (UTI-VM-SS).
La variable principal de resultado fue letalidad a los 28 días. La variable secundaria fue evolución favorable, definida para el grupo PISO como alta o permanencia en piso, y para el grupo UTI, alta o pase a piso.
Las variables continuas fueron expresadas como media ± desvío estándar (DE) o como mediana y rango intercuartílico, de acuerdo a la naturaleza de los datos, y se compararon sobrevivientes vs. no sobrevivientes, por medio de test t o U de Mann-Whitney, para muestras independientes. Las variables categóricas fueron expresadas como porcentajes (%) y comparadas con χ2.
La supervivencia del grupo plasma en cada estrato de gravedad (PISO, UTI, UTI-VM, UTI-VM-SS) fue estimada por medio de curvas de Kaplan-Meier y se analizaron las diferencias por medio de log-rank test. Se utilizó regresión de Cox para identificar los factores independientemente asociados a la supervivencia. El análisis se construyó en dos bloques: en el primero se incluyó la estratificación de riesgo inicial (modelo no ajustado), y en el segundo bloque se incluyeron las covariables con un ingreso condicional hacia adelante (modelo ajustado, con p > 0.10 como criterio de exclusión del modelo).
Las variables que se ingresaron al modelo son las que se muestran en la Tabla 1, sin transformaciones adicionales. Los riesgos fueron expresados como hazard risk (HR) e intervalo de confianza del 95% (IC95%).
Las variables relacionadas con evolución favorable fueron evaluadas por medio de regresión logística y tal como se presentan en la Tabla 1. Los riesgos fueron expresados como razón de las ventajas (odds-ratio, OR) con su intervalo de confianza del 95% (IC95%). Se consideró como significativa una p < 0.05 para prueba bilateral. Todos los análisis fueron efectuados por medio del programa estadístico SSPS-21 (IBM, 2013).
Este estudio fue aprobado por el Comité de Bioética Central del Ministerio de Salud de la PBA (Expediente 2020-14965594). La administración de plasma de convaleciente fue aceptada mediante firma de consentimiento informado, según las normas de RUDPCBA (Expediente 2919/2123/2020).
Resultados
Desde el 15 de mayo hasta el 1 de julio de 2020, 272 pacientes recibieron 313 unidades de plasma de convaleciente, 77 mujeres (54 ± 16 años) y 195 varones (53 ± 14 años, p = 0.71). Como puede observarse en la Tabla 1, las comorbilidades más frecuentes fueron la obesidad y la hipertensión arterial. En el momento de la indicación del plasma, 100 (36.8%) se encontraban internados en PISO; 87 (32.0%) en UTI; 56 (20.6%) en UTI-VM; y 29 (10.7%) en UTI-VM-SS. También se presenta en la Tabla 1 la comparación de las características clínicas entre sobrevivientes y no sobrevivientes. Solamente la edad y la presencia de shock séptico difieren significativamente entre ambos grupos; el peso presentó una diferencia en el margen de la significación estadística.
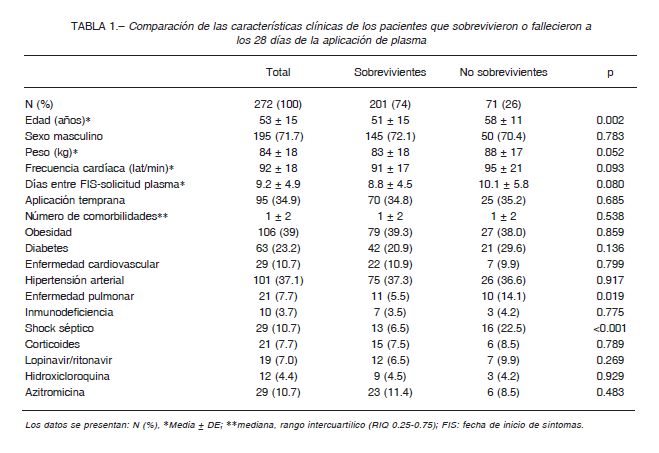
En la Figura 1 se observa la distribución del título de anticuerpos de las unidades transfundidas (n = 313).
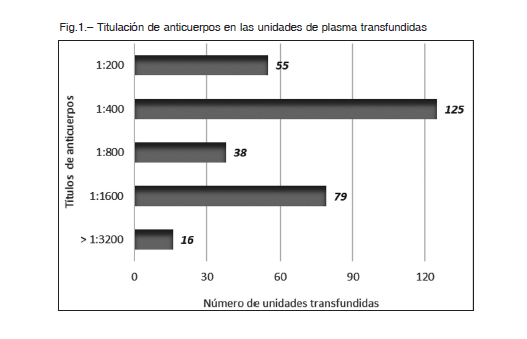
La letalidad global a los 28 días fue de 26.1% (71/272); 14.0% en PISO; 18.4% en UTI; 44.6% en UTI-VM; y 55.2% en UTI-VM-SS. En la Figura 2 se muestran las curvas de supervivencia a los 28 días de acuerdo a la gravedad de la enfermedad en el momento de indicación de plasma de convaleciente. Las supervivencias medias fueron de 25.6 ± 0.6; 25.3 ± 0.7; 20.8 ± 1.2 y 18.2 ± 1.8 días para los grupos PISO, UTI, UTI-VM y UTI-VM-SS, respectivamente (p < 0.001 de acuerdo al long-rank test).
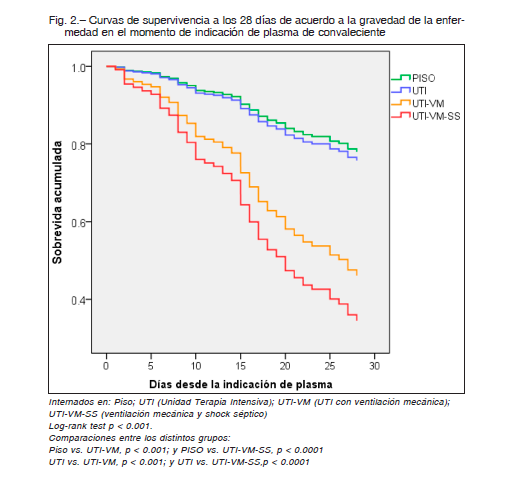
Considerando a PISO como grupo de riesgo 1, los cocientes de riesgo de muerte a los 28 días (Hazard ratio, HR) no ajustados, fueron 1.12 (IC95% 0.54-2.32), 3.11 (IC95% 1.62-5.98), y 4.28 (IC95% 2.09-8.77) para UTI, UTI-VM y UTI-VM-SS, respectivamente. En la Tabla 2 se muestra el modelo de regresión de Cox con ajuste por múltiples variables (entre ellas: edad, diabetes, EPOC, obesidad, enfermedad cardiovascular e hipertensión arterial). Solo la ventilación mecánica (UTI-VM), el shock séptico (UTI-VM-SS) y el peso estuvieron asociados independientemente con la mortalidad.
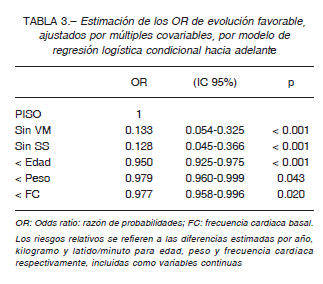
Con respecto a la evolución favorable como variable de resultado secundaria, estuvo presente en 164 de los 258 pacientes con datos disponibles (63.6%). De acuerdo con la gravedad inicial, se observó una evolución favorable en 79/97 (81.4%) de los internados en piso; 56/79 (70.9%) en UTI; 21/53 (39.6%) en UTI-VM y 8/29 (27.6%) en UTI-VM-SS. En la Tabla 3 se muestra el modelo de regresión logística evaluando las variables relacionadas con la evolución favorable. La ausencia de VM o SS, la
menor edad, el menor peso y una frecuencia cardíaca basal más baja, se relacionaron independientemente con una evolución favorable.
En cuanto al desarrollo de eventos adversos graves, no se registró ningún episodio de TACO o de TRALI.
Discusión
Este estudio describe las características de una población no seleccionada de 272 pacientes consecutivos con COVID-19 (confirmado por RT-PCR) en estadios moderado-grave (estadios 3-5)18 que recibieron plasma de convaleciente.
La letalidad global observada fue del 26.1%. Esta letalidad fue mayor que la observada en el grupo que recibió plasma en los estudios controlados aleatorizados, la que estuvo en un rango de 5 a 15.7% 19-21. La mayor letalidad observada en nuestro estudio puede ser atribuida a la mayor proporción de pacientes críticos (en VM y/o shock séptico) que representaron el 31.3% de los pacientes incluidos, notoriamente superior a la informada en los estudios mencionados 19-21. Por ejemplo, en el grupo plasma del estudio de Rasheed y col. (n = 21, mortalidad 5%) no se incluyeron pacientes con falla multiorgánica ni con VM tardía; en el estudio de Gharbharan y col. (n = 43, mortalidad 14.8%) no se consideraron pacientes con VM mayor de 96 horas; y, finalmente, en el estudio de Li y col, se excluyeron pacientes con distrés respiratorio grave o con shock séptico grave 19-21. Otros estudios observacionales que comunicaron menor letalidad en el grupo plasma, como el estudio efectuado por Liu y col. (n = 39, mortalidad 12.8%) y el estudio realizado por Xia y col. (n = 138, mortalidad 2.2%) incluyeron solo 10% y 1.4% de pacientes en VM respectivamente 22, 23. Sin embargo, estos números difieren significativamente de la letalidad de 8.5% de la serie de casos de la Clínica Mayo (n = 20 000), que incluye un 37% de pacientes con VM y 12% con shock séptico 24. Es de remarcar que este estudio evalúa la letalidad precoz a los 7 días, a diferencia a la de la mayoría de los trabajos y el nuestro que utilizan la letalidad a los 28 días. Por este motivo los datos no son comparables.
Adicionalmente, es importante señalar que la letalidad en el distrés respiratorio, la sepsis y el shock séptico es más elevada en América Latina que la informada en EE.UU. y Europa 25-27. Con respecto a los pacientes sin VM y sin shock séptico (grupos PISO y UTI) la letalidad fue del 14% y 18% respectivamente, comparable a la observada en el grupo que recibió plasma en un estudio de casos y controles (n =115, mortalidad 14%) que evaluó su eficacia en pacientes no ventilados 16. Los factores independientes asociados a letalidad, fueron la gravedad inicial y el peso, coincidiendo con la literatura 3, 28, 29.
En cuanto al análisis del objetivo secundario de nuestro estudio, 81.4% de los pacientes del grupo PISO y 70.9% en el grupo UTI, mostraron evolución favorable reforzando la hipótesis de un mayor beneficio en no ventilados 18, 19.
Los factores asociados a evolución favorable fueron el no requerimiento de VM, no presentar shock séptico, la menor edad y una frecuencia cardíaca basal más baja 30, 31.
La ausencia de eventos adversos graves como TACO y TRALI, coincide con la literatura y remarca la seguridad de la administración de plasma de convaleciente 23,24.
La mayor limitación de este estudio es la falta de un grupo control, lo que impide estimar la eficacia de esta terapéutica. La falta de evaluación de la gravedad por medio de alguna escala o escore no permite el ajuste adicional de los resultados.
Como conclusión, nuestro estudio aporta los primeros datos cuantitativos de pacientes que han recibido plasma para el tratamiento de COVID-19 moderado-grave. La letalidad y la evolución favorable tienen una clara relación con el estado clínico en el momento de la indicación, en especial con VM o SS. Adicionalmente, el uso de plasma de convaleciente mostró seguridad transfusional.
Agradecimientos: A Luis Cantaluppi, Yanina Spinelli, Cecilia Girard Bosch, Patricia Méndez, Rosario Céspedes, Gian Pietro Fernández Rojas, Laura Vives, Verónica Copolillo, Natalia Núñez, Alejandra Debonis, Agustina Lagrava, Ariel Sola, Alejandra Toledo, Miriam Cardalda, Jorgelina Aberer, Silvana Gabriela Turano, Carlos Antonio Cuchetti, Agustina Martins, Luciana Spizzirri, Gustavo Mariño, Andrea Lopardi, Cecilia Avatte, Viviana Falasco, Martín Fabián Ruiz, Ana Laura González, Gabriela Rodríguez, Horacio Rubén López Alegre, Pablo Schon, Mariana Casalins, Gustavo Cañete, Soledad Vallejo, Karina Sarmiento, Christian Martínez Kovach, Fabiana Ferrero, Liliana Disalvo, Ana Varea, Ignacio Méndez, Lucrecia Fotia, Marcela Padua, Patricia Carrera Ramos, Vanesa Fernández, Isabel Ballesteros, Adriana Hilda Romani, Daniela Federico, Diego Ortale, Viviana Jalife, Josefina Viaño, Mariana Jaime, Federico Gorini, Sandra González, Analía Vairo, Marina Álvarez, Pablo Marocco y Diego Saez. Sin su apoyo no habría sido posible la realización de este estudio.
El equipo de investigadores y colaboradores dedica este estudio a la Dra. Nora Etchenique, quien fue una de las principales impulsoras del Protocolo de Uso de Plasma Convaleciente de COVID-19 en la Provincia de Buenos Aires, pero fundamentalmente, fue una activa defensora de las políticas públicas en materia sanitaria. En sus más de 40 años de labor profesional, la Dra. Etchenique reivindicó de manera permanente el uso de la sangre como recurso estratégico del Estado, promoviendo la donación de sangre voluntaria, solidaria y con compromiso social, convencida de que es la única forma de brindar a todos los pacientes un producto seguro. Sin su aporte y convicción, este proyecto no hubiera sido posible.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Organización Mundial de la Salud. Cronología de la respuesta de la OMS a la COVID-19. En: https://www.who.int/es/news-room/detail/29-06-2020-covidtimeline; consultado julio 2020.
2. World Health Organization. Coronavirus disease (COVID-19). Situation report 199. Geneva: WHO; 2020. En: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200806-covid-19-sitrep-199.pdf?sfvrsn=6b9d262d_2; consultado julio 2020.
3. WHO. Clinical management of COVID-19. En: https://www.who.int/publications/i/item/clinical-management-ofcovid-19; consultado julio 2020.
4. RECOVERY Collaborative Group, Horby P, Lim WS, et al. Dexamethasone in hospitalized patients with Covid-19 – preliminary report. N Engl J Med 2020; 10.1056/NEJMoa2021436. doi: https://doi.org/10.1056/NEJMoa2021436
5. OPS/OMS. Seguridad de los pacientes con COVID-19 en relación con el uso de medicamentos sin evidencia científica sobre su beneficio. En: https://iris.paho.org/bitstream/handle/10665.2/52219/OPSEIHHACOVID-19200003_spa.pdf?sequence=1&isAllowed=y; consultado julio 2020.
6. Duan K, Liu B, Li C,et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci USA 2020; 117: 9490-6.
7. Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA 2020; 323: 1582-9.
8. Casadevall A, Scharff MD. Return to the past: the case for antibody-based therapies in infectious diseases. Clin Infect Dis 1995; 21: 150-61.
9. Mc Allister F, Mantegazza A, Garzón, et al. Uso de plasma de convalecientes para tratamiento de COVID-19. Historia y evidencia. Medicina (B Aires) 2020; 80: 82-6.
10. Cheng Y, Wong R, Soo YO, et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis 2005; 24: 44-6.
11. Arabi YM, Hajeer AH, Luke T, et al. Feasibility of using convalescent plasma immunotherapy for MERS-CoV infection, Saudi Arabia. Emerg Infect Dis 2016; 22: 1554-61.
12. Maiztegui JI, Fernandez NJ, de Damilano AJ. Efficacy of immune plasma in treatment of argentine haemorrhagic fever and association between treatment and a late neurological syndrome. Lancet 1979; 2: 1216-7.
13. Gobierno de la Provincia de Buenos Aires. Emergencia Sanitaria. Registro Único de Donantes de Plasma Convaleciente de la Provincia de Buenos Aires (RUDPCBA) para la obtención, procesamiento, distribución y recomendaciones terapéuticas sobre su uso en el tratamiento de pacientes con COVID-19. En: https://portal-coronavirus.gba.gob.ar/es/efectores-de-salud; http://www.femeba.org.ar/documentos/download/4860-uso-de-plasma-convaleciente-para-el-tratamiento-de-pacientes-con-covid-19.pdf; consultado agosto 2020.
14. Guan W, Ni Z, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020: NEJMoa2002032. doi: https://doi.org/10.1056/NEJMoa2002032.
15. Grasselli G, Zangrillo A, Zanella A, et al. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy. JAMA 2020; 323: 1574–81.
16. Narick C, Triulzi DJ, Yazer MH. Transfusion-associated circulatory overload after plasma transfusion. Transfusion 2012; 52: 160-5.
17. Abolghasemi H, Eshghi P, Cheraghali AM, et al. Clinical efficacy of convalescent plasma for treatment of COVID-19 infections: Results of a multicenter clinical study Transfus Apher Sci 2020; 102875. doi: https://doi.org/10.1016/j.transci.2020.102875.
18. WHO. COVID-19 Therapeutic Trial Synopsis. En: https://www.who.int/publications/i/item/covid-19-therapeutic-trialsynopsis; consultado agosto 2020.
19. Rasheed AM, Ftak DF, Hashim HA, Maulood MF, Kabah KK, Abdulamir AS. The therapeutic effectiveness of convalescent plasma therapy on treating COVID-19 patients residing in respiratory care units in hospitals in Baghdad, Iraq. Preprint medRxiv2020.06.24.20121905. https://doi.org/10.1101/2020.06.24.20121905.
20. Gharbharan A, Jordans C, Geurtsvankessel C, et al. Convalescent plasma for COVID-19. A randomized clinical trial. medRxiv 2020.07.01.20139857. doi: https://doi.org/10.1101/2020.07.01.20139857.
21. Li L, Zhang W, Hu Y, et al. Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and life-threatening COVID-19: A randomized clinical trial. JAMA 2020; e2010044. doi:10.1001/jama.2020.10044.
22. Liu S, Lin H, Baine I, et al. Convalescent plasma treatment of severe COVID-19: A matched control study. medRxiv 2020.05.20.20102236. doi: https://doi.org/10.1101/2020 .05.20.20102236.
23. Xia X, Li K, Wu L, et al. Improved clinical symptoms and mortality on severe/critical COVID-19 patients utilizing convalescent plasma transfusion. Blood 2020; 136:755-9.
24. Joyner MJ, Bruno KA, Klassen SA, et al. Safety update: COVID-19 convalescent plasma in 20,000 hospitalized patients. Mayo Clin Proc 2020. doi: https://doi.org/10.1016/j.mayocp.2020.06.028.
25. Estenssoro E, Kanoore Edul VS, Loudet CI, et al. SATISEPSIS Investigators. Predictive validity of sepsis-3 definitions and sepsis outcomes in critically ill patients: a cohort study in 49 ICUs in Argentina. Crit Care Med 2018; 46: 1276-83.
26. Machado FR, Cavalcanti AB, Bozza FA, et al; SPREAD Investigators, Latin American Sepsis Institute Network: The epidemiology of sepsis in Brazilian intensive care units (the Sepsis PREvalence Assessment Database, SPREAD): An observational study. Lancet Infect Dis 2017; 17: 1180–9.
27. Laffey JG, Madotto F, Bellani G, et al. Geo- economic variations in epidemiology, patterns of care, and outcomes in patients with acute respiratory distress syndrome: insights from the LUNG SAFE prospective cohort study. Lancet Respir Med 2017; 5: 627-38.
28. Kalligeros M, Shehadeh F, Mylona EK, et al. Association of obesity with disease severity among patients with Coronavirus Disease 2019. Obesity (Silver Spring) 2020; 28: 1200-4.
29. Simonnet A, Chetboun M, Poissy J, et al. High prevalence of obesity in severe acute respiratory syndrome Coronavirus-2 (SARS-CoV-2) requiring invasive mechanical ventilation. Obesity (Silver Spring) 2020; 28: 1195-9.
30. Docherty AB, Harrison EM, Green CA, et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. BMJ 2020; 369:m1985. doi: https://doi.org/10.1136/bmj.m1985.
31. Xai CC, Shih TP, Ko WC, Tang HJ, Hsueh PR. Severe acute respiratory syndrome coronavirus 2 (SARS- CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges. Int J Antimicrob Agents 2020; 55: 105924.
Anexo
Instituciones participantes
Clínica Monte Grande; HIAEC San Juan de Dios; HIAEP Sor María Ludovica; HIAYC Alejandro Korn; HIGA Dr. José Penna; HIGA Eva Perón, San Martín; HIGA Evita, Lanús; HIGA Gral. San Martín, La Plata; HIGA Luisa C. De Gandulfo; HIGA Pedro Fiorito; HIGA Presidente Perón; HIGA Prof. Dr. Ramón Carrillo; HIGA Prof. Dr. Rodolfo Rossi; HIGA Prof. Luis Güemes; HIGA San Roque; HIGA Vicente López y Planes; HLG Nuestra Sra del Carmen; HMTYE Abete; Hospital Central de San Isidro; Hospital Central Sanguinetti; Hospital Cuenca Alta; Hospital del Bicentenario LF Leloir, E. Echeverría; Hospital Diego Thompson; Hospital Español La Plata; Hospital Héctor Cura; Hospital Italiano La Plata; Hospital Mercante; Hospital Municipal Pte. Néstor Kirchner de Escobar; Hospital Municipal de Salto; Hospital Municipal Emilio Ferreyra, Necochea; Hospital Municipal Emilio Zerboni; Hospital Municipal Eva Perón; Hospital Municipal Houssay; Hospital Municipal Lavallol, Lomas de Zamora; Hospital Municipal Ostaciana B. de Lavignolle, Morón; Hospital Municipal San Andrés de Giles; Hospital Municipal San Carlos; Hospital S.T. Santamarina Hospital San José de Campana; HZA Dr. Lucio Melendez; HZG Dr. Alberto E. Balestrini; HZGA Cetrángolo; HZGA Dr. Iriarte; HZGA Dr. Alberto Antranik Eurnekian; HZGA Dr. Carlos Alberto Bocalandro; HZGA Dr. Diego Paroissien; HZGA Dr. E. Wilde; HZGA Dr. Enrique Erill; HZGA Evita Pueblo; HZGA Magdalena Villegas de Martinez; HZGA Oñativia; HZGA Petrona V. de Cordero; HZGA Virgen del Carmen, Zárate e Instituto Médico Platense
