FERNANDO JERKOVICH 1, LEONARDO RIZZO 2, JUAN E. FANTI 2, MARÍA F. FANTI 2, FABIÁN PITOIA 2
1 División Endocrinología, Hospital de Clínicas José de San Martín, 2 Consultorio privado, Buenos Aires, Argentina
Resumen Existen numerosas comunicaciones de hallazgo incidental de remanentes del conducto tirogloso (CTG) posteriores a una tiroidectomía total, pero se desconoce su implicancia en pacientes con cáncer diferenciado de tiroides (CDT). Nuestro objetivo fue determinar frecuencia de detección ecográfica de remanentes del CTG posterior a la tiroidectomía total en pacientes con CDT y evaluar el impacto del hallazgo en la respuesta al tratamiento. Se incluyeron 377 pacientes con CDT tratados con tiroidectomía total entre enero 1994 y enero 2017, con seguimiento de al menos un año posterior a la cirugía. Se detectó la presencia de remanente del CTG en 16/377 (4.2%): 15 de bajo riesgo de recurrencia y uno de riesgo intermedio. Trece recibieron radioyodo. Todos tuvieron un estado sin evidencia de enfermedad al final del seguimiento, excepto uno con riesgo intermedio que presentó una respuesta inicial estructural incompleta e indeterminada posterior al vaciamiento ganglionar. La mediana del tiempo de diagnóstico del remanente del CTG luego de la tiroidectomía fue de 5 años (rango 1-16). Dos pacientes con remanentes del CTG fueron intervenidos quirúrgicamente, ambos presentaron tumoraciones de aparición súbita en región suprahioidea, 2.4 y 4 cm, detectados a los 9 y 16 años luego de la tiroidectomía, respectivamente. La prevalencia de esta condición parece ser poco frecuente. Sin embargo, la aparición de una masa quística en el seguimiento de un paciente con CDT puede ser confundido con enfermedad metastásica y generar ansiedad. El hallazgo de remanentes del CTG parecería no tener ningún impacto en la respuesta al tratamiento.
Palabras clave: remanentes del conducto tirogloso, quistes tiroglosos, cáncer diferenciado de tiroides, tiroidectomía total, riesgo de recurrencia
Abstract There are numerous reports of incidental findings of thyroglossal duct remnants (TGDR) after total thyroidectomy, but its implication on the outcome of patients with differentiated thyroid cancer (DTC) is unknown. The aim of this study was to determine the frequency of TGDR detected by ultrasonography after total thyroidectomy in patients with DTC and to evaluate the impact of this finding on the response to treatment. A total of 377 records of patients with DTC who received total thyroidectomy between January 1994 and January 2017 were reviewed. Patients with less than one year of follow-up after surgery were excluded. TGDR was diagnosed in 16 out of 377 (4.2%). Fifteen had a low risk of recurrence DTC and 13 of them were treated with radioactive iodine. All low risk patients had an excellent response to treatment. Only one with an intermediate risk of recurrence DTC had an initial structural incomplete response which changed to an indeterminate response after a modified central lymph node dissection. The median time of TGDR diagnosis after thyroidectomy was 5 years (1-16). Two patients underwent TGDR surgery due to the presence of a rapidly growing neck mass, 2.4 and 4 cm in size, detected 9 and 16 years after thyroidectomy, respectively. The prevalence of this condition seems to be rare. However, the appearance of a cystic mass during the follow-up of a patient with DTC cancer could be confused with metastatic disease. The diagnosis of TGDR seems not to have an impact on the response to treatment.
Key words: thyroglossal duct remnants, thyroglossal duct cysts, total thyroidectomy, differentiated thyroid cancer, risk of recurrence
Dirección postal: Fernando Jerkovich, Hospital de Clínicas José de San Martín, Av. Córdoba 2351, 1120 Buenos Aires, Argentina
e-mail: fernandojerkovich@hotmail.com
Los remanentes quísticos del conducto tirogloso (CTG) constituyen la causa más frecuente de masas detectadas en la línea media durante la niñez 1. En la población general, su incidencia es difícil de determinar dado que la mayoría de los casos son asintomáticos. En un estudio de prevalencia en adultos, el hallazgo ecográfico de quistes del CTG en un estudio de screening fue de 0.9% 2. No obstante, estudios de autopsias en adultos demostraron una prevalencia cercana al 7%3.
Por otro lado, las recurrencias ganglionares del cáncer diferenciado de tiroides (DTC) luego de la cirugía son un evento frecuente 4 y la ecografía cervical es el método de elección para su detección y caracterización 5.
A pesar de numerosos informes de hallazgo incidental de remanentes del CTG posteriores a la tiroidectomía total (TT)6, 7, no existe evidencia acerca de su prevalencia detectada por ecografía y se desconoce cuál es la implicancia clínica de este hallazgo en pacientes con CDT.
Nuestro objetivo fue determinar la frecuencia de detección ecográfica de remanentes quísticos del CTG posterior a la TT en pacientes con CDT y evaluar el impacto de este hallazgo en la respuesta al tratamiento.
Materiales y métodos
Se revisaron las historias clínicas de 377 pacientes consecutivos con CDT tratados con TT entre enero de 1994 y enero de 2017, con un seguimiento de al menos un año posterior a la cirugía. Ninguno tenía historia de cirugía o radiación de cuello previa.
Los pacientes fueron clasificados en riesgos de recurrencia (bajo, intermedio y alto) de acuerdo con los criterios propuestos por las guías de la Asociación Americana de Tiroides (ATA)8. Para la evaluación de la respuesta inicial y final al tratamiento se usaron las definiciones propuestas por esta misma guía (excelente, indeterminada, bioquímica incompleta y estructural incompleta)8. Para pacientes que no recibieron ablación con radioyodo, se utilizaron los criterios propuestos por Momesso y col.9.
En todos los que recibieron radioyodo se suspendió el tratamiento con levotiroxina por 3 semanas para obtener un valor de TSH mayor a 30 mUI/l. Asimismo, se prescribió una dieta baja en yodo como mínimo una semana previa a la dosis y se llevó a cabo un rastreo corporal total a los 5-7 días posteriores.
Luego de la ablación, se indicó terapia con levotiroxina para mantener el nivel de TSH de acuerdo al riesgo de recurrencia inicial y a las respuestas al tratamiento, siguiendo las recomendaciones de las guías de la ATA8.
Todos tenían ecografías preoperatorias sin evidencias de remanentes del CTG, realizadas por el mismo operador.
En la evaluación de las masas halladas por ecografía se consideró su localización en relación al hueso hioides y la línea media, tamaño, características de las paredes y márgenes, presencia o ausencia de loculación, ecogenicidad interna, realce posterior, tabiques internos y componente sólido. La presencia de quiste del conducto tirogloso fue definida como una masa de forma redondeada a ovoide, de baja ecogenicidad, con una cápsula brillante bien definida y realce acústico posterior 10. La evidencia ecográfica de pared externa engrosada, ecos internos, nodularidad interna y presencia de septos y calcificaciones dentro del quiste del conducto tirogloso fueron criterios para realizar punción aspirativa con el objeto de descartar malignidad 11. Las ecografías postoperatorias se realizaron a los 6-12 meses durante el primer año de seguimiento y luego cada 12-24 meses. En todos los casos, las ecografías fueron realizadas por el mismo operador durante todo el seguimiento (JEF).
Se utilizaron los equipos Toshiba Xario (entre 1994 y 2011) y Toshiba Aplio 400 (entre 2012 y 2017).
Los valores de tiroglobulina se midieron con método quimioluminiscente (ICMA Immulite 2000, Siemens) con una sensibilidad analítica de 0.2 ng/ml y una sensibilidad funcional de 0.9 ng/ml, y por método electroquimioluminiscente (ICMA) Elecsys 1010 (Roche) con una sensibilidad analítica de 0.04 ng/ml y sensibilidad funcional de 0.1 ng/ml. Los ensayos para medición de anticuerpos antitiroglobulina fueron el método electroquimioluminiscente Elecsys Anti-Tg (Roche) y el método quimioluminiscente Immulite 2000 Anti-TG Ab (Siemens). Para ambos ensayos, los valores > 20 UI/ml se consideraron positivos.
La investigación fue evaluada por el Comité de Ética. Los 16 pacientes con diagnóstico de quistes del CTG dieron su consentimiento para participar del estudio.
Resultados
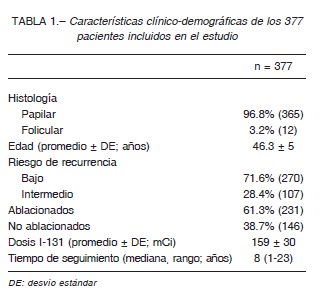
En la Tabla 1 se detallan las características clínicodemográficas de los 377 pacientes evaluados. Se detectó la presencia de remanente quístico del CTG en 16 (4.2%).
Las características clínicas, ecográficas y valores de tiroglobulina de estos casos pueden verse en la Tabla 2.
De los 16 pacientes con remanentes quísticos del CTG, 15 eran de bajo riesgo de recurrencia, de los cuales 13 fueron ablacionados con una dosis de 83 ± 48 mCi de 131I. Dos no recibieron ablación con radioyodo. Todos los sujetos con un CDT de bajo riesgo de recurrencia tuvieron un estado “sin evidencia de enfermedad” al final del seguimiento (mediana de seguimiento 8 años, rango 1-23). Un paciente con un riesgo intermedio de recurrencia presentó una repuesta inicial estructural incompleta ganglionar a los 12 meses y, posterior al vaciamiento ganglionar lateral, evolucionó con respuesta indeterminada al final del seguimiento (48 meses). En este, se detectó la presencia de una masa anecoica de 0.9 × 1 cm por ecografía 12 meses luego de la segunda cirugía. Ante la presencia de valores de tiroglobulina detectables (1.01 ng/ml) con anticuerpos antitiroglobulina negativos, se realizó una tomografía por emisión de positrones con 18F-fluorodesoxiglucosa que no mostró ninguna captación. La misma fue controlada con ecografías periódicas que no mostraron variaciones en su tamaño ni en sus características, por lo que la imagen fue interpretada como un quiste del CTG.
La mediana del tiempo al diagnóstico del remanente del CTG luego de la tiroidectomía fue de 5 años (rango 1-16) luego del tratamiento inicial.
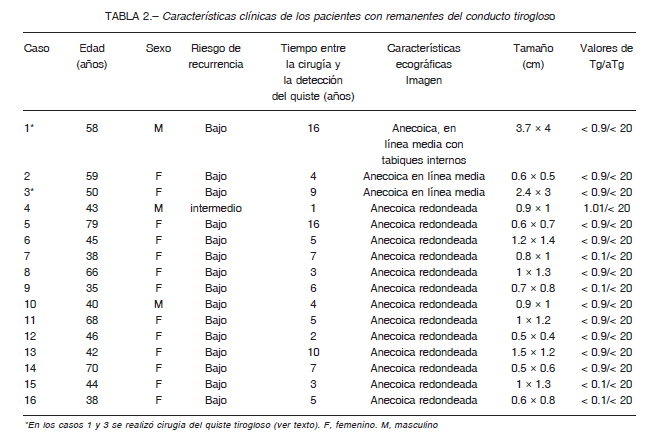
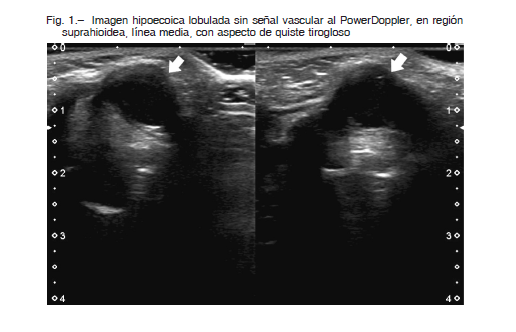
Dos remanentes del CTG en 2 pacientes diferentes se intervinieron quirúrgicamente. El primer caso se trató de un varón de 35 años de edad al diagnóstico de un carcinoma papilar de tiroides (T1bN0M0). Realizó tratamiento con TT y ablación con 100 mCi de 131I con rastreo corporal total post-dosis terapéutica que mostraba un resto captante en región paramediana izquierda. Seis meses después de la cirugía presentó una respuesta excelente que se mantuvo hasta el final del seguimiento. Dieciséis años y 3 meses posteriores a la cirugía, consultó por la aparición súbita de una tumoración en región suprahioidea de 4 cm de diámetro. La ecografía demostró la presencia de un área quística de 32 x 37 mm con tabiques internos y vascularización periférica en la línea media, ubicada entre el hueso hioides y el cartílago tiroides. Se hizo punción aspirativa de la misma con un resultado citológico benigno. Se indicó cirugía por el rápido crecimiento y preferencias del paciente. El informe histopatológico confirmó la presencia de un quiste tirogloso con ausencia de malignidad. Nueve años después de este episodio, mantiene una respuesta excelente al tratamiento. El segundo caso fue el de una mujer de 35 años de edad al diagnóstico del CDT que realizó TT y ablación con 100 mCi de 131I. El rastreo corporal total post-dosis mostró captación en línea media de cuello con una respuesta inicial excelente. A los nueve años de la tiroidectomía, se halló en el examen físico una tumoración en la región anterior de cuello. La ecografía (Fig. 1) mostró una imagen hipoecoica lobulada de 24 mm de diámetro mayor. Se realizó punción aspiración con aguja fina con extracción de 3 ml de líquido amarillento opaco con medición de tiroglobulina del material drenado que resultó ser de 4.90 ng/ml (anticuerpos antitiroglobulina negativos). La descripción microscópica informó histiocitos espumosos que alternaban con leucocitos y detritus en un fondo amorfo basófilo. Se realizó cirugía por preferencia del paciente. El informe anatomopatológico confirmó el diagnóstico de quiste tirogloso con ausencia de malignidad. Luego de 2 años de este episodio, continúa con una respuesta excelente.
Discusión
La glándula tiroides se desarrolla a partir del piso de la faringe primitiva durante la tercera semana de gestación, y emigra desde el foramen ciego en la base de la lengua por el CTG hasta alcanzar su posición definitiva en el cuello hacia la séptima semana 12. La falla en la obliteración de este conducto da lugar a quistes o tejidos tiroideos ectópicos 1
Los remanentes quísticos del CTG representan más del 75% de las masas detectadas en la línea media durante la infancia 12-14. De hecho, la gran mayoría de los quistes del CTG se reconocen antes de los 5 años y 60% son diagnosticados antes de los 20 años 14. La prevalencia en estudios de autopsias en una población pediátrica alcanzó el 41.8%15, y en adultos se informó cercana al 7% 3, lo que demuestra que muchos de los casos de remanentes del CTG son asintomáticos y probablemente nunca diagnosticados.
El cáncer diferenciado de tiroides es la neoplasia endocrina más frecuente 16. La TT seguida de ablación con radioyodo constituyó durante muchos años el pilar del tratamiento inicial. En los últimos años, una adecuada estratificación de los pacientes en riesgos de recurrencia permitió modificar el tratamiento convencional hacia uno más conservador (tiroidectomía total sin ablación con radioyodo o lobectomía) en la gran mayoría de pacientes de riesgo bajo o intermedio 8.
A diferencia de los que conservan la glándula tiroides, en los tiroidectomizados los remanentes del CTG pueden hacerse evidentes debido a la estimulación de la TSH como consecuencia del hipotiroidismo posquirúrgico o por una exhaustiva búsqueda ecográfica de la región cervical en búsqueda de adenopatías sospechosas6. De hecho, los quistes del CTG son raramente identificados en los centellogramas tiroideos dada la presencia de insuficiente tejido funcionante lo cual se hace evidente luego de la cirugía de tiroides 17. En un estudio de 133 pacientes consecutivos que realizaron TT por CDT y ablación con radioyodo con suspensión de levotiroxina por seis semanas, se detectó captación en línea media sugestiva de remanente del CTG en 33.6% de los casos 6. No obstante, dos de nuestros pacientes con remanentes quísticos del CTG no recibieron radioyodo luego de la TT. Nelson y col. 7 describieron el caso de una mujer que presentó un quiste del CTG con hiperplasia glandular compensatoria, 14 meses posteriores a una TT por un microcarcinoma papilar de tiroides, sin uso de ablación con radioyodo. Al igual que en nuestros pacientes no ablacionados, en este caso se mantuvo terapia de reemplazo con levotiroxina sin requerimientos de rastreos diagnósticos o estimulación de los valores de tiroglobulina, lo que sugiere que el estímulo de la TSH no explicaría por completo el crecimiento del tejido tiroideo remanente.
Por otro lado, Srinivasan y col. comunicaron el caso de una paciente que presentó un quiste del CTG 18 meses luego de realizar radioterapia externa en cuello por un carcinoma escamoso de cuello 18. La hipótesis de los autores fue que la inflamación local repetida provocada por la radioterapia podría haber causado edema de un remanente del CTG oculto. En este mismo sentido, la cirugía de tiroides podría representar una injuria similar en este tejido remanente. Al igual que en nuestro trabajo, los estudios por imágenes previos no demostraron la presencia del quiste, lo que sugiere una relación causal con el evento (radiación e injuria quirúrgica)18.
Más de la mitad de los pacientes con cáncer diferenciado de tiroides presentan metástasis ganglionares19.
Aproximadamente el 40% de las metástasis ganglionares del carcinoma papilar de tiroides tienen tendencia a producir cavitación del ganglio linfático por degeneración quística y estas lesiones pueden confundirse con lesiones quísticas benignas como los remanentes del CTG 19. Los ganglios linfáticos metastásicos quísticos suelen ser distinguidos de los quistes del CTG por la presencia de pared externa engrosada, ecos internos, nodularidad interna y presencia de septos 11. Sin embargo, en hasta un 6% de los casos, sobre todo en jóvenes, los ganglios metastásicos pueden ser puramente quísticos 20. Esto es importante en aquellos con antecedentes de CDT que se encuentran en seguimiento ecográfico, donde el hallazgo de una masa quística puede generar dudas diagnósticas en el equipo médico y ansiedad en el paciente. En este contexto, es importante considerar el riesgo de recurrencia inicial, las características ecográficas de la lesión, la localización de las mismas y la determinación de tiroglobulina sérica en el seguimiento 8. En el caso de alto riesgo de recurrencia inicial, las características ecográficas sospechosas de malignidad de la imagen quística 11 o si la aparición coincide con valores de tiroglobulina crecientes o que se hacen detectables en el tiempo, una punción aspirativa con aguja fina sería de gran ayuda para descartar la presencia de una recurrencia local 8, 21. Hay que considerar que los pacientes con bajo riesgo de recurrencia que presentan tiroglobulina indetectable durante el seguimiento tienen un riesgo de recurrencia de solo 1-4% 8 y el uso sistemático de la ecografía permitiría detectar más falsos positivos que recurrencias locales clínicamente significativas 22.
En nuestra cohorte, 15 de los 16 pacientes a los se les detectó quistes del CTG, eran de bajo riesgo de recurrencia y presentaron tiroglobulinas indetectables durante el seguimiento. En un paciente de riesgo intermedio, la imagen compatible con quiste del CTG, sin características sospechosas, se hizo evidente 12 meses después de una reintervención quirúrgica por recurrencia ganglionar. Se realizó tomografía por emisión de positrones con 18F fluorodesoxiglucosa que no mostró hallazgos patológicos y la imagen se controló evolutivamente sin cambios en el tamaño. Tampoco se registraron amentos en los valores de tiroglobulina sérica.
Por otra parte, la presencia de un carcinoma papilar de tiroides en un quiste de CTG es una complicación muy rara que se describe en el 1% de todos los quistes 23. Ningún paciente de nuestra serie con remanentes del CTG tuvo evidencias de malignidad.
En el estudio de Lee y col.6, no hubo diferencias significativas en los valores de tiroglobulina o en el porcentaje de rastreos corporales totales diagnósticos negativos al año de la ablación entre pacientes con y sin remanentes del CTG detectados por centellografía con 131I6. En nuestro estudio, analizando las respuestas al tratamiento inicial validadas para pacientes con CDT 8, 9, 15 de los 16 en los que se detectó un remanente quístico del CTG posterior a la TT tuvieron una respuesta excelente al tratamiento.
Solo uno presentó persistencia ganglionar al año de la tiroidectomía y luego del vaciamiento ganglionar persistió con una respuesta indeterminada. Esto es similar a lo que ocurre en aquellos con bajo riesgo y riesgo intermedio de recurrencia 8, 9. En una cohorte de pacientes del Hospital de Clínicas de la Universidad de Buenos Aires, la frecuencia de respuesta estructural incompleta inicial fue de 10% para los de bajo riesgo de recurrencia y de 29% para los de riesgo intermedio 24. Esto sugiere que la aparición de un remanente del CTG posterior a la TT por CDT no tendría ningún impacto en la respuesta al tratamiento.
Como conclusión, la prevalencia de remanentes del CTG detectados en ecografías posteriores a la TT por CDT, es un hecho poco frecuente. Sin embargo, es importante tenerlo en cuenta como diagnóstico diferencial de una metástasis ganglionar ante la presencia de una masa quística de ubicación en la línea media del cuello.
Por otro lado, este hallazgo parecería no tener ningún efecto en la respuesta al tratamiento.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Dedivitis RA, Camargo DL, Peixoto GL, Weissman L, Guimarães AV. Thyroglossal duct: a review of 55 cases. J Am Coll Surg 2002; 194: 274-7.
2. Kim SC, Sun HY, Kim HS, Ryoo I. Long-term ultrasound follow-up of incidentally detected thyroglossal duct cysts in adults. Am J Neuroradiol 2018; 39: 2356-59.
3. Kurt A, Ortug C, Aydar Y, Ortug G. An incidence study on thyroglossal duct cysts in adults. Saudi Med J 2007; 28: 593-7.
4. Tomoda C, Sugino K, Matsuzu K, et al. Cervical lymph node metastases after thyroidectomy for papillary thyroid carcinoma usually remain stable for years. Thyroid 2016; 26: 1706-11.
5. King AD, Ahuja AT, To EW, Tse GM, Metreweli C. Staging papillary carcinoma of the thyroid: magnetic resonance imaging vs ultrasound of the neck. Clin Radiol 2000; 55: 222-6.
6. Lee SW, Lee J, Lee HJ, et al. Enhanced scintigraphic visualization of thyroglossal duct remnant during hypothyroidism after total thyroidectomy: prevalence and clinical implication in patients with differentiated thyroid cancer. Thyroid 2007; 17: 341-6.
7. Nelson RE, Ahmad H, Hildrew DM, et al. Thyroglossal duct remnant with follicular hyperplasia presenting after total thyroidectomy. Ochsner J 2016; 16: 154-7.
8. Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association Guidelines Task Force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016; 26: 1-133.
9. Momesso DP, Vaisman F, Yang SP, et al. Dynamic risk stratification in patients with differentiated thyroid cancer treated without radioactive iodine. J Clin Endocrinol Metab 2016; 101: 2692-700.
10. Baatenburg de Jong RJ, Rongen RJ, Laméris JS, Knegt P, Verwoerd CD. Ultrasound characteristics of thyroglossal duct anomalies. ORL J Otorhinolaryngol Relat Spec 1993; 55: 299-302.
11. Patel S, Bhatt AA. Thyroglossal duct pathology and mimics. Insights Imaging 2019; 10: 12.
12. Shahin A, Burroughs FH, Kirby JP, Ali SZ. Thyroglossal duct cyst: a cytopathologic study of 26 cases. Diagn Cytopathol 2005; 33: 365-9.
13. Mohan PS, Chokshi RA, Moser RL, Razvi SA. Thyroglossal duct cysts: a consideration in adults. Am Surg 2005; 71: 508-11.
14. Lin ST, Tseng FY, Hsu CJ, Yeh TH, Chen YS. Thyroglossal duct cyst: a comparison between children and adults. Am J Otolaryngol 2008; 29: 83-7.
15. Sprinzl GM, Koebke J, Wimmers-Klick J, Eckel HE, Thumfart WF. Morphology of the human thyroglossal tract: a histologic and macroscopic study in infants and children. Ann Otol Rhinol Laryngol 2000; 109: 1135-9.
16. Kitahara CM, Sosa JA. The changing incidence of thyroid cancer. Nat Rev Endocrinol 2016; 12: 646-53.
17. Heyman S. The scintigraphic visualization of a lingual thyroid after excision of associated ectopic thyroid tissue. Clin Nucl Med 1979; 4: 275-6.
18. Srinivasan A, Hayes M, Chepeha D, Mukherji SK. Rare presentation of thyroglossal duct cyst after radiation therapy to the neck. Australas Radiol 2007; 51: B180-2.
19. Grebe SK, Hay ID. Thyroid cancer nodal metastases: biologic significance and therapeutic considerations. Surg Oncol Clin N Am 1996; 5: 43-63.
20. Wunderbaldinger P, Harisinghani MG, Hahn PF, et al. Cystic lymph node metastases in papillary thyroid carcinoma. AJR Am J Roentgenol 2002; 178: 693-7.
21. Chandanwale SS, Buch AC, Chawla KR, Mittal PU. Fine needle aspiration cytology of thyroglossal duct cyst: Diagnostic pitfalls and a study of 14 cases. Thyroid Res Pract 2013; 10: 104-7.
22. Yang SP, Bach AM, Tuttle RM, Fish SA. Serial neck ultrasound is more likely to identify false-positive abnormalities than clinically significant disease in low-risk papillary thyroid cancer patients. Endocr Pract 2015; 21: 1372-9.
23. Alatsakis M, Drogouti M, Tsompanidou C, Katsourakis A, Chatzis I. Invasive thyroglossal duct cyst papillary carcinoma: a case report and review of the literature. Am J Case Rep 2018; 19: 757-62.
24. Pitoia, F, Schmidt A. La respuesta excelente al tratamiento en pacientes con cáncer diferenciado de tiroides se mantiene a lo largo del seguimiento independientemente del riesgo de recurrencia inicial. Rev Argent Endocrinol Metab 2019; 56: 11-6.
– – – –
A pesar de algunos lunares, de unas poquísimas preocupaciones de casta, que aparecen excepcionalmente en las manifestaciones de su sentimiento nacional, y que tienen heredadas, a veces de grupos exclusivistas de gallegos rancios, a veces de tribus indias hundidas todavía en el período pre-feudal, la República Argentina es seria y esencialmente organizada a la moderna. Tiene alma democrática. En esto reside su principal mérito y el secreto de su prodigiosa vitalidad.
Alfredo Ebelot* (1839-1920)
La Pampa (1889). Buenos Aires; Eudeba, 1961. Como se forman las aristocracias; p 101
* Ingeniero, escritor y periodista francés, llegó Buenos Aires en 1870, participó en la construcción de la “zanja de Alsina” y luego en la conquista del desierto, regresó a Francia en 1908.
