HORACIO M. CASTRO 1, 2, HERNAN L. CANALE 1, 2, BRUNO L. FERREYRO 3, 4, MANUEL A. PRIETO 2, BRENDA E. MASSIMINO 1, 2, GABRIEL FUNTOWICZ 2, JOAQUÍN MARITANO FURCADA 1
1 Sección de Neumonología, Hospital Italiano de Buenos Aires, Buenos Aires, Argentina, 2 Central de Emergencias de Adultos, Hospital Italiano de San Justo Agustín Rocca, Buenos Aires, Argentina, 3 Interdepartmental Division of Critical Care Medicine, University of Toronto, Toronto, Ontario, Canada, 4 Departament of Medicine, Sinai Health System and University Health Network, Toronto, Canada
Resumen La enfermedad por coronavirus (COVID-19) es un problema prioritario de salud. El objetivo del trabajo fue evaluar las características clínicas, evolución y gravedad de COVID-19 en un centro hospitalario de tercer nivel de la provincia de Buenos Aires, Argentina. Se realizó un estudio de cohorte retrospectiva de pacientes con COVID-19, entre el 3 de marzo y 21 de junio de 2020. Se evaluaron las características en función de la presencia o ausencia de neumonía y de la gravedad de la enfermedad. Se incluyeron 101 pacientes, la mediana de edad fue de 42 años y el 53% mujeres. Los síntomas más frecuentes fueron: fiebre 66% y tos 57%. La disnea y la fiebre se asociaron a la presencia de neumonía. Las comorbilidades más prevalentes fueron: hipertensión 22%, obesidad 18%, enfermedad cardiovascular 7% y enfermedad respiratoria crónica 7%. Los hallazgos de laboratorio más comunes fueron: linfopenia 55%, dímero-D elevado 38% y plaquetopenia 20%. El 26% presentó neumonía y el 24% fue personal de salud. En el 24% de los casos se necesitó más de una muestra de RT-PCR para el diagnóstico. Un valor moderado-alto del Índice de severidad de neumonía (PSI) fue más frecuente en la neumonía grave que en la leve (63 contra 17%, p 0.032). Se registró una mortalidad del 5%. Las características clínicas, la gravedad y evolución fueron similares a las descritas a nivel mundial. Destacamos la proporción elevada del personal de salud infectado, la tasa de falsos negativos de la RT-PCR y la utilidad del PSI para discriminar la gravedad de la neumonía.
Palabras clave: COVID-19, SARS-CoV-2, infecciones por coronavirus, signos y síntomas, neumonía
Abstract Coronavirus disease (COVID-19) became a priority health problem. The objective was to evaluate the clinical characteristics, evolution and severity of COVID-19 in a third-level hospital, in the province of Buenos Aires, Argentina. We conducted a retrospective cohort of 101 patients with COVID-19 from March 3 to June 21, 2020. The patients were divided according to the presence or absence of pneumonia and the severity of the disease. The median age was 42 years and 53% were women. The most common symptoms were fever 66% and cough 57%. Dyspnea and fever were associated with the presence of pneumonia. The most prevalent comorbidities were: hypertension 22%, obesity 18%, cardiovascular disease 7% and chronic respiratory disease 7%. The presence of any comorbidity and hypertension were more common in severe cases. The most frequent laboratory findings were: lymphopenia 55%, elevated D-dimer 38%, and thrombocytopenia 20%. In severe diseases, the level of C-reactive protein and D-dimer were higher. Twenty six patients had pneumonia and 24% were healthcare workers. For diagnosis, more than one reverse transcriptase polymerase chain reaction (RT-PCR) sample was needed in 24% of cases. A moderate-high value of the Pneumonia Severity Index (PSI) was more prevalent in severe than mild pneumonia (63% vs. 17%, p 0.032). A mortality of 5% was registered (95% CI 1-11%). The clinical characteristics, severity and prognosis were similar to those described worldwide. We highlight a high proportion of healthcare workers were SARS-CoV-2 positive, the false negative rate of the RT-PCR and the usefulness of the PSI to discriminate the severity of pneumonia.
Key words: COVID-19, SARS-CoV-2, coronavirus infections, sign and symptoms, pneumonia
Dirección postal: Horacio M. Castro, Sección de Neumonología, Hospital Italiano de Buenos Aires, Tte. Gral. Juan D. Perón 4190, 1199 Buenos Aires, Argentina
e-mail: matias.castro@hospitalitaliano.org.ar
Conocimiento actual
• Los síntomas más frecuentes de COVID-19 son fiebre, tos y disnea.
• El laboratorio suele informar linfopenia, elevación de parámetros inflamatorios y trastornos de la coagulación.
• La sensibilidad diagnóstica de la RT-PCR oscila entre 60-96%.
• La mayoría de los pacientes con COVID-19 presentan un cuadro leve, con baja mortalidad y se recuperan.
Contribución del artículo al conocimiento actual
• Las manifestaciones clínicas y pronóstico fueron similares a los descritos a nivel mundial.
• La tasa de falsos negativos de la primera muestra de RT-PCR en nuestra cohorte fue del 24%.
• La proporción de personal de salud afectado fue elevada (24%).
• La mortalidad en este estudio de la provincia de Buenos Aires fue del 5%.
En diciembre de 2019 se informó un brote de neumonía por un nuevo tipo de coronavirus en la ciudad de Wuhan de la provincia de Hubei, China 1. El agente etiológico fue nombrado coronavirus-2 del síndrome respiratorio agudo grave (SARS-CoV-2)2. La enfermedad por coronavirus 2019 (COVID-19) se extendió rápidamente a nivel mundial y el 11 de marzo la Organización Mundial de la Salud (OMS) la declaró pandemia3. El 3 de marzo de 2020 se confirmó el primer caso de COVID-19 en Argentina4.
El cuadro clínico puede oscilar desde síntomas respiratorios leves a la insuficiencia respiratoria5. Se describieron manifestaciones pulmonares y extrapulmonares6, 7. Además, se han reconocido múltiples factores de riesgo de enfermedad grave8-10. Las características demográficas, clínicas y pronósticas de los pacientes con COVID-19 pueden diferir en los diferentes países, regiones y ciudades.
En la Argentina, se han publicado reportes, series de casos con un tamaño muestral pequeño11-15 y un estudio de vigilancia epidemiológica16.
El objetivo de este trabajo fue evaluar las características clínicas, gravedad y evolución de la infección por SARS-CoV-2 en un centro de tercer nivel de la provincia de Buenos Aires, Argentina.
Materiales y métodos
Se realizó un estudio de cohorte retrospectivo que incluyó pacientes adultos con diagnóstico de COVID-19 entre el 3 de marzo y el 21 de junio de 2020, con seguimiento hasta el 21 de julio de 2020. Se definió como caso de COVID-19 a aquellos con una reacción en cadena de la polimerasa con transcriptasa reversa (RT-PCR) positiva para SARS-CoV-2 en hisopado (nasofaríngeo u orofaríngeo) o muestra respiratoria de la vía aérea inferior (esputo, aspirado traqueal o lavado broncoalveolar) en concordancia con las guías de la OMS17.
Para realizar las RT-PCR se utilizó el kit comercial Bosphore novel coronavirus (2019-nCov) Detection Kit V2 de Anatolia Geneworks Bioar. El estudio fue realizado en un único centro de la provincia de Buenos Aires, el Hospital Italiano de San Justo Agustín Rocca.
Se utilizó la historia clínica electrónica hospitalaria para registrar las características clínico-demográficas, de laboratorio, radiológicas, el tratamiento recibido, las complicaciones y la evolución clínica. Además, se obtuvieron los datos del ingreso hospitalario (síntomas, signos vitales y comorbilidades) en base al registro institucional prospectivo de pacientes con COVID-19. Sumado a esto, se registraron los datos epidemiológicos en una ficha estandarizada por el médico tratante durante la evaluación inicial siguiendo las recomendaciones del Ministerio de Salud de la Nación18.
Los estudios complementarios solicitados fueron acordes a los estándares de cuidado y según criterio médico. Las imágenes radiológicas y tomográficas fueron descritas por neumonólogos. La información recolectada fue evaluada por dos investigadores en forma independiente para asegurar la validez de los datos. Los pacientes se siguieron hasta el alta, la muerte o hasta cuatro semanas de finalizado el reclutamiento.
El protocolo del estudio fue aprobado por el comité de ética institucional del Hospital Italiano de Buenos Aires y se realizó acorde a la guía de buenas prácticas clínicas.
Dadas las características retrospectivas del estudio, no se realizó toma de consentimiento informado. Todos los datos del estudio fueron tratados con máxima confidencialidad de manera anónima.
Se definió el grado de gravedad acorde a la guía de manejo de pacientes con COVID de National Institutes of Health (NIH)19, de la siguiente manera: -Asintomática: test positivo SARS-CoV-2 en ausencia de síntomas. -Leve: presencia de síntomas pero en ausencia de disnea e imágenes torácicas anormales. -Moderada: neumonía con una saturación periférica de oxígeno al aire ambiente (SpO2) ≥ 94%. -Grave: neumonía con SpO2 < 94%, frecuencia respiratoria por minuto > 30 y/o PAFI < 300 mmHg. – Crítica: al menos uno de las siguientes, insuficiencia respiratoria con necesidad de ventilación mecánica, shock séptico y/o falla multiorgánica.
El diagnóstico de neumonía se definió con la presencia de síntomas respiratorios o fiebre asociado a una opacidad en la radiografía o tomografía de tórax. Se evaluó el grado de gravedad con los datos del ingreso (obtenidos dentro de las 48 horas de la admisión hospitalaria o consulta a la central de emergencias) y de acuerdo a la evolución clínica. Además se clasificó la gravedad de la neumonía en leve (correspondiente a la categoría moderada) y grave (correspondiente a la categoría grave y crítica). Se consideró paciente recuperado aquel que resolvió la fiebre, presentó mejoría de los síntomas respiratorios y pasó más de 10 días de iniciado los síntomas20.
Se describieron las variables numéricas como media y desvío estándar o mediana y rango intercuartil (RIC), según la distribución observada. Las variables categóricas se describieron como frecuencia absoluta y relativa. Para el análisis, se dividieron a los pacientes según la presencia o ausencia de neumonía y la gravedad de la misma (leve o grave). Se compararon entre los grupos las variables categóricas con Test de Chi cuadrado y Fisher y las variables cuantitativas con T-Test o Mann Whitney según correspondiera.
Se presentaron las proporciones con su intervalo de confianza del 95%. Todos los test se realizaron a dos colas y se consideró un valor de p inferior a 0.05 como estadísticamente significativo. Se utilizó para el análisis estadístico el software Stata versión 13.
Resultados
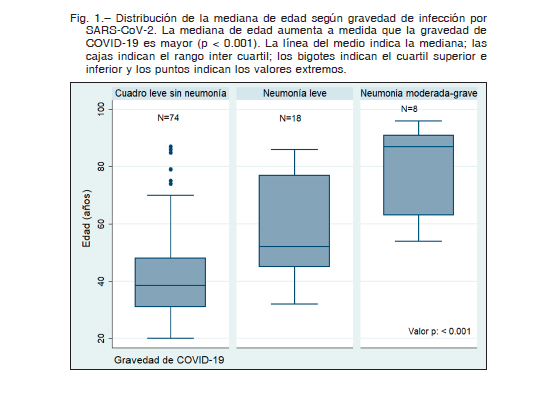
Se incluyeron en el estudio 101 pacientes con diagnóstico de SARS-CoV-2. Se resumen las características clínicodemográficas de la muestra agrupadas según la presencia de neumonía en la Tabla 1. La mayoría fueron mujeres (53%) siendo el porcentaje de hombres más elevado en aquellos que presentaron neumonía (62%). Cuatro mujeres estaban embarazadas. La mediana de edad fue de 42 años con un RIC de 33-59, siendo mayor en aquellos que tuvieron neumonía, con una mediana de 67 años. A mayor gravedad de COVID-19, mayor fue la mediana de edad (Fig. 1). Al ingreso, los casos fueron clasificados como: asintomáticos 1% (IC 95% 0.03-5%), leves 73% (IC 95% 64-82%), moderados 22% (IC 95% 14-31%), graves 2% (IC 95% 0.2-7%) y críticos 2% (IC 95% 0.2-7%).
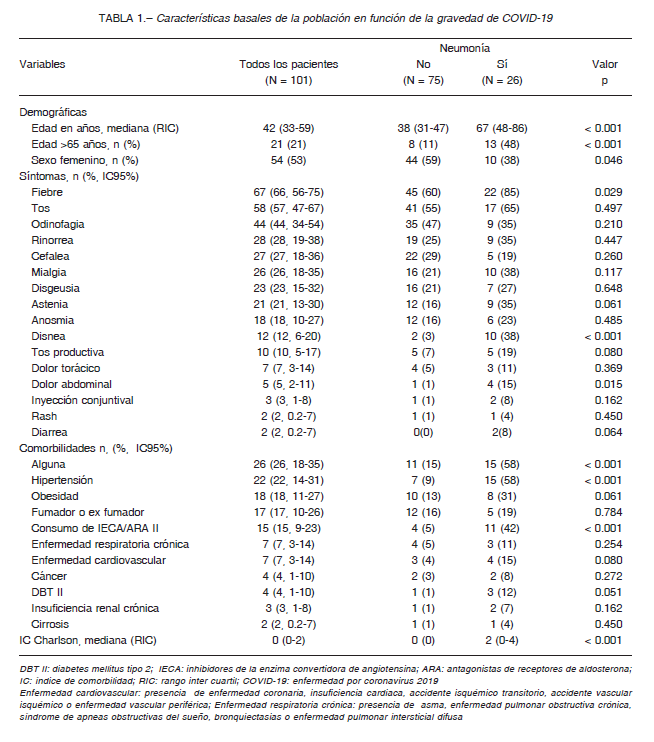
Los síntomas más frecuentes fueron: fiebre 66%, tos 57% y odinofagia 44%. El porcentaje de pacientes con fiebre, disnea y dolor abdominal fue significativamente mayor en el grupo que presentó neumonía que en aquellos sin neumonía, 85 contra 60% (p 0.029), 38 contra 3% (p < 0.001) y 15 contra 1% (p 0.015), respectivamente.
Los síntomas respiratorios fueron los más comunes, pero se encontraron síntomas musculoesqueléticos 46% (cefalea, astenia o mialgias), gastrointestinales 6% (vómitos, diarrea o dolor abdominal) y mucocutáneos 4% (rash o inyección conjuntival) (Tabla 1). La mediana de tiempo desde el inicio de síntomas al diagnóstico con RT-PCR fue de 2 días con un RIC de 2.
Casi un cuarto de los sujetos presentó alguna comorbilidad.
Las comorbilidades más frecuentes fueron: hipertensión 22%, obesidad 18%, enfermedad cardiovascular 7% y enfermedad respiratoria crónica 7%. Al comparar el grupo con neumonía respecto de aquellos sin neumonía: el índice de comorbilidad de Charlson fue mayor (2 contra 0, p < 0.001), hubo más hipertensos (58% contra 9%, p < 0.001) y se mostró una tendencia a una mayor proporción de obesidad (31% contra 13%, p 0.061), enfermedad cardiovascular (15% contra 4%, p 0.080) y diabetes (12% contra 1%, p 0.051). Solo un sexto de la muestra tenía antecedentes de tabaquismo activo o previo.
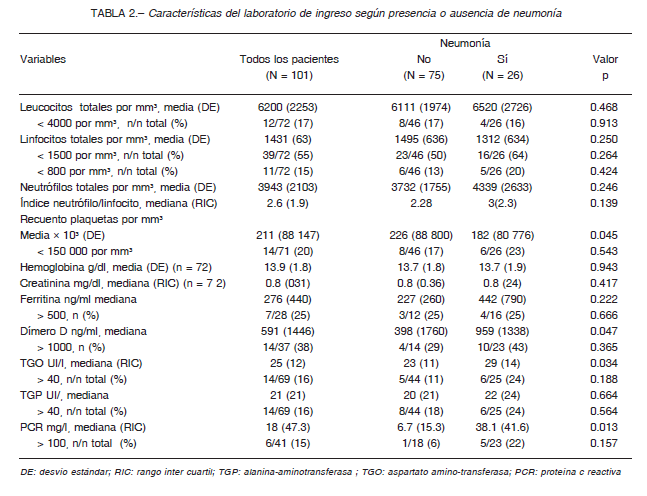
En los análisis de laboratorio de ingreso se encontró linfopenia en más de la mitad de los casos, mientras que la plaquetopenia y leucopenia estuvieron presentes en alrededor de un sexto de los sujetos. La neumonía se asoció a menores niveles de plaquetas y mayores niveles de PCR y dímero-D. En la Tabla 2 se resumen las características del laboratorio de acuerdo con la presencia o ausencia de neumonía.
Todos los pacientes contaron con una RT-PCR positiva para SARS-CoV-2, pero ésta fue positiva en: la primera muestra de hisopado nasofaríngeo en el 76% de los casos (IC 95% 67-84%, n = 77), en el segundo hisopado en el 23% de los casos (IC 95% 15-32%, n = 22) y, en una segunda muestra respiratoria baja (esputo) en el 1% (n = 1). De los 24 que presentaron una primera muestra negativa 17 consultaron dentro de las 72 horas de iniciado los síntomas y 16 tuvieron un COVID-19 leve.
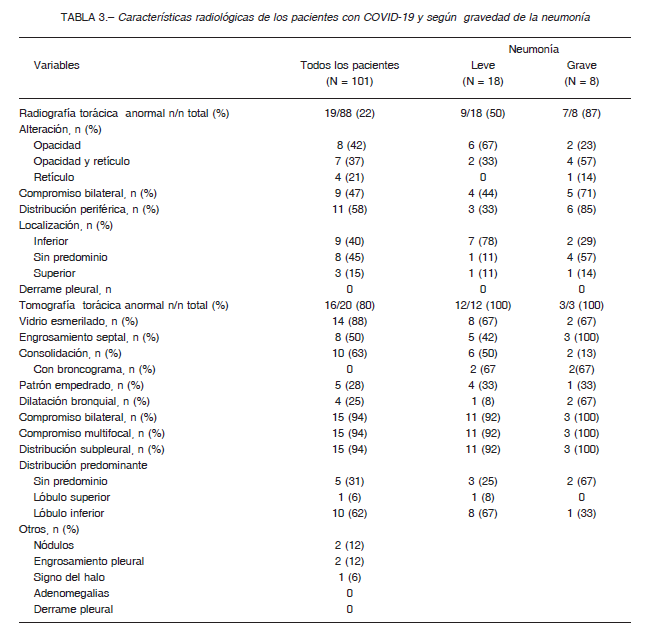
Los hallazgos radiológicos al ingreso y según la gravedad de la neumonía se resumen en la Tabla 3. A 88 se les realizó una radiografía de tórax, siendo la sensibilidad diagnóstica para neumonía del 22% (IC 95% 14-31%).
En 20 casos se obtuvo una tomografía computarizada de tórax, con una sensibilidad diagnóstica para SARS-CoV-2 del 80% (IC 95% 56-94%), las 4 tomografías negativas fueron realizadas al inicio de los síntomas (dentro de las 72 horas). El patrón tomográfico más frecuente fue opacidades en vidrio esmerilado (80%), la consolidación (63%) y el engrosamiento septal (50%). En la mayoría el compromiso fue bilateral (94%), subpleural (94%), multifocal (94%) y con predominio de lóbulos inferiores (62%).
Las vías de contagio más probables fueron: contacto con caso sospechoso o confirmado de COVID-19 (41%, IC 95% 31-51%), transmisión comunitaria (38%, IC95% 28-48%), personal de salud (21%, IC 95% 13-30%) y casos importados (1%, IC 95% 0.03-5%). El 24% fue personal de salud, de los cuales la mayoría tuvo contacto con pacientes con COVID-19 (88%, 21/24). El 54% eran enfermeros, el 13% médicos, el 13% técnicos radiológicos, el 13% administrativos y el 8% se desempeñaba en otras tareas. Ninguno presentó un cuadro de gravedad.
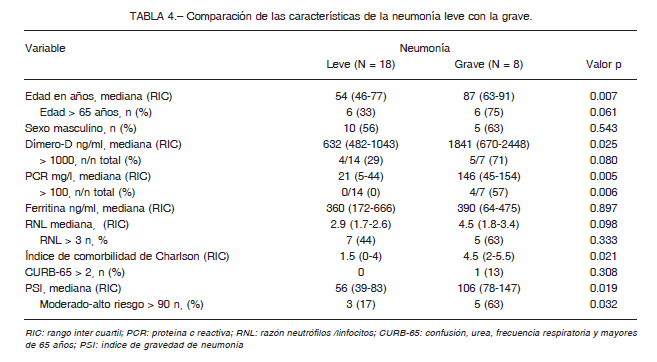
El 68% de los pacientes requirió internación. Inicialmente, acorde con las normativas del Ministerio de Salud de la República Argentina, todos fueron internados independientemente del grado de gravedad, pero, posteriormente, solo se internaron aquellos con comorbilidades o con cuadros graves. Más de un cuarto de los sujetos presentó neumonía al ingreso. En la Tabla 4 se describen las características de los pacientes de acuerdo al grado de gravedad de la neumonía. Aquellos con neumonías graves presentaron mayor edad, índice de comorbilidad de Charlson, niveles de dímero-D, PCR e índice de severidad de la neumonía (Pneumonia severity Index, PSI).
El 87% de las neumonías graves presentó un CURB-65 menor a 2. Solamente el 5% de los casos requirió internación en unidad de cuidados intensivos (UCI), con una mediana de internación de 9 días (RIC 6-10). Seis tuvieron insuficiencia renal aguda, 5 necesitaron oxigenoterapia suplementaria y tres requirieron ventilación mecánica con una mediana de 10 días de ventilación (RIC 4-30) y una mortalidad del 67% (n = 2/3).
Los tratamientos recibidos por orden de frecuencia fueron: antibióticos 28%, azitromicina 18%, corticoides sistémicos 6%, ritonavir/lopinavir 2%, plasma de convaleciente 2% y ninguno recibió hidroxicloroquina. La mayoría de los pacientes que recibieron estas terapias presentaron neumonía o cuadros severos. No se registraron efectos adversos asociados a los mismos. De los seis que recibieron corticoides, todos presentaron neumonía (3 graves) y 2 fallecieron. La mortalidad fue del 5% (n = 5, IC95% 1-11%), todos en mayores de 85 años de edad.
Al final del seguimiento se observó la siguiente distribución: asintomáticos 1% (IC 95% 0.03-5%), leves 73% (IC 95% 60-81%), moderados 19% (IC 95% 12-23%), graves 3% (IC 95% 1-8%) y críticos 5% (IC 95% 1-11%). Hasta el seguimiento del estudio, el 94% se había recuperado (n = 95, IC 95% 86-97%), el 1% permanecía internado en UCI (n = 1) y el 5% había fallecido (n = 5).
Discusión
Este estudio resume las características clínicas, radiológicas, de laboratorio, tratamiento, complicaciones y evolución de los pacientes con COVID-19 en un Hospital Universitario de Argentina.
Las comorbilidades de la población fueron conforme a lo comunicado previamente21 y al estudio de mayores dimensiones (116 974 casos) publicado en la Argentina16, tanto en ambos estudios como en el nuestro la hipertensión arterial fue la comorbilidad más común. La sintomatología de presentación fue similar a la de una revisión sistemática de 148 estudios realizados en 9 paises6 y a la informada en estudios nacionales12, 15, 16, siendo la fiebre y la tos los síntomas más frecuentes.
La mediana de edad fue comparable a la descrita en series de pacientes con COVID-19 a nivel mundial (46-59 años)1, 9, 22 y local (37-39 años)15, 16. La menor mediana de edad observable en nuestro estudio (42 años) y a nivel nacional puede deberse al criterio amplio de internación aplicado al momento del estudio, a un menor contagio en pacientes mayores debido al aislamiento social, a la menor edad poblacional o a características propias de la muestra. Los resultados de laboratorio descritos son acordes a los informados por una revisión sistemática de 19 estudios23. Tanto en nuestro estudio como en otros, las anormalidades más extremas del laboratorio se han asociado a una mayor gravedad clínica24. El tiempo desde el inicio de los síntomas a la consulta, en nuestro estudio fue menor que el descrito en la mayor parte de los estudios en China25. Estas diferencias pueden estar relacionadas al acceso a salud, actitud frente al COVID-19 del sistema de salud o a mayor conocimiento de la enfermedad.
En concordancia con nuestros resultados la edad, la disnea, la fiebre, la presencia de alguna comorbilidad y la hipertensión arterial se han asociado a cuadros más graves10, 26, 27. Pero a diferencia de otros estudios28, 29, la enfermedad cardiovascular, la enfermedad respiratoria crónica, la obesidad, la diabetes, la tos productiva, el índice neutrófilo/linfocitico y el aumento de ferritina no se asociaron a mayor gravedad. Esto puede deberse a la falta de poder de nuestro estudio para estos hallazgos debido al número limitado de pacientes.
Se estima que la sensibilidad de la RT-PCR para detectar SARS-CoV-2 oscila entre 60-96%30, 31. Nuestros resultados (76%) son más cercanos al valor inferior de dicho rango, pudiendo estar subestimado al solo buscarse una segunda muestra en casos de alta sospecha clínica o de persistencia de los síntomas. Los falsos negativos (24%) fueron más frecuentes en los casos leves y con periodo corto desde el inicio de los síntomas, variables que influyen en la sensibilidad diagnóstica32 y han sido asociadas a una carga viral baja33.
La TC de Tórax ha demostrado tener una sensibilidad alta para el diagnóstico de SARS-CoV-234. En nuestro estudio presentó una sensibilidad del 80%, siendo negativa en los que consultaron precozmente, lo que es una causa conocida de falsos negativos35. El patrón tomográfico característico de vidrio esmerilado, bilateral, periférico, en lóbulos inferiores previamente descrito36, fue el más frecuente. Al igual que en estudios previos37,38, la radiografía demostró un rol limitado en el diagnóstico con una baja sensibilidad.
La proporción de casos en trabajadores de la salud fue del 24%, similar a lo descrito por Pulido L. y col.15, en un centro de la Ciudad Autónoma de Buenos Aires, pero mayor que el Reino Unido (15.4%)39, el 10% informado en una revisión sistemática que incluyó estudios de China, Italia y EE.UU.40, los datos oficiales de la provincia de Buenos Aires (7%, datos disponibles al 1/08/2020)41, y un estudio de vigilancia epidemiológica a nivel nacional (7.6%)16. Es imposible distinguir si el mayor número de casos en nuestro estudio está vinculado al contacto con pacientes con COVID-19, compañeros de trabajo infectados, uso inapropiado del equipo de protección o el uso de transporte público, entre otros factores. Los enfermeros fueron los más afectados, igual que lo comunicado por Pulido L. y col.15, quizás asociado al mayor tiempo en contacto con los pacientes. No se registró ningún caso grave en este subgrupo.
Los pacientes con neumonía grave presentaron más comorbilidades, mayor edad, y niveles de dímero-D y PCR elevados en forma consistente con estudios previos24, 29. El CURB-65 no pudo discriminar a los pacientes de alto riesgo como se ha evidenciado en publicaciones anteriores42, a diferencia del PSI de moderado-alto riesgo que se asoció a la presencia de neumonía grave. Este hallazgo ha sido informado previamente por Satici C y col., quienes determinaron que el PSI es una herramienta útil para predecir mortalidad en pacientes con COVID-1943.
La mejor utilidad del PSI en COVID-19 puede deberse a que este índice incluye la edad, comorbilidades y la hipoxemia, factores asociados a una mayor mortalidad en COVID-1929.
La evolución de los pacientes fue similar a lo informado globalmente5. La mortalidad (5%) fue menor a la comunicada en Italia (9.2%), Perú (9.1%), Holanda (7.4%) y Brasil (7.1%), similar a la de España (6.4%) y mayor que en Francia (2.6%), China (2.3%), Corea del Sur (1.6%), EE.UU. (1.2%), y Alemania (0.7%)44-46. Datos correspondientes a Argentina informan que la mortalidad en la población general es del 1.8% a nivel nacional16, 47 y 1.6% en la provincia de Buenos Aires42. La menor mortalidad a nivel provincial/nacional puede deberse a que muchos de los casos graves no tienen un tiempo de seguimiento mínimo para determinar el pronóstico final, incluyen población infantil en la que la mortalidad es menor, a diferencias de las características de la población, y a estrategias de testeo que pueden modificar el número total de casos contemplado. En comunicaciones previas la edad fue un factor vinculado a la mortalidad, Rearte A. y Col.16 describieron que el 81.6% de los decesos por COVID-19 en Argentina fueron en mayores de 60 años y Price-Haywood y col.48 observaron que la mortalidad intrahospitalaria se asociaba a mayor edad. En nuestra cohorte todos los fallecidos fueron mayores de 85 años.
Nuestro estudio tiene limitaciones. Primero, dada su naturaleza retrospectiva, hubo datos ausentes de estudios complementarios (imágenes y de laboratorio). Segundo, las imágenes no fueron evaluadas por radiólogos, lo que le puede quitar reproducibilidad y precisión a los hallazgos.
Pero se asemeja más a la práctica habitual de la urgencia, en donde la radiografía no suele ser evaluada por radiólogos. Tercero, la descripción de los cuadros graves es limitada por el bajo número de pacientes en esta categoría. Cuarto, este estudio fue realizado en un único centro, lo que podría limitar el alcance de nuestros hallazgos. Sin embargo, debe considerarse, como se analizó previamente, que los resultados son compatibles con lo descrito en la bibliografía.
Como hallazgo significativo, debemos mencionar la baja sensibilidad de la RT-PCR lo que sugiere la necesidad de una segunda muestra o una tomografía de tórax según el pretest diagnóstico. Serían de gran valor estudios que evalúen el rédito diagnóstico de la RTPCR en nuestro medio, la utilidad de una estrategia de múltiples test en serie o paralelo y el intervalo entre test adecuado. Además, el PSI fue más útil que el CURB-65 para discriminar la gravedad de la neumonía, hallazgo que debería ser evaluado en estudios diseñados con este objetivo. Finalmente, sería de gran interés obtener más información relacionada a la prevalencia, características y pronóstico del COVID-19 en personal de salud.
En conclusión, los síntomas, comorbilidades asociadas, la radiología torácica, los hallazgos de laboratorio y el pronóstico del COVID-19 fueron similares a los descritos a nivel mundial. Se destaca la proporción elevada de personal de salud con SARS-CoV-2, la tasa de falsos negativos de la RT-PCR y la utilidad del PSI para discriminar la gravedad de la neumonía. Se necesitan más estudios para confirmar nuestros hallazgos.
Conflictos de intereses: Ninguno para declarar
Bibliografía
1. Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395: 497-506.
2. Wu Y, Ho W, Huang Y, et al. SARS-CoV-2 is an appropriate name for the new coronavirus. Lancet 2020; 395:949–50.
3. WHO Director-General opening remarks at the media briefing on COVID-19- 11 March 2020. En: https://www.who.int/es/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020; consultado agosto 2020.
4. Ministerio de Salud. Salud confirma el primer caso de coronavirus en el país En: https://www.argentina.gob.ar/noticias/salud-confirma-el-primer-caso-de-coronavirusen-el-pais; consultado agosto 2020.
5. Wu Z, McGoogan JM. Characteristics of and important lessons from the Coronavirus Disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese center for disease control and prevention. JAMA 2020; 323: 1239-42.
6. Grant MC, Geoghegan L, Arbyn M, et al. The Prevalence of Symptoms in 24,410 Adults Infected by the Novel Coronavirus (SARS-CoV-2; COVID-19): a systematic review and meta-analysis of 148 studies from 9 countries. PLoS One 2020; 15: e0234765.
7. Gupta A, Madhavan MV, Sehgal K, et al. Extrapulmonary manifestations of COVID-19. Nat Med 2020; 26: 1017-32.
8. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020; 395: 1054-62.
9. Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA 2020; 323: 1061-9.
10. Kumar A, Arora A, Sharma P, et al. Clinical Features of COVID-19 and Factors Associated with Severe Clinical Course: A Systematic Review and Meta-Analysis. Preprint. SSRN. 2020;3566166. Published 2020 Apr 21.
11. Carboni Bisso I, Huespe I, Lockhart C, et al. COVID-19 in the intensive care unit. Analysis of the experience during the first month of pandemic. Medicina (B Aires) 2020; 80: 25-30.
12. Wainer P, Saavedra F, Tagliapietra V, et al. COVID-19 experience in a private institution in Buenos Aires during the first month of the pandemic: 26 cases. Medicina (B Aires) 2020; 80: 193-6.
13. Milanesio M, Escudero D, Caeiro JP. Enfermedad covid-19. Reporte del primer caso confirmado en Córdoba (Argentina) y revisión de la literatura. Rev Fac Cien Med Univ Nac Cordoba 2020; 77: 110-2.
14. Castro HM, Seehaus A. COVID-19 pneumonia: tomographic findings. Rev Fac Cien Med Univ Nac Cordoba 2020; 77: 131-3.
15. Pulido L, Solís-Aramayo MA, Ibarrola M, et al. Experiencia inicial en la atención de pacientes con COVID-19 en un Hospital privado de alta complejidad de la Ciudad de Buenos Aires. Medicina (B Aires) 2020; 80: 433-8.
16. Rearte A, Baldani AEM, Barcena Barbeira P, et al. Caracteristica epidemiológicas de los primeros 116974 casos de COVID-19 en Argentina, 2020. Rev Argent Salud Publica 2020; 12 Supl COVID-19:e5.
17. Varghese GM, John R, Manesh A, et al. Clinical management of COVID-19. Indian J Med Res 2020; 151:401–10.
18. Fichas de recolección de datos para la notificación. En: https://www.argentina.gob.ar/salud/epidemiologia/fichas; consultado en agosto 2020.
19. Information on COVID-19 Treatment, Prevention and Research. COVID-19 Treatment Guidelines. En: https://www.covid19treatmentguidelines.nih.gov/; consultado en agosto 2020.
20. CDC. Discontinuation of Transmission-Based Precautions and Disposition of Patients with COVID-19 in Healthcare Settings (Interim Guidance). En: https://www.cdc.gov/coronavirus/2019-ncov/hcp/disposition-hospitalizedpatients.html; consultado agosto 2020.
21. Docherty AB, Harrison EM, Green CA, et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. BMJ 2020; 369:m1985.
22. Guan W-J, Ni Z-Y, Hu Y, et al. Clinical characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020; 382: 1708-20.
23. Rodriguez-Morales AJ, Cardona-Ospina JA, Gutiérrez- Ocampo E, et al. Clinical, laboratory and imaging features of COVID-19: a systematic review and meta-analysis. Travel Med Infect Dis 2020; 34: 101623.
24. Wiersinga WJ, Joost Wiersinga W, Rhodes A, et al. Pathophysiology, transmission, diagnosis, and treatment of Coronavirus Disease 2019 (COVID-19). JAMA 2020; 324: 782-93.
25. Khalili M, Karamouzian M, Nasiri N, Javadi S, Mirzazadeh A, Sharifi H. Epidemiological characteristics of COVID-19: a systematic review and meta-analysis. Epidemiol Infect 2020; 29:148-e130. doi: 10.1017/S0950268820001430.
26. Argenziano MG, Bruce SL, Slater CL, et al. Characterization and clinical course of 1000 Patients with COVID-19 in New York: retrospective case series. Preprint. medRxiv. 2020; 2020.04.20.20072116.
27. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with Coronavirus Disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020; 180: 1-11.
28. Basbus L, Lapidus MI, Martingano I, et al. Neutrophil to lymphocyte ratio as a prognostic marker in COVID-19. Medicina (B Aires) 2020; 80: 31-6.
29. Petrilli CM, Jones SA, Yang J, et al. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: prospective cohort study. BMJ 2020; 369: m1966.
30. Long DR, Gombar S, Hogan CA, et al. Occurrence and timing of subsequent SARS-CoV-2 RT-PCR positivity among initially negative patients. Clin Infect Dis 2020; ciaa722.
31. Weissleder R, Lee H, Ko J, Pittet MJ. COVID-19 diagnostics in context. Sci Transl Med 2020; 12: eabc1931.
32. Kucirka LM, Lauer SA, Laeyendecker O, et al. Variation in false-negative rate of reverse transcriptase polymerase chain reaction-based SARS-CoV-2 tests by time since exposure. Ann Int Med 2020; 173: 262-7.
33. Liu Y, Yan L-M, Wan L, et al. Viral dynamics in mild and severe cases of COVID-19. Lancet Infect Dis 2020; 20: 656-7.
34. Ai T, Yang Z, Hou H, et al. Correlation of chest CT and RT-PCR testing for Coronavirus Disease 2019 (COVID-19) in China: a report of 1014 cases. Radiology 2020; 296: 32-40.
35. Bernheim A, Mei X, Huang M, et al. Chest CT Findings in Coronavirus Disease-19 (COVID-19): Relationship to Duration of Infection. Radiology 2020; 295:200463.
36. Salehi S, Abedi A, Balakrishnan S, Gholamrezanezhad A. Coronavirus Disease 2019 (COVID-19): a systematic review of imaging findings in 919 patients. AJR Roentgenol 2020; 215: 87-93.
37. Choi H, Qi X, Yoon SH, et al. Erratum: Extension of Coronavirus Disease 2019 (COVID-19) on chest CT and implications for chest radiograph interpretation. Radiol Cardiothorac Imaging 2020; 2:e204001.
38. Wong HYF, Lam HYS, Fong AH-T, et al. Frequency and distribution of chest radiographic findings in patients positive for COVID-19. Radiology 2020; 296: 72-8.
39. Rivett L, Sridhar S, Sparkes D, et al. Screening of healthcare workers for SARS-CoV-2 highlights the role of asymptomatic carriage in COVID-19 transmission. eLife 2020; 9:e58728.
40. Sahu AK, Amrithanand VT, Mathew R, et al. COVID-19 in health care workers – A systematic review and metaanalysis. Am J Emerg Med 2020; 38: 1727-31.
41. Boletín epidemiológico del gobierno de la provincia de Buenos Aires. Semana 31. En: http://www.ms.gba.gov.ar/sitios/media/files/2020/08/Bolet%C3%ADn-EPI-31.pdf; consultado agosto 2020.
42. Nguyen Y, Corre F, Honsel V, et al. Applicability of the CURB-65 pneumonia severity score for outpatient treatment of COVID-19. J Infect 2020; 81:e96-e98.
43. Satici C, Demirkol MA, Sargin Altunok E, et al. Performance of pneumonia severity index and CURB-65 in predicting 30-day mortality in patients with COVID-19. Int J Infect Dis 2020; 98: 84-9.
44. Munayco C, Chowell G, Tariq A, et al. Risk of death by age and gender from CoVID-19 in Peru, March-May, 2020. Aging 2020; 12: 13869-81.
45. Sudharsanan N, Didzun O, Bärnighausen T, at al. The contribution of the age distribution of cases to COVID-19 case fatality across countries: A 9-country demographic study. Ann Intern Med 2020; M20-2973.
46. Soares R de CM, de Cássia Menezes Soares R, Mattos LR, et al. Risk Factors for hospitalization and mortality due to COVID-19 in Espírito Santo State, Brazil. Am J Trop Med Hyg 2020; 103: 1184-90.
47. Información epidemiológica. Ministerio de Salud. En: https://www.argentina.gob.ar/salud/coronavirus-COVID-19/sala-situacion; consultado agosto 2020.
48. Price-Haywood EG, Burton J, Fort D, et al. Hospitalization and mortality among black patients and White patients with Covid-19. N Engl J Med 2020; 382: 2534-43.
