CLAUDIA M. CORTÉS, JOSÉ H. CASABÉ, ROBERTO R. FAVALORO, HÉCTOR RAFFAELLI, EDUARDO DULBECCO, JOSÉ ABUD, FABIÁN SALMO, MELINA RIESCO, MILAGROS SEIJO, EDUARDO GUEVARA
Instituto de Cardiología y Cirugía Cardiovascular, Hospital Universitario Fundación Favaloro
Resumen La insuficiencia aórtica aguda (IAOA) por endocarditis infecciosa (EI) es grave y generalmente re-
quiere tratamiento quirúrgico. Se compararon los pacientes con IAOA grave por EI e insuficiencia cardíaca (IC) en clase funcional I-II NYHA (G1) con los pacientes en clase funcional III-IV (G2) en relación a características clínicas, ecocardiográficas, microbiológicas y evolución hospitalaria y se evaluaron los predictores de mortalidad, en un centro de alta complejidad. Desde 06/92 a 07/16, de 439 pacientes con EI, 86 presentaron IAOA: (G1, 39: 45.4% y G2, 47: 54.7%). El G1 presentó mayor EI protésica (43.6% vs. 17.0%; p < 0.01). Los 47 casos G2 presentaban disnea vs. 12 (30.8%) G1 (p < 0.0001). No hubo diferencias en cuanto a las características clínicas, ecocardiográficas y microbiológicas. El tratamiento quirúrgico fue principalmente por extensión de la infección y/disfunción valvular en el G1 y por IC en el G2. La mortalidad hospitalaria fue del 15.4% vs. 27.7% (G1 y G2 respectivamente, p NS). Fueron predictores en el análisis multivariado: la infección intrahospitalaria (p 0.001), los hemocultivos negativos (p 0.004) y la presencia de IC clase funcional III-IV (p 0.039).Una quinta parte de los pacientes con EI presentaron IAOA. Aquellos con IC grave requirieron tratamiento quirúrgico de emergencia y con IC con clase funcional I-II requirieron cirugía por extensión de la infección y/o disfunción valvular. La mortalidad quirúrgica y hospitalaria continúan siendo elevadas en ambos grupos y fueron predictores de mortalidad hospitalaria: la infección intrahospitalaria, los hemocultivos negativos y la IC avanzada.
Palabras clave: insuficiencia aórtica aguda, endocarditis infecciosa, mortalidad intrahospitalaria
Abstract Acute aortic regurgitation due to infective endocarditis. Acute aortic regurgitation (AAR) due to
infective endocarditis (IE) is a serious disease and usually requires surgical treatment. Our study aims to compare the clinical, echocardiographic, and microbiological characteristics as well as in-hospital outcome of patients with AAR according to the severity of heart failure (HF) and to evaluate predictors of in-hospital mortality in a tertiary centre. In a prospective analysis, we compared patients with NYHA functional class I-II HF (G1) vs. functional class III-IV HF (G2). From 06/92 to 07/16, 439 patients with IE were hospitalized; 86 presented AAR: (G1, 39: 45.4% y G2, 47: 54.7%). The G1 had higher prosthetic IE (43.6% vs. 17%, p 0.01). All G2 patients had dyspnoea vs. 30.8% of the G1 (p < 0.0001). There were no differences in clinical, echocardiographic and microbiological characteristics. Surgical treatment was indicated mainly due to infection extension or valvular dysfunction in G1 and HF in G2. In-hospital mortality was 15.4% vs. 27.7% (G1 and G2 respectively p NS). In multivariate analysis, health care-associated acquisition (p 0.001), negative blood cultures (p 0.004), and functional class III-IV HF (p 0.039) were in-hospital mortality predictors. One-fifth of the patients with EI had AAR. Half of them had severe HF which needed emergency surgery and the remaining needed surgery for extension of the infection and / or valvular dysfunction. Both groups remain to have high surgical and in-hospital mortality. Health care-associated acquisition, negative blood cultures and advanced HF were predictors of in-hospital mortality.
Key words: acute aortic regurgitation, infective endocarditis, in-hospital mortality predictors
Recibido: 17-V-2017 Aceptado: 7-VIII-2017
Dirección postal: Dra. Claudia M. Cortés, ICYCC, Fundación Favaloro, Av. Belgrano 1746, 1093 Buenos Aires
e-mail:ccortes@ffavaloro.org
La endocarditis infecciosa (EI) es una enfermedad poco frecuente (3-4 casos nuevos cada 100 000 habitantes/año) que a pesar de los avances en el diagnóstico precoz y el tratamiento quirúrgico continúa teniendo cifras elevadas de mortalidad (entre 16 y 29% al año) sin mejoría en las últimas 2 décadas1-5. Por esta razón es necesaria la identificación de subgrupos de alto riesgo con la finalidad de ofrecer el tratamiento específico en el momento adecuado para mejorar su pronóstico.
La insuficiencia cardíaca (IC) como complicación de la EI ocurre en aproximadamente el 40% de los pacientes6, 7 y su presencia en la EI localizada del lado izquierdo del corazón es una de las variables más importantes de mal pronóstico8. Por otra parte, la EI es una de las etiologías más frecuentes de insuficiencia valvular aórtica aguda (IAOA). La presencia del daño estructural grave causado por la infección sobre la válvula cardíaca genera regurgitación aórtica significativa en un ventrículo izquierdo de dimensiones generalmente conservadas que se manifiesta como insuficiencia cardíaca aguda grave que requiere tratamiento quirúrgico de urgencia, como lo establecen las guías para el control de estos pacientes9-11. Sin embargo, no todos los pacientes con insuficiencia aórtica aguda por EI se presentan clínicamente con insuficiencia cardíaca grave12.
El propósito del presente estudio fue comparar las características clínicas, ecocardiográficas, microbiológicas y evolución hospitalaria de pacientes que presentan insuficiencia aórtica aguda por EI, según el grado de compromiso hemodinámico de su insuficiencia cardíaca y evaluar predictores de mortalidad hospitalaria en un centro de alta complejidad.
Materiales y métodos
Se analizaron datos obtenidos prospectivamente de los pacientes mayores de 13 años con diagnóstico de EI definitiva o posible de acuerdo con los criterios de la Universidad de Duke13 internados en el Hospital Universitario de la Fundación Favaloro entre junio de 1992 y julio de 2016. De ellos incluimos los que presentaban EI aguda de válvula aórtica y comparamos las características clínicas, microbiológicas, ecocardiográficas y su evolución en los que se presentaban con insuficiencia cardíaca aguda en clase funcional I-II (Grupo 1) de la New York Heart Association (NYHA), con respecto a los que se encontraban en clase funcional III-IV (Grupo 2). Se registró: el tiempo transcurrido desde el inicio de los síntomas de EI a la derivación a nuestra institución, diferenciando entre EI sobre válvula nativa y sobre válvula protésica, el tiempo desde el ingreso y la cirugía, antecedentes clínicos (diabetes, insuficiencia renal crónica, enfermedades del colágeno o cáncer), factores predisponentes de EI (antecedentes de fiebre reumática, presencia de válvula protésica, enfermedades congénitas o degenerativas, antecedentes de EI y procedimientos capaces de producir bacteriemias en los últimos 3 meses), administración previa de antibióticos, forma de adquisición de la infección (intra o extrahospitalaria), síntomas (presencia o antecedente de fiebre, disnea y su clase funcional, escalofríos, sudoración, astenia, anorexia, artralgias, pérdida de peso, mialgias, lumbalgias, tos, alteraciones del sensorio, cefalea) y signos (esplenomegalia definida por la palpación del bazo al examen físico, presencia de petequias, signos de foco neurológico, nódulos de Osler, lesiones de Janeway o Manchas de Roth.) En todos los casos se tomaron muestras para hemocultivos y se realizaron ecocardiogramas por vía transtorácica y/o transesofágica. A todos se les administró tratamiento antibiótico empírico que luego fue ajustado por los resultados de los cultivos. Todos fueron evaluados por un equipo conformado por cirujanos cardiovasculares, cardiólogos e infectólogos, dedicado a evaluar los casos con endocarditis a fin de determinar el momento quirúrgico óptimo.
EI en actividad: cuadro clínico compatible y alguno de los siguientes criterios: hemocultivos positivos, fiebre, leucocitosis, marcadores de inflamación elevados (VSG y/o PCR) aún bajo tratamiento antibiótico.
Endocarditis protésica precoz: infección protésica adquirida dentro del año de la cirugía.
Endocarditis protésica tardía: infección protésica posterior al año de la cirugía
Cirugía de Ross: Consiste en resecar la válvula y la raíz aórticas, y reemplazarlos por un autoinjerto con la válvula pulmonar y la raíz de la arteria pulmonar del paciente. Se reimplantan las arterias coronarias y, en posición pulmonar, se implanta un homoinjerto cadavérico.
Cirugía de Bentall y de Bono: consiste en resecar la válvula y la raíz aórticas y reemplazarlas por un tubo valvulado, con prótesis biológica o mecánica. Se reimplantan las arterias coronarias
Mortalidad quirúrgica: fue definida como la muerte ocurrida durante la internación en relación con el procedimiento quirúrgico.
Mortalidad hospitalaria fue definida como la ocurrida durante la internación.
Las variables discretas están expresadas como porcentajes y las continuas como media ± desvío estándar. Las comparaciones estadísticas de variables discretas se realizaron con prueba de chi2 de Pearson o prueba exacta de Fisher y las comparaciones entre variables continuas con la prueba de la T de Student para datos no apareados. Se realizó un análisis multivariado de regresión logística múltiple para determinar predictores de mortalidad hospitalaria, seleccionando las variables asociadas en el análisis univariado y aquellas referidas en estudios previos. Se calculó el odds ratio (OR) con su respectivo intervalo de confianza 95% (IC 95%). Se consideraron valores de p < 0.05 como estadísticamente significativos.
Resultados
Cuatrocientos treinta y nueve pacientes ingresaron en el período de estudio a la Fundación Favaloro, con diagnóstico de EI valvular activa, realizándose diagnóstico de IAOA en 86 de ellos (19.6%). La mayoría presentó EI definida según los criterios de Duke13 (Grupo 1: 84.6% vs. Grupo 2: 95.7% p NS). Sesenta y tres casos (77.6%) fueron derivados de otras instituciones. El grupo 1 estuvo constituido por 39 (45.4%) que presentaron IC en clase funcional I-II de la NYHA y el grupo 2 por 47 (54.6%) en clase funcional III-IV. El tiempo de evolución entre el inicio de los síntomas de EI a la derivación a nuestra institución fue significativamente más tardío en el grupo 2 (Grupo 1: 45 ± 48 días vs. 52 ± 81 días p 0.008).
En la Tabla 1 se comparan las características basales de la población. Los pacientes del grupo 1 presentaban EI sobre válvula protésica con mayor frecuencia que los del grupo 2. Al analizar el tiempo de evolución entre el inicio de los síntomas a la derivación según el tipo de válvula, observamos que los casos de EI sobre válvula nativa llegaban más tardíamente a nuestro hospital. (53 ± 74 días vs. 38 ± 49 días p 0.01). La Tabla 1 muestra la frecuencia de aparición de los síntomas y signos de ambos grupos. La fiebre fue el síntoma principal en ambos grupos (Grupo 1: 89.7% vs. grupo 2: 89.4% p NS) y de acuerdo con los criterios de inclusión todos los pacientes del grupo 2 presentaban disnea mientras que solo 12 (30.8%) del grupo 1 (p < 0.0001).
No hubo diferencias en cuanto a los hallazgos electrocardiográficos. En el grupo 1 presentaron bloqueo aurículo-ventricular completo dos pacientes y cuatro bloqueo aurículo-ventricular de primer grado. En el grupo 2 cuatro pacientes presentaron bloqueo aurículo-ventricular de primer grado, uno bloqueo completo de rama izquierda y uno aleteo auricular.
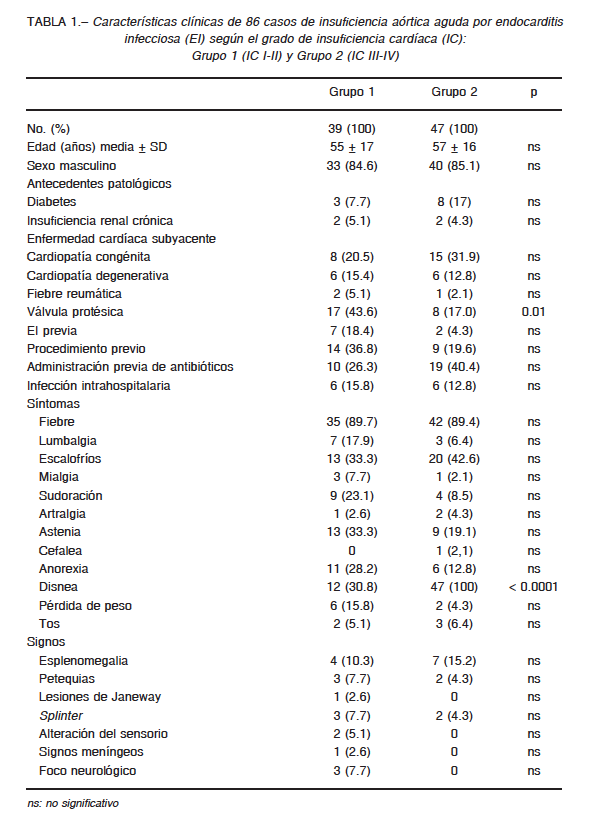
No hubo diferencias en cuanto al antecedente de insuficiencia renal crónica (grupo 1: 5.1% vs. grupo 2: 4.3%)
En el grupo 1 nueve (23.1%) presentaron embolias, cinco de ellas en el sistema nervioso central y siete (15.2%) en el grupo 2 (dos en el sistema nervioso central) (p NS).
Se encontraron vegetaciones en 25 (64.1%) en el grupo 1 y en 39 (83%) en el grupo 2 (p NS). Tampoco hubo diferencias en cuanto a la presencia de absceso del anillo (grupo 1: 28.2% vs. grupo 2: 23.4%).
En el 79.5% en el grupo 1 y 85.1% del grupo 2 (p NS) se rescató el microorganismo responsable en los hemocultivos. Trece (87%) de los 15 casos con hemocultivos negativos habían recibido antibiótico de amplio espectro y en dos no se encontró motivo. Al analizar los microorganismos en ambos grupos no se encontraron diferencias estadísticamente significativas entre ellos, como tampoco al diferenciar entre EI nativa, protésica precoz y tardía. (Tablas 2 y 3).
El tratamiento quirúrgico de la EI fue realizado en 31 (79.5%) en el grupo 1 y en 43 (91.5%) del grupo 2 (p NS).
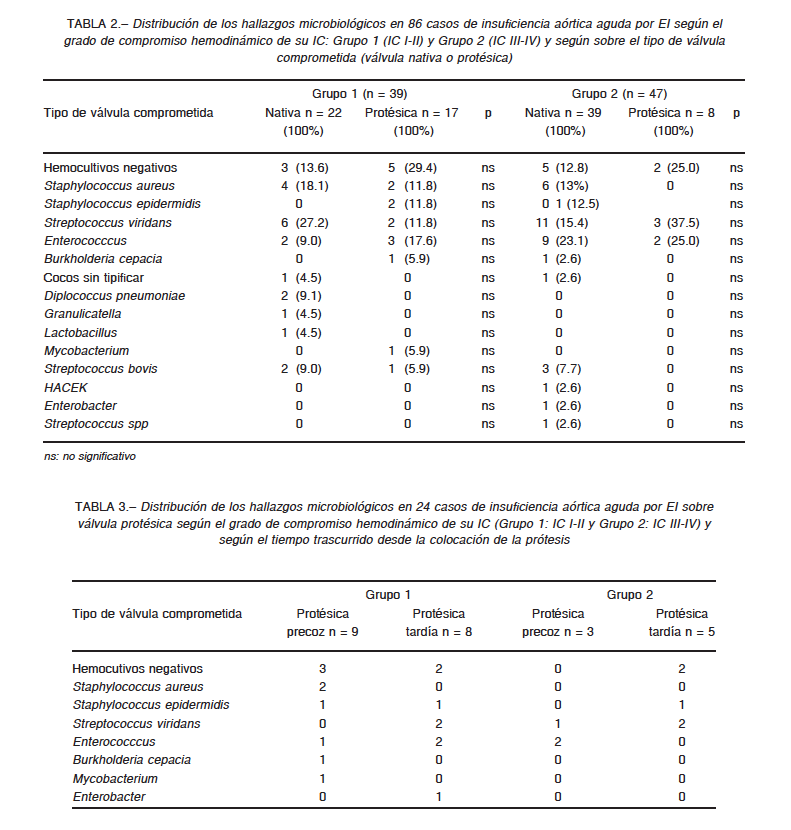
El tiempo transcurrido desde el inicio de los síntomas hasta la cirugía fue significativamente mayor en el grupo 1. (Grupo 1: 66 ± 59 días vs. Grupo 2: 58 ± 84 días, p 0.02) y el tiempo entre el ingreso y la cirugía fue de 3.5 ± 4 días y 3.2 ± 6 días en el grupo 1 y 2 respectivamente (p 0.006).
En el grupo 2 el motivo principal de la indicación quirúrgica fue la insuficiencia cardiaca y dos casos presentaron además absceso anular. En cuanto al grupo 1 el 32.3% presentó como motivo principal la presencia de absceso anular, el 19.4% disfunción protésica, 19.4% evolucionó con IC en clase funcional I-II, 6.5% embolias y 6.5% fiebre persistente.
En ambos grupos el homoinjerto fue el procedimiento más utilizado (Grupo 1: 14 (45.2%) dos en cirugía combinada y grupo 2: 24 (55,8%) siete en cirugía combinada).
La válvula biológica fue utilizada en ocho casos (25.8%), cuatro en cirugía combinada, en el grupo 1, y en nueve (21%) del grupo 2; dos de ellas en cirugía combinada. La válvula mecánica fue utilizada en ocho (25.8%), cinco de ellas en cirugía combinada del grupo 1, y en seis (13.9%) del grupo 2 (tres de ellas combinadas). En tres (7%) casos del grupo 2 y en uno (3.2%) del grupo 1 se realizó cirugía de Ross y un caso (2.3%) del grupo 2 requirió cirugía de Bentall de Bono. (p NS)
En el post operatorio se encontraron como complicaciones: insuficiencia renal aguda en seis de 31 pacientes operados del grupo 1 (19.3%); en que uno requirió hemodiálisis, y 10 de 43 (23.2%) casos del grupo 2 (p NS), en que cuatro requirieron hemodiálisis. Cinco (11.6%) pacientes del grupo 2, y 3 (10%) del grupo 1 requirieron marcapasos. Uno de cada grupo presentó un accidente cerebro vascular.
No hubo diferencias significativas en ambos grupos con respecto a la mortalidad estimada promedio según el Euroscore14, 15 (Grupo 1: 19.6% ± 18 vs. Grupo 2: 20.5 ± 15.9) y el score de Parsonet16 (Grupo 1: 25.6% ± 13 vs. Grupo 2: 23.6 ± 11).
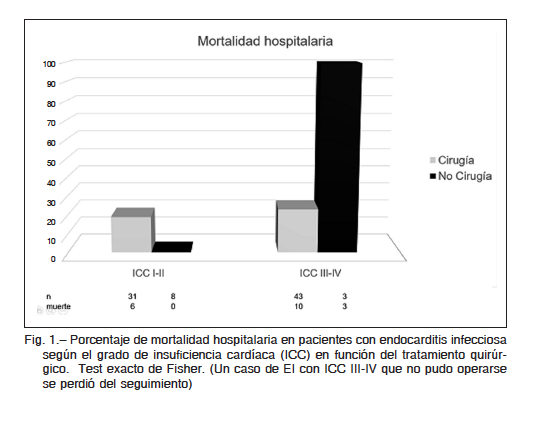
La mortalidad quirúrgica del grupo 1 en estudio se produjo en cuatro pacientes (12.9%) y la del grupo 2 en 10 (23.3%) (p NS). De los cuatro que no se operaron del grupo 2, tres fallecieron durante la internación (uno por insuficiencia cardíaca y los dos restantes por sepsis) y uno fue derivado a otra institución y se perdió del seguimiento.
La mortalidad hospitalaria se produjo en seis pacientes de los 39 del grupo 1 (15.4%) y en 13 pacientes de los 47 del grupo 2 (27.7%), siendo en el grupo 2: siete por insuficiencia cardíaca y cinco por sepsis, mientras que en el grupo 1 hubo un deceso por sepsis, dos fueron intraquirúrgicos y tres por otras causas (Fig. 1).
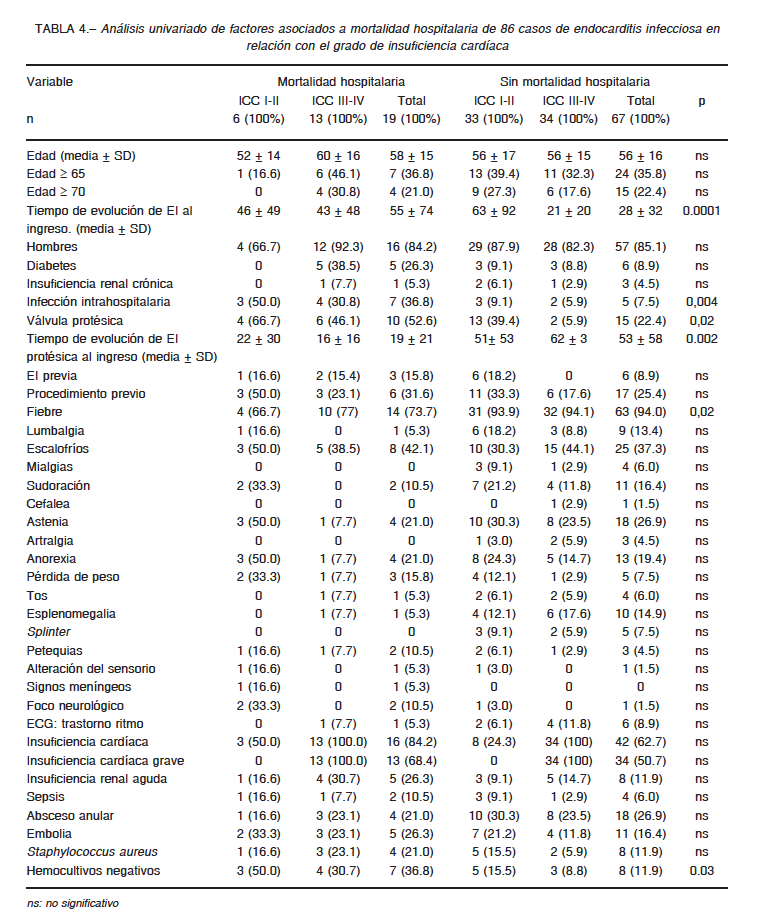
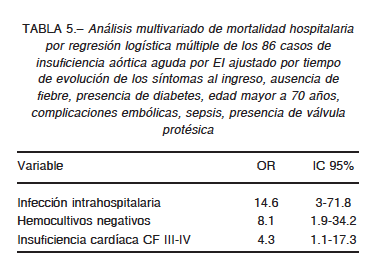
En la Tabla 4 se muestran las variables que se asociaron con mayor mortalidad hospitalaria. En el análisis multivariado (Tabla 5), resultaron predictores de mortalidad hospitalaria la infección intrahospitalaria (p < 0.001), la presencia de hemocultivos negativos (p < 0.004) y la presencia de insuficiencia cardíaca III-IV (p < 0.039).
Discusión
La EI es una de las etiologías más frecuentes de la IAOA9, 12 Debido al compromiso hemodinámico y/o al mal control de la infección, en muchas ocasiones requiere tratamiento quirúrgico de emergencia o urgencia. La decisión de una intervención quirúrgica en estos casos es muchas veces difícil. Como lo recomiendan las guías9, en nuestra institución existe un equipo conformado por cardiólogos clínicos, cirujanos cardiovasculares e infectólogos (“endocarditis team”) que se encarga de evaluar a los pacientes con EI en actividad a fin de decidir la necesidad de tratamiento quirúrgico y el momento óptimo para realizarlo. En este estudio describimos las características clínicas, microbiológicas, ecocardiográficas y la evolución de pacientes que ingresaron a nuestro centro con este diagnóstico.
La presencia de IC como complicación de la EI ocurre en aproximadamente el 40% de los casos6, 7. En el estudio EIRA 1 (años 1992-1993) el 35.5% presentó IC y fue motivo de cirugía en el 64%17. En el EIRA 2 (años 2003-2004) el 36.2% de la población la presentó y fueron operados 61.4%18. Es la complicación más frecuente de la EI localizada del lado izquierdo del corazón, el motivo principal de indicación quirúrgica y el factor de mayor peso pronóstico negativo8. La IC moderada a grave aumenta
significativamente la mortalidad hospitalaria a 6 meses y a un año9, 19. 20 y se observa más frecuentemente cuando hay compromiso aórtico que en el mitral. Así Kiefer y col. encontraron que, de 1359 pacientes con EI e insuficiencia cardíaca, el 44.9% presentó insuficiencia aórtica aguda12. La causa principal es la destrucción valvular con regurgitación aguda o fístulas, y más raramente por obstrucción por vegetaciones voluminosas21. De acuerdo a la experiencia
internacional y nacional9-11, 21 la cirugía está indicada en forma urgente cuando la IC es grave y se produce por regurgitación grave aórtica o mitral. También se sugiere la intervención urgente en pacientes con estas valvulopatías sin IC clínica, pero con signos ecocardiográficos de elevación de la presión de fin de diástole del ventrículo izquierdo (por ejemplo cierre precoz de la válvula mitral) o hipertensión pulmonar moderada a grave9. Sin embargo, en el “mundo real” un número significativo con indicación de cirugía según estas guías, no llegan a ser operados (24% en el registro internacional prospectivo colaborativo, ICE-PCS)22. El 54.6% de los pacientes del presente estudio presentaron IC grave y a todos se les indicó tratamiento quirúrgico, que se concretó en 43 de 47 (91.5%).
No obstante, algunos enfermos con IAOA no presentan IC grave12; y la necesidad de tratamiento quirúrgico queda condicionada a otras eventualidades, como la persistencia del cuadro séptico a pesar del correcto tratamiento antibiótico, la presencia de absceso anular, la etiología micótica y las embolias mayores a repetición9-11. En nuestra población un 79.5% se operó por presentar absceso anular, embolias recurrentes, fiebre persistente a pesar del tratamiento antibiótico y/o disfunción protésica con IC leve. En este grupo predominó la EI en válvula protésica, que es un factor de riesgo documentado para la aparición de extensión de la infección9. A pesar de que el tiempo de inicio de los síntomas a la derivación fue menor en las EI protésicas, este hecho no mejoró el pronóstico (Tabla 4). Por otra parte, el retraso evidenciado en la derivación de los pacientes del grupo 2 podría explicar el mayor compromiso hemodinámico con el que arribaron al hospital, y seguramente este hecho hizo que estos pacientes llegaran antes a ser intervenidos quirúrgicamente.
Los hemocultivos fueron positivos en el 79.5% y el 85.1% (Grupo 1 y Grupo 2 respectivamente) en porcentajes similares a los comunicados en nuestro país18 sin diferencia entre ambos grupos. La causa principal de la negatividad de los cultivos fue, como está descripto9,10, la administración previa e intempestiva de antibióticos de amplio espectro.. En discordancia con lo que se observa en la actualidad, donde el Staphylococcus aureus es el germen más frecuente22, 23, el microorganismo predominante en ambos grupos fue el Streptococcus viridans seguido por el Enterococcus, y por último el S. aureus. Una explicación posible es que el paciente con EI por Streptococcus viridans por considerarse el germen menos agresivo es derivado tardíamente para su tratamiento quirúrgico y por ello se presentan con mayor destrucción valvar; además, como está descripto22, una proporción importante de los pacientes con EI por S. aureus no llega al tratamiento quirúrgico por el mal pronóstico percibido anticipadamente, no importa cuál sea el tratamiento a instituir.
Las técnicas quirúrgicas en la válvula aórtica requieren de la colocación de una válvula mecánica o biológica, en relación con la edad del paciente y a la contraindicación de anticoagulación a largo plazo. El reemplazo valvular aórtico con homoinjertos fue introducido por Ross en 1962 y Barrat-Boyes en 196424. 25. Mediante la criopreservación se utilizaron durante años en la EI aórtica ya que presentan alta resistencia a la infección, ausencia de necesidad de anticoagulación, excelente hemodinámica y permiten la reparación de neocavidades, hallazgo frecuente cuando existen abscesos anulares. Las desventajas son la disponibilidad y la durabilidad. Dado que en nuestro Hospital contábamos con un banco de homoinjertos con buenos resultados a largo plazo26 a la mayoría de los pacientes se les realizó el reemplazo valvular aórtico con esta técnica, aunque en un número importante se utilizaron también válvulas biológicas y mecánicas. Recientemente Solaris y col.27 publicaron su experiencia de 20 años en pacientes que requirieron reemplazo valvular aórtico por EI con homoinjerto. De 95 casos con seguimiento medio de 7.8 años, la libertad de reoperación por EI o degeneración estructural del homoinjerto a 10 y 15 años fue de 86.3 ± 5.5 y 47.3 ± 11.0%, respectivamente. En trabajos recientes, comparando diferentes prótesis en la EI aórtica, se concluye que la elección de la misma no influyó en la mortalidad quirúrgica ni hospitalaria28-30.
Los pacientes con insuficiencia cardíaca grave que fueron sometidos al tratamiento quirúrgico indicado, presentaron una mortalidad quirúrgica del 23.3%, acorde a lo esperado por los scores de riesgo utilizados (Euroscore14, 15 y Parsonet16), mientras que los que no se operaron fallecieron todos. Por otro lado, en los pacientes cuyo compromiso hemodinámico no fue grave, su mortalidad quirúrgica fue menor (12.9%), aunque no alcanzó niveles de significancia estadística, y aquellos que no se operaron no tuvieron un evento fatal probablemente por una buena selección de los pacientes para el tratamiento quirúrgico.
La mortalidad hospitalaria fue del 15.4% en pacientes del Grupo 1 y de 27.7% en Grupo 2; son porcentajes que se encuentran dentro del rango esperado en distintas series31-34. Los factores asociados con la misma fueron la infección intrahospitalaria, los hemocultivos negativos, la EI en válvula protésica, el tiempo de evolución de la EI a la derivación y la ausencia de fiebre. Al ajustar por ausencia de fiebre, tiempo de evolución de la EI a la derivación, presencia de diabetes, edad mayor a 70 años, complicaciones embólicas, sepsis, presencia de válvula protésica o presencia de S. aureus, resultaron predictores independientes la infección intrahospitalaria, los hemocultivos negativos y la presencia de insuficiencia cardíaca grave. La infección intrahospitalaria está en aumento en relación principalmente a los cuidados de la salud, y a pesar de los adelantos en el diagnóstico y tratamiento, las EI adquiridas en el hospital siguen teniendo una alta mortalidad9, 10; de hecho, en el presente estudio resultó el predictor de mortalidad con mayor peso estadístico. La presencia de hemocultivos negativos, el segundo predictor, ya ha sido referida como causante de mayor morbimortalidad35, y por último, como fue descripto, la aparición de insuficiencia cardiaca grave es uno de los principales factores pronósticos6-8.
Una quinta parte de los pacientes con EI presentaron IAOA. Se diferenciaron 2 grupos: por un lado, aquellos con escaso compromiso hemodinámico que requirieron cirugía por extensión de la infección y/o disfunción valvular y en los cuales predominó la EI protésica; y un segundo grupo con IAOA e insuficiencia cardíaca grave, que requirieron reemplazo valvular de emergencia. Ambos grupos siguen teniendo alta mortalidad quirúrgica y hospitalaria, siendo los predictores de las mismas la infección intrahospitalaria, la presencia de hemocultivos negativos y la insuficiencia cardíaca avanzada.
Como limitación del presente estudio debemos mencionar que el Hospital Universitario de la Fundación Favaloro es un centro de derivación terciaria para la realización de intervenciones quirúrgicas debido a su disponibilidad y resultados en cirugía cardiovascular. Muchas veces los pacientes llegan en condiciones de extrema gravedad. Por esto, los resultados y conclusiones no pueden extenderse a hospitales generales sin esta complejidad.
Agradecimientos: Al Dr. Gustavo A. Giunta por el análisis estadístico
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Hoen B, Alla F, Selton-Suty C, et al. Changing profile of infective endocarditis. JAMA 2002; 288: 75-81.
2. Casabé JH, Deschle H, Cortés C, et al. Predictores de mortalidad hospitalaria en 186 episodios de endocarditis infecciosa activa en un centro de tercer nivel (1992-2001). Rev Esp Cardiol 2003; 56: 578-85.
3. Oyonarte M, Montagna M, Braun S, et al. Resultados del estudio cooperativo nacional de endocarditis infecciosa (ECNEI: 1998-2002) Rev Med Chile 2003; 131: 237-50.
4. Cabell CH, Jollis J, Peterson G, et al. Changing patients characteristics and the effect on mortality in endocarditis. Arch Intern Med 2002; 162: 90-4.
5. Modenesi JC, Ferreirós ER, Swieszkowski S, et al. Predictores de mortalidad intrahospitalaria de la endocarditis infecciosa en la república Argentina: resultados del EIRA II. Rev Argent Cardiol 2005; 73: 283-90.
6. Vikram HR, Buenconsejo J, Hasbun R, Quagliarello VJ. Impact of valve surgery on 6-month mortality in adults with complicated, left-sided native valve endocarditis: a propensity analysis. JAMA 2003; 290: 3207-14.
7. Thuny F, Habib G. When should we operate on patients with acute infective endocarditis? Heart 2010; 96: 892-7.
8. Delahaye F, Alla F, Beguinot I, Bruneval P, et al. In-hospital mortality of infective endocarditis: prognostic factors and evolution over an 8-year period. Scand J Infect Dis 2007; 39: 849-57.
9. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC), European Association for Cardio-Thoracic Surgery (EACTS), Vahanian A, Alfieri O, Andreotti F, et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33: 2451-96.
10. Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC guidelines for the management of infective endocarditis. Eur Heart J 2015; 36: 3075-128.
11. Baddour LM, Wilson WR, Bayer AS, et al. American Heart Association Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young, Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and Stroke Council. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications. Circulation 2015; 132: 1435-86.
12. Kiefer T, Park L, Tribouilloy C, et al. Association between valvular surgery and mortality among patients with infective endocarditis complicated by heart failure. JAMA 2011; 306: 2239-2247.
13. Durack DT, Lukes A, Bright DK. New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic finding. Am J Med 1994; 96: 100-8.
14. Nashef SAM, Roques F, Michel P, et al. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg 1999; 16: 9-13.
15. Roques F, Nashef SA.M, Michel P, et al. Risk factors and outcome in European cardiac surgery: analysis of the EuroSCORE multinational database of 19030 patients. Eur J Cardiothorac Surg 1999; 15: 816-23.
16. Parsonnet V, Dean D, Bernstein AD. A method of uniform stratification of risk for evaluating the results of surgery in adquired adult heart disease. Circulation 1989; 79(Suppl 1): 3-12.
17. Casabé JH, Pellegrini CD, Hershson AR, et al. Endocarditis infecciosa en la República Argentina. Resultados Generales. Ver Argent Cardiol 1996; 64 (Supl V): 9-19.
18. Ferreiros ER, Nacinovich F, Casabé JH, et al. Epidemiologic, clinical, and microbiologic profile of infective endocarditis in Argentina: A national survey. The endocarditis infecciosa en la Republica Argentina–2 (EIRA 2) Study. Am Heart J 2006; 151: 545-52.
19. Thuny F, Beurtheret S, Mancini J, et al. The timing of surgery influences mortality and morbidity in adults with severe complicated infective endocarditis: a propensity analysis. Eur Heart J 2011; 32: 2027-2033.
20. Revilla A, Lopez J, Vilacosta I, et al. Clinical and prognostic profile of patients with infective endocarditis who need urgent surgery. Eur Heart J 2007; 28: 65-71.
21. Casabé JH, Varini S, Nacinovich F et al. Consenso de endocarditis infecciosa. Ver Argent Cardiol 2016; 84 (Supl): 1- 49.
22. Chu VH, Park LP, Athan E, et al., International Collaboration on Endocarditis Investigators. Association between surgical indications, operative risk and clinical outcome in infective endocarditis: a prospective study from the International Collaboration on Endocarditis. Circulation 2015; 131: 131-40.
23. Casabe JH. Endocarditis infecciosa, una enfermedad cambiante Medicina (B Aires) 2008; 68: 164-74.
24. Ross DN. Homograft replacement of the aortic valve. Lancet 1962; 2: 487-48.
25. Barrat-Boyes BG. Homograft aortic valve replacement in aortic incompetence and stenosis. Thorax 1964; 19: 131-134.
26. Favaloro RR, Casabé JH, Stutzbach P y col. Homoinjertos y autoinjertos en la endocarditis infecciosa aórtica en actividad: resultados inmediatos y a mediano plazo. Rev Argent Cardiol 2000; 68: 555-560.
27. Solari S, Mastrobuonia S, De Kerchovea L, et al. Over 20 years experience with aortic homograft in aortic valve replacement during acute infective endocarditis. Eur J Cardiothorac Surg. 2016 Dec; 50:1158-1164.
28. Kim JB, Ejiofor JI, Yammine, M, et al. Are homografts superior to conventional prosthetic valves in the setting of infective endocarditis involving the aortic valve? J Thorac Cardiovasc Surg 2016; 151: 1239-48.
29. Feindel CM. It’s not what you put in that is important, it’s what you take out. J Thorac Cardiovasc Surg 2016; 151:1249-50.
30. Kirklin JK. Challenging homografts as the holy grail for aortic valve endocarditis; J Thorac Cardiovasc Surg 2016; 151:1230-1.
31. Murdoch DR, Corey G, Hoen B, et al., International Collaboration on Endocarditis- Prospective Cohort Study (ICE-PCS) Investigators. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009; 169: 463-73.
32. Leone S, Ravasio V, Durante-Mangoni E, et al. Epidemiology, characteristics, and outcome of infective endocarditis in Italy: the Italian study on endocarditis. Infection 2012; 40: 527-535.
33. Martínez-Sellés M, Muñoz P, Arnáiz A, et al. Valve surgery in active infective endocarditis: A simple score to predict in-hospital prognosis. Int J Cardiol 2016; 203: 62-8.
34. Gatti G, Benussi B, Gripshi F, et al. A risk factor analysis for in hospital mortality after surgery for infective endocarditis and a proposal of a new predictive scoring system. Infection 2017 Jan 4. Doi: 10.1007/s15010-016-0977-9. [Epub ahead of print]
35. Katsouli A, Massad MG. Current issues in the diagnosis and management of blood culture-negative Infective and non-infective endocarditis. Ann Thorac Surg 2013; 95: 1467-74.
– – – –
LA TAPA
Tarjeta comercial de John Yarwell (~1690s). The British Museum, No. Y.5.310. Papel; 25.4 cm por 16.5 cm. Donación de Dorothea, Lady Banks (1818).
John Warwell (1648-1712) después de su aprendizaje, a los 24 años, se instaló por su cuenta como óptico, pulidor de lentes. En su clientela se contaban exigentes miembros de la Royal Society. Al parecer era un hábil y concienzudo artesano que prefería “satisfacer a sus amigos [clientes] más que a su propio interés”. Quedan pocos objetos de su manufactura. (Whipple RS. John Yarwell or the story of a trade card. Ann Sci 1951: 7: 62-9). La tarjeta ilustra los productos que ofrecía Yarwell: anteojos, lentes de aumento, microscopios simples y compuestos, telescopios de varios tipos y tamaño, prismas. El caballero que observa con un telescopio es el astrónomo Johannes Hevelius (1611-1687), nativo de Gdansk (Danzig), autor de Selenographia, sive Luna descriptio (1647), el “fundador de la topografía lunar”. Las tarjetas comerciales de propaganda han merecido la atención de los historiadores de la ciencia (Crawforth MA. Evidence from trade cards for the scientific instruments industry. Ann Sci 1985; 42:453-544).
Las tarjetas fueron reemplazadas por catálogos, ahora por sitios en la web y serviciales agentes. Los fabricantes de instrumentos científicos formaron, en Londres, en 1956, la Worshipful Company of Scientific Instruments Makers, gremio registrado con escudo, grados, ceremonias y vestimentas casi medievales. El escudo tiene el lema: Sine nobis Scientia Languet (Sin nosotros la ciencia languidece). Tienen razón.
