El hepatocarcinoma (HCC) es el tumor hepático primario más frecuente y su incidencia y su tasa de mortalidad se encuentran en claro aumento. Algunas cifras son preocupantes por su letalidad: actualmente en el mundo se diagnostican cada año cerca de 750 000 nuevos casos y se registra un número similar de muertes, lo que la convierte en la segunda causa de muerte asociada al cáncer a nivel global1, 2. Por otra parte, las opciones terapéuticas con intención curativa (trasplante, resección y terapias ablativas) solo pueden ser aplicadas en pacientes con enfermedad temprana, lo que ocurre en apenas 30%-40% de los casos al momento del diagnóstico3. El inhibidor de tirosina multiquinasas sorafenib (Nexavar®), el único tratamiento para la enfermedad avanzada, brinda una supervivencia global de 10.7 meses, superando en menos de 3 meses al placebo3. Recientemente, el estudio RESORCE demostró que la terapia de segunda línea con regorafenib, una molécula similar al sorafenib, aumenta la supervivencia de pacientes no respondedores a dicha molécula 7.8 a 10.6 meses frente al placebo4. Resulta claro que es necesario desarrollar nuevas estrategias para pacientes con HCC en estadios avanzados5. Recientemente, diversos inhibidores de enzimas modificadoras postraduccionales de histonas han mostrado resultados promisorios tanto in vitro como in vivo 6.
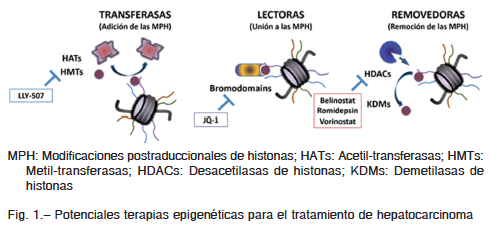
Investigaciones realizadas en las últimas décadas han revelado que la reprogramación epigenética permite a las células adquirir características necesarias para el desarrollo tumoral y las resistencias al tratamiento del cáncer6. La epigenética es el estudio de aquellos mecanismos heredables que alteran los procesos genéticos sin involucrar cambios en la secuencia del ADN6. Básicamente, mientras que el ADN tiene toda la información para dirigir las funciones de una célula, la modulación epigenética regula el grado de empaquetamiento del ADN incidiendo en el patrón de expresión génica. Esto puede ocurrir durante la embriogénesis, en el estado adulto y durante diversos procesos patológicos, incluyendo el cáncer. El mejor estudiado de estos mecanismos consiste en las modificaciones postraduccionales de histonas (Fig. 1), que son generalmente reversibles: metilaciones, acetilaciones, fosforilaciones y ubiquitinaciones6. Cada tipo de modificaciones postraduccionales de histonas es regulada de manera dinámica por dos grupos de enzimas, aquellas que agregan la marca a las histonas (transferasas) y aquellas que las remueven (removedoras). Asimismo, las modificaciones postra-
duccionales de histonas son reconocidas por proteínas que poseen dominios específicos de unión a las mismas (lectoras) y que dirigen eventos sobre la cromatina6. De este modo, alteraciones en las vías epigenéticas pueden afectar la transcripción génica (incrementando la expresión de oncogenes y/o suprimiendo la de genes supresores de tumores), la reparación del ADN (incrementando la inestabilidad genómica), la replicación celular (permitiendo la evasión de diversos puntos de control durante el ciclo celular) y, con ellos, contribuir a desarrollar la resistencia a las terapias convencionales7. Debido a esto, se está observando un importante desarrollo de inhibidores específicos de las enzimas epigenéticas a nivel clínico (Fig. 1). En este sentido, la mayoría de los avances se han realizado en tumores de origen hematopoyéticos y se aprobaron inhibidores contra deacetilasas de histonas para su tratamiento (belinostat, romidepsin y vorinostat, entre otros)8.
Dentro de las alteraciones epigenéticas desarrolladas durante el proceso hepatocarcinogénico se han descripto mutaciones y desregulaciones de enzimas modificadoras de histonas. Por ejemplo, la sobreexpresión de EZH-2, una metiltransferasa de la lisina 27 de la histona 3 (H3K27) que funciona como subunidad catalítica del complejo represivo polycomb 2, ha sido asociada a un mal pronóstico y un fenotipo agresivo en pacientes con HCC por la regulación de genes relacionados con la resistencia a quimioterapia9. Por otra parte, un estudio reciente demostró una interregulación entre EZH2 y la quinasa relacionada con el ciclo celular (CCRK) fundamental en el proceso hepatocarcinogénico y la progresión tumoral. De manera similar, tanto JMJD1A, una demetilasa de la lisina 9 de la histona 3 (H3K9) como KDM5B y LSD-1 (demetilasas de la lisina 4 de la histona 3) se encuentran sobreexpresadas en pacientes con HCC y son asociadas con mal pronóstico y mayor capacidad invasiva. Por otra parte, la depleción de KDM4B o KDM6B, demetilasas de H3K9 y H3K27 respectivamente, en células de HCC reduce el crecimiento celular, la migración y la invasión. Estos nuevos conocimientos han posicionado a las enzimas involucradas en las vías epigenéticas como nuevos blancos terapéuticos del HCC10. En esta línea, inhibidores de ADN metiltransferasas (vidaza, decitabine y SGI-1027), inhibidores de metiltransferasas (LLY-507), inhibidores de histonas deacetilasas (ácido valproico, n-butirato de sodio, vorinostat y belinostat) y de dominios de lectura de histonas acetiladas (JQ-1) han mostrado resultados promisorios tanto in vitro como in vivo11-13. En esta línea, el ensayo clínico en fase I/II utilizando belinostat ha comunicado una supervivencia global de 6.6 meses, poniendo en discusión el potencial terapéutico de los inhibidores epigenéticos en esta enfermedad. De manera similar, los resultados preliminares del estudio Shelter en pacientes que progresaron bajo tratamiento con sorafenib, mostraron una supervivencia de 4 meses con el tratamiento en segunda línea con reminostat. No obstante, en el mismo ensayo la combinación de reminostat con sorafenib resulta en una supervivencia global de 8 meses2. Mas allá de los beneficios moderados de este estudio, la posibilidad de que reminostat pueda restaurar la sensibilidad al sorafenib renueva la expectativa sobre este tipo de terapias.
El gran potencial de las terapias que tienen como blanco los mecanismos epigenéticos radica en la reversibilidad de los cambios que involucran, a diferencia de lo que ocurre con las mutaciones genéticas6. En este contexto, ensayos clínicos que utilizan diversos inhibidores de enzimas epigenéticas para el tratamiento de diversos tipos de cáncer se encuentran en sus fases iniciales. A esto se suma la identificación de grupos de pacientes con HCC con susceptibilidad a este tipo de terapias. En conjunto, ambos tipos de estudios permiten una visión optimista en el futuro cercano.
El mensaje es que será importante no solo evaluar el potencial terapéutico de estos inhibidores en el contexto del HCC sino, y quizás más importante aún, identificar grupos de pacientes con “susceptibilidades epigenéticas” y poder hacer terapias más personalizadas. Asimismo, al observarse que diversas enzimas epigenéticas participan de mecanismos de resistencia a las terapias convencionales, se abre la posibilidad de emplear moléculas inhibidoras de vías epigenéticas en combinación con la terapia estándar, como el sorafenib, no solo para buscar sinergias terapéuticas sino también para evitar resistencias que parecen inevitables en la actualidad.
Juan Bayo, Guillermo D. Mazzolini
Laboratorio de Terapia Génica, Instituto de Investigaciones en Medicina Traslacional, Facultad de Ciencias Biomédicas, CONICET- Universidad Austral, Argentina
e-mail: gmazzoli@austral.edu.ar
Bibliografía
1. Maluccio M, Covey A. Recent progress in understanding, diagnosing, and treating hepatocellular carcinoma. CA Cancer J Clin 2012; 62: 394-9.
2. Bitzer M, Horger M, Giannini EG, et al. Resminostat plus sorafenib as second-line therapy of advanced hepatocellular carcinoma – The SHELTER study. J Hepatol 2016; 65: 280-8.
3. Bruix J, Reig M, Sherman M. Evidence-based diagnosis, staging, and treatment of patients with hepatocellular carcinoma. Gastroenterology 2016; 150: 835-53.
4. Bruix J, Qin S, Merle P, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017; 389: 56-66.
5. Mazzolini G, Prieto J. Terapia génica de los tumores hepáticos. Medicina (B Aires) 2001; 61: 364-8.
6. Bayo J, Dalvi MP, Martinez ED. Successful strategies in the discovery of small-molecule epigenetic modulators with anticancer potential. Future Med Chem 2015; 7: 2243-61.
7. Dalvi MP, Wang L, Zhong R, et al. Taxane-platin-resistant lung cancers co-develop hypersensitivity to JumonjiC demethylase inhibitors. Cell Rep 2017; 19: 1669-84.
8. Roche J, Bertrand P. Inside HDACs with more selective HDAC inhibitors. Eur J Med Chem 2016; 121: 451-83.
9. Ning X, Shi Z, Liu X, et al. DNMT1 and EZH2 mediated methylation silences the microRNA-200b/a/429 gene and promotes tumor progression. Cancer Lett 2015; 359: 198-205.
10. Wahid B, Ali A, Rafique S, Idrees M. New insights into the epigenetics of hepatocellular carcinoma. Biomed Res Int 2017; 2017: 1609575.
11. Anestopoulos I, Voulgaridou GP, Georgakilas AG, Franco R, Pappa A, Panayiotidis MI. Epigenetic therapy as a novel approach in hepatocellular carcinoma. Pharmacol Ther 2015; 145: 103-19.
12. Yeo W, Chung HC, Chan SL, et al. Epigenetic therapy using belinostat for patients with unresectable hepatocellular carcinoma: a multicenter phase I/II study with biomarker and pharmacokinetic analysis of tumors from patients in the Mayo Phase II Consortium and the Cancer Therapeutics Research Group. J Clin Oncol 2012; 30: 3361-7.
13. Hong SH, Eun JW, Choi SK, et al. Epigenetic reader BRD4 inhibition as a therapeutic strategy to suppress E2F2-cell cycle regulation circuit in liver cancer. Oncotarget 2016; 7: 32628-40.