FEDERICO RODRÍGUEZ LUCCI, MATÍAS ALET, SEBASTIÁN F. AMERISO
Centro integral de Neurología Vascular, FLENI, Buenos Aires, Argentina
Resumen El accidente cerebrovascular (ACV) es la causa más común de convulsiones y epilepsia observada en estu-
dios poblacionales de adultos. Las convulsiones ocurren dentro de las 24 horas posteriores al ACV en un alto porcentaje de pacientes. La patogénesis de estas convulsiones de inicio temprano puede estar relacionada con cambios iónicos locales y liberación de altos niveles de neurotransmisores excito-tóxicos en el área lesionada. Una lesión permanente con cambios en la excitabilidad neuronal parece ser responsable de convulsiones de inicio tardío después del ACV. Los factores de riesgo más comúnmente identificados con el comienzo agudo o tardío de las convulsiones post ACV son la gravedad y la localización cortical. La mayoría de las convulsiones post ACV son focales al inicio pero pueden generalizarse secundariamente, el estatus epiléptico es poco frecuente. La eficacia de las drogas antiepilépticas para estas convulsiones no ha sido rigurosamente evaluada en estudios controlados, aunque la mayoría de las convulsiones pueden ser controladas con un solo agente. Dada la frecuencia relativamente baja de convulsiones recurrentes después del ACV y la ausencia de predictores absolutos de epilepsia post ACV, la decisión de cuándo tratar a los pacientes con una convulsión después de un ACV es difícil.
Palabras clave: epilepsia, ACV, crisis
Abstract Post-stroke epilepsy. Stroke is the most common cause of seizures and epilepsy in population stu-
ies of adults. Seizures occur within 24 hours of the stroke in a high percent of patients. The pathogenesis of these early-onset seizures may be related to local ion shifts and release of high levels of excitotoxic neurotransmitters in the area of ischemic injury. The risk of late-onset seizures may increase over time, an underlying permanent lesion that leads to persistent chnges in neuronal excitability appears to be responsible for late-onset seizures after stroke. The most consistently identified risk factors for acute and late post-stroke seizures are stroke severity and cortical location. Most seizures following stroke are focal at onset, but secondary generalization is common, particularly in patients with late-onset seizures. Status epilepticus is relatively uncommon. The efficacy of antiepileptic drugs for these post-stroke seizures has not been rigorously assessed in controlled trials, although most seizures can be controlled with a single agent. Given the relatively low frequency of recurrent seizures after stroke, and an absence of absolute predictors of poststroke epilepsy, the decision of when to treat patients for a post-stroke seizure is difficult.
Key words: epilepsy, stroke, seizures
Recibido: 13-IX-2017 Aceptado: 29-XII-2017
Dirección postal: Dr. Federico Rodríguez Lucci, Centro Integral de Neurología Vascular, FLENI, Montañeses 2325, 1428 Buenos Aires, Argentina
e-mail: frodriguezlucci@fleni.org.ar
Los accidentes cerebrovasculares (ACV) isquémicos y hemorrágicos, son la causa de epilepsia de inicio en la edad adulta en uno de cada diez casos. Esta cifra se eleva al 25% en mayores de 65 años en la mayoría de la series publicadas1. Además, los pacientes mayores de 50 años con epilepsia de reciente diagnóstico tienen un riesgo dos a tres veces mayor de sufrir un ACV en comparación a la población general, de acuerdo a estudios realizados especialmente en Europa y América del Norte1. En estos casos, la epilepsia podría ser secundaria a daño microangiopático con predisposición a eventos cerebrovasculares futuros2.
Debido a las consecuencias sociales y económicas de la epilepsia, las limitaciones para el manejo de vehículos y las problemáticas en el ámbito laboral, la prevención y el manejo de las crisis es fundamental. Conceptualmente, las crisis pueden dividirse en crisis sintomáticas agudas (CSA) y crisis no provocadas (CNP), dependiendo del momento del evento. La Liga Internacional Contra la Epilepsia (ILAE) define a la CSA como aquella que ocurre dentro de la primera semana luego del ACV, mientras que las CNP se manifiestan pasado este tiempo. Un paciente tiene diagnóstico de epilepsia cuando sufre al menos una CNP y tiene predisposición a crisis subsiguientes. Por lo tanto, ante una primera CNP luego de un ACV, el caso cumple criterios de epilepsia post-ACV3.
Distintos estudios epidemiológicos muestran que la frecuencia de CSA luego de un ACV es del 3 al 6%. La cifra es mayor en pacientes con hemorragia intracerebral (hematomas intraparenquimatosos, hemorragia subaracnoidea). Se han descrito algunos factores de riesgo independientes que establecen mayor predisposición a una CSA, tales como el compromiso cortical, la mayor gravedad del ACV y la transformación hemorrágica del ACV isquémico4.
En Italia, Procaccianti y col. informaron un 10 a 12% de casos de CNP (o epilepsia post-ACV) luego de un ACV, en el seguimiento de 5 a 10 años. El riesgo es similar en eventos isquémicos o hemorrágicos. Algunos factores como el compromiso cortical, el tamaño del ACV y la edad avanzada se relacionan con mayor riesgo de primera crisis o recurrencia5.
Otro grupo de riesgo son aquellos pacientes con hemorragia subaracnoidea (HSA) y hemorragia intraparenquimatosa (HIP) asociada (33% a 5 años)6. Los infartos extensos, con desviación de línea media y necesidad de craniectomía también tienen un riesgo mayor (45% en el primer año). De acuerdo a estudios realizados en Israel, la incidencia de crisis en infartos lacunares es muy baja, menor al 1%. No se ha informado diferencia en la frecuencia de crisis secundarias a infartos por compromiso de grandes vasos en comparación a infartos embólicos7.
El tipo de crisis es variable, siendo un 60% de tipo parcial y un 40% con generalización tónico-clónica. De las parciales, 75% son motoras puras y el resto con generalización posterior7.
Actualmente, no existe un consenso claro acerca de la indicación de profilaxis primaria o secundaria con drogas antiepilépticas (DAE), tanto en las CSA como en las CNP posteriores al ACV8. No hay estudios que justifiquen el uso de DAE como medida de prevención contra la ocurrencia de una primer CNP posterior en ninguno de estos escenarios6. Existen pocas guías que den recomendaciones en este tópico. La guía de la Organización Europea de Stroke (ESO), publicada a principios de 2017 brinda recomendaciones que en su mayoría carecen de evidencia avalada por estudios aleatorizados controlados, proviniendo principalmente de estudios observacionales y recomendaciones de expertos9.
Prevención en pacientes que no han tenido crisis
Profilaxis primaria con una droga antiepiléptica en pacientes con ACV isquémico o hemorrágico
Un estudio aleatorizado, comparó la eficacia del valproato contra placebo como profilaxis primaria en pacientes con HIP. Con 36 pacientes en cada grupo, no se halló diferencias significativas en relación a la prevención de CSA10.
Un estudio retrospectivo reciente evaluó el uso de levetiracetam como profilaxis de CSA luego de una HIP. Noventa y ocho pacientes recibieron tratamiento, utilizando levetiracetam en el 97%. Los investigadores no encontraron asociación con empeoramiento de la funcionalidad al alta o aumento de mortalidad, pero no brindan información acerca de la eficacia de la medicación como profilaxis11. Otro estudio, con 289 pacientes que recibieron profilaxis con levetiracetam luego de un ACV hemorrágico, mostró resultados similares respecto a funcionalidad al alta o mortalidad12.
En el caso de la HSA aneurismática, las recomendaciones actuales sugieren considerar, según criterio del médico tratante, el uso de DAE como profilaxis primaria, aunque con bajo grado de evidencia. No existe una recomendación particular sobre qué DAE utilizar, pero se debe evitar, de ser posible, el uso de fenitoína ya que algunos estudios mostraron peor pronóstico luego del uso de dicho fármaco. En el caso de haber iniciado la profilaxis, se recomienda que sea de corta duración (entre 3 a 7 días)13.
No existe aún evidencia que favorezca el uso de profilaxis primaria con DAE luego de otros tipos de ACV. Las consecuencias clínicas posteriores a una CSA son usualmente autolimitadas.
Si el paciente se encuentra dentro de los grupos de alto riesgo descritos, la opción de tratamiento a largo plazo con DAE deberá evaluarse en forma individualizada.
En caso de decidir administrar profilaxis primaria en ciertos subgrupos que puedan considerarse de mayor riesgo (ejemplo, HIP con compromiso cortical, HSA), la elección de la DAE primaria debería tener en cuenta la necesidad de una rápida dosis efectiva en el primer día de administración, y por vía endovenosa de preferencia. Si bien no existen estudios al respecto, las medicaciones que cumplen esta condición en monoterapia son levetiracetam, lacosamida, lamotrigina, carbamazepina, difenilhidantoína y valproato14.
Si se realizó profilaxis primaria con DAE, el tratamiento debería ser lo más corto posible y limitado a la etapa aguda9.
Por lo tanto, la evidencia actualmente es baja para sugerir que exista algún tratamiento que prevenga la aparición de una primera CSA o CNP post-ACV.
Otras estrategias
Existen algunos estudios que muestran que en pacientes con tratamiento previo con diuréticos el riesgo de crisis posterior a un ACV es menor. Las estatinas también han mostrado efecto potencialmente beneficioso. Algunos estudios prospectivos observacionales encontraron que aquellos pacientes con uso de estatinas previo a su ACV tuvieron un riesgo menor de crisis tempranas y epilepsia posterior. La cantidad de casos evaluados es baja y se requieren más estudios para confirmar estas asociaciones1.
Un estudio en sujetos tratados con trombolisis endovenosa evaluó si aquellos que recibieron el tratamiento agudo tuvieron menor posibilidad de crisis posterior. En un seguimiento a dos años, no mostró diferencia significativa entre ambos grupos15.
Control y tratamiento de la primera crisis sintomática aguda
En casos de crisis autolimitadas durante el evento isquémico agudo (definidas como aquellas con una duración menor a 5 minutos con restitución completa), no se recomienda administrar tratamiento posterior16. De haberse administrado, se recomienda suspender la DAE utilizada en forma progresiva dentro de los primeros 7 a 10 días.
Si la crisis dura más de 5 minutos, o el paciente presenta crisis subintrantes sin recuperación inter-crisis, se recomienda seguir el protocolo de manejo de status convulsivo (Fig.1). Se debe iniciar con administración de lorazepam endovenoso (EV) en infusión lenta, y si no se obtiene respuesta con el mismo se puede utilizar carga de fenitoína en forma e.v. Otras opciones disponibles para el tratamiento por vía e.v. en esta etapa son el fenobarbital, el ácido valproico, el levetiracetam y la lacosamida. Luego de 30 minutos en status, y de no haber obtenido respuesta con las DAE en la etapa anterior, se requiere iniciar ventilación asistida y utilizar drogas sedativas como el midazolam o el propofol, en dosis de carga.
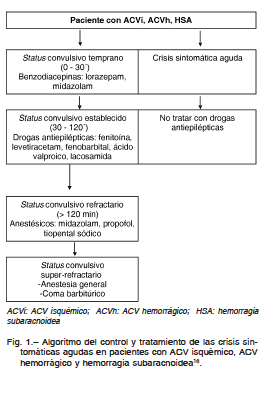
En los casos refractarios a esta estrategia, se debe inducir el coma barbitúrico con pentobarbital o tiopental16, 17.
Se deberá continuar con dosis de mantenimiento de la medicación que haya resultado efectiva para el tratamiento del status, con seguimiento clínico y electroencefalográfico para definir el descenso de las drogas sedativas, si éstas han sido empleadas.
Profilaxis secundaria con una DAE en pacientes que tuvieron al menos una CSA
El riesgo de repetición luego de una CSA (en la primera semana posterior al ACV) ronda entre el 10 y el 20%. No existen estudios aleatorizados sobre prevención de recurrencias. Algunos estudios observacionales muestran que la recurrencia es baja, por lo tanto, no se recomienda administrar DAE como prevención secundaria de crisis luego de una única CSA18.
Sin embargo, el inicio de DAE luego de una primer CSA post-ACV es muy frecuente en la práctica clínica. Si bien no es lo recomendado, en estos casos se debería optar por esquemas de corta duración, con un descenso programado y escalonado de la DAE administrada, de 7 a 10 días, luego de la etapa aguda.
En cambio, en HSA luego de una primera crisis, se recomienda el uso de DAE como profilaxis secundaria. La duración del tratamiento es variable y depende del estado del paciente, riesgo de recurrencia, crisis previas, presencia de hematoma asociado, hipertensión grave y también de la opinión del médico tratante19. Se sugiere un tratamiento mínimo de entre 3 a 6 meses, el cual puede suspenderse en ausencia de recurrencias. El levetiracetam es la droga recomendada en este escenario15.
Profilaxis secundaria con DAE en pacientes con una primer CNP
Crisis durante el periodo no agudo
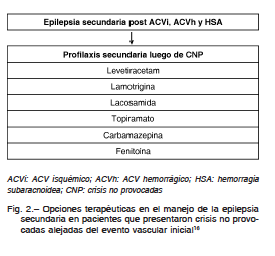
Se recomienda el uso de DAE como profilaxis secundaria en epilepsia post ACV para evitar la recurrencia de CNP. De acuerdo a las definiciones actuales de epilepsia de la ILAE, el paciente con una primer CNP y daño estructural secundario al ACV tiene una probabilidad del 60% de recurrencia de crisis en los primeros 10 años.
No existen estudios aleatorizados en este escenario. Estudios observacionales muestran un riesgo de recurrencia, luego de una primera CNP, de aproximadamente 70% en los primeros 10 años de seguimiento. Un estudio comparó la eficacia del tratamiento entre levetiracetam y carbamazepina, y otro comparó lamotrigina con carbamacepina20, 21. Luego de 12 meses de seguimiento, el tiempo libre de crisis fue similar con el uso de ambas estrategias.
Existen dos pequeños estudios prospectivos en donde se evaluó el uso de levetiracetam como monoterapia en pacientes con CNP y prevención de crisis posteriores. En ambos se mostró que aproximadamente 80% de los pacientes se mantuvieron libres de crisis durante el tiempo de seguimiento, con dosis entre 1000 a 2000 mg/día. El porcentaje de suspensión por efectos adversos (somnolencia fue la más frecuente) fue cercano al 15%22, 23.
Otro estudio reciente mostró que el levetiracetam es mejor tolerado que la carbamacepina, en la población añosa, en el tratamiento de la epilepsia post-ACV. La lamotrigina tuvo una eficacia similar a levetiracetam en este mismo estudio24.
Las drogas de primera generación como fenitoína, fenobarbital o benzodiazepinas pueden alterar o enlentecer la recuperación funcional de los pacientes luego del ACV18. Fenitoína, fenobarbital y carbamacepina, por ser inductores hepáticos, y el valproato, por tener alta unión a proteínas, pueden interferir con drogas utilizadas en la prevención secundaria del ACV como los anticoagulantes y antiagregantes plaquetarios. En pacientes añosos, además, el metabolismo hepático y la eliminación renal pueden estar afectadas. En contraste, los DAE como levetiracetam, lacosamida, lamotrigina, gabapentin y topiramato no han demostrado interacción significativa con dichas drogas y parecen tener menor impacto en la rehabilitación y el estado funcional posterior25. Las DAE se deben iniciar en dosis bajas con escalamiento gradual1.
El levetiracetam tiene varias características favorables, como el bajo nivel de interacciones, ausencia de metabolitos activos, corta vida media de eliminación y poco efecto sobre la función cognitiva o el sueño. La formulación por vía oral se absorbe rápidamente y en forma casi completa, con un pico plasmático a la hora. También puede administrarse por vía endovenosa, que es bioequivalente a la administración oral. Su vía de eliminación depende del metabolismo renal, por lo que debe ajustarse al clearance de creatinina. Permite así administrar altas dosis en el tratamiento agudo, con buena concentración en sangre a los pocos minutos de su infusión, la que se mantiene luego con dosis regladas26.
La lacosamida es un antagonista NMDA (N-metil-D-aspartato), que actúa en el sitio de enlace de la glicina, produciendo una inactivación lenta de canales de sodio voltaje-dependiente. Está aprobado para su uso en epilepsia de inicio parcial, tanto en monoterapia como en terapia adyuvante. Tiene buena absorción luego de la administración oral y alta biodisponibilidad, con máxima concentración plasmática en 1 a 4 horas. Los alimentos no afectan la velocidad y el grado de absorción. También se encuentra disponible para su administración por vía e.v., siendo bioequivalente al comprimido oral. Se elimina principalmente mediante excreción renal y biotransformación27. Un estudio prospectivo observacional evaluó la eficacia del uso de lacosamida por vía endovenosa en el manejo del status epiléptico post-ACV. Se incluyeron 16 pacientes mayores de 50 años. La lacosamida mostró una efectividad del 50% para la resolución del cuadro. En el tratamiento posterior se mantuvo lacosamida 300 mg por vía oral, sin recurrencias en 9 meses de seguimiento posterior 28. (Fig. 2)
Existen estudios que muestran que la recurrencia de crisis luego de la suspensión de DAE en estos pacientes es cercana al 50%29. Por lo tanto, la decisión de suspender la DAE debe ser evaluada en forma individualizada en cada caso, acorde a las características clínicas del paciente.
Efecto del tratamiento con DAE en el pronóstico, estado funcional o muerte a largo plazo
Algunos estudios aleatorizados evaluaron el estado funcional de los pacientes tratados con DAE luego de un ACV, comparados con placebo. Uno de ellos utilizó diazepam durante tres días, sin hallar mejoría en el estado funcional a los tres meses. Otro estudio utilizó valproico versus placebo por un mes, luego de una HIP, y halló leve mejora en la escala NIHSS a 12 meses30. Y otro comparó la administración de levetiracetam durante 12 semanas posterior al ACV comparado contra placebo, pero no llegó a completarse por bajo reclutamiento de pacientes31.
Dos estudios aleatorizados no mostraron efectos de DAE sobre la mortalidad luego de una crisis post ACV32.
En conclusión, no existen evidencias consistentes que demuestren beneficio o perjuicio de las DAE en el estado funcional o la mortalidad posterior a un ACV. Con el constante crecimiento de la especialización en el área de la neurología y las enfermedades cerebrovasculares, y la alta prevalencia de esta enfermedad en nuestra población, el manejo de las CSA y las CNP posteriores a un ACV es un motivo frecuente de consulta tanto en la hospitalización como en el seguimiento ambulatorio.
Existe aún controversia sobre la necesidad de prevención primaria de las crisis, y su relación con pronóstico o mortalidad. Se necesitan más estudios que evalúen el impacto real de las crisis en la función neurológica y el daño neuronal. Por el momento, la única indicación formal de DAE es en pacientes con CNP y diagnóstico de epilepsia post-ACV, teniendo el resto de las indicaciones evidencia limitada.
No existen estudios comparativos convincentes entre las diferentes DAE. La tendencia actual, basada en opinión de expertos y estudios observacionales, es el uso de levetiracetam, lamotrigina y lacosamida. Estos son opciones elegidas por su biodisponibilidad, rápido inicio de acción y bajo riesgo de efectos adversos. La inclusión de pacientes con epilepsia post-ACV en estudios prospectivos y aleatorizados podría brindar mayor evidencia acerca de las DAE más efectivas.
Estos estudios podrán aportar además un avance sustancial en la prevención, el tratamiento en la fase aguda y la profilaxis posterior a una crisis en pacientes con ACV.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Zelano J. Poststroke epilepsy: update and future directions. Ther Adv Neurol Disord 2016; 9: 424-35.
2. Cleary P, Shorvon S, Tallis R. Late-onset seizures as a predictor of subsequent stroke. Lancet 2004; 363: 1184-6.
3. Beghi E, Carpio A, Forsgren L, et al. Recommendation for a definition of acute symptomatic seizure. Epilepsia 2010; 51: 671-5.
4. Roivainen R, Haapaniemi E, Putaala J, Kaste M, Tatlisumak T. Young adult ischaemic stroke related acute symptomatic and late seizures: risk factors. Eur J Neurol 2013; 20: 1247-5.
5. Procaccianti G, Zaniboni A, Rondelli F, Crisci M, Sacquegna T. Seizures in acute stroke: incidence, risk factors and prognosis. Neuroepidemiology 2012; 39: 45-50.
6. Santamarina E, Sueiras M, Toledo M, et al. Epilepsy in patients with malignant middle cerebral artery infarcts and decompressive craniectomies. Epilepsy Res 2015; 112: 130-6.
7. Gilad R. Management of seizures following a stroke. Drugs Aging 2012; 29: 533-8.
8. Sykes L, Wood E, Kwan J. Antiepileptic drugs for the primary and secondary prevention of seizures after stroke. Cochrane Database Syst Rev 2014; CD005398.
9. Holtkamp M, Beghi E, Benninger F, et al. European Stroke Organisation guidelines for the management of post-stroke seizures and epilepsy. European Stroke Journal 2017; 2: 103-5.
10. Gilad R, Boaz M, Dabby R, Sadeh M, Lampl Y. Are post intracerebral hemorrhage seizures prevented by anti-epileptic treatment? Epilepsy Res 2011; 95: 227-1.
11. Mackey J, Blatsioris AD, Moser EAS, et al. Prophylactic anticonvulsants in Intracerebral hemorrhage. Neurocrit Care 2017; 27: 220-8.
12. Sheth KN, Martini SR, Moomaw CJ, et al. Prophylactic antiepileptic drug use and outcome in the ethnic/racial variations of intracerebral hemorrhage study. Stroke 2015; 46: 3532-5.
13. Diringer MN, Bleck TP, Claude Hemphill J 3rd, et al. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the Neurocritical Care Society’s Multidisciplinary Consensus Conference. Neurocrit Care 2011; 15: 211-40.
14. Rowan AJ, Ramsay RE, Collins JF, et al. New onset geriatric epilepsy: a randomized study of gabapentin, lamotrigine, and carbamazepine. Neurology 2005; 64: 1868-3.
15. Gensicke H, Seiffge DJ, Polasek AE, et al. Long-term outcome in stroke patients treated with IV thrombolysis. Neurology 2013; 80: 919-5.
16. Bernater R, Calle A, Campanille V, et al. Status epiléptico: actualización en consideraciones clínicas y guías terapéuticas. Neurología Argentina 2013; 5: 117-8.
17. Brophy GM, Bell R, Claassen J, et al. Guidelines for the evaluation and management of status epilepticus. Neurocrit Care 2012; 17:3-23.
18. Leung T, Leung H, Soo YOY, Mok VCT, Wong KS. The prognosis of acute symptomatic seizures after ischaemic stroke. J Neurol Neurosurg Psychiatry 2016; 88:86-4.
19. Connolly ES Jr, Rabinstein AA, Carhuapoma JR, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2012; 43: 1711-7.
20. Consoli D, Bosco D, Postorino P, et al. Levetiracetam versus carbamazepine in patients with late poststroke seizures: a multicenter prospective randomized open-label study (EpIC Project). Cerebrovasc Dis 2012; 34: 282-9.
21. Gilad R, Sadeh M, Rapoport A, Dabby R, Boaz M, Lampl Y. Monotherapy of lamotrigine versus carbamazepine in patients with poststroke seizure. Clin Neuropharmacol 2007; 30: 189-5.
22. Belcastro V, Costa C, Galletti F, et al. Levetiracetam in newly diagnosed late-onset post-stroke seizures: a prospective observational study. Epilepsy Res 2008; 82: 223-6.
23. Kutlu G, Gomceli YB, Unal Y, Inan LE. Levetiracetam monotherapy for late poststroke seizures in the elderly. Epilepsy Behav 2008;13: 542-4.
24. Werhahn KJ, Trinka E, Dobesberger J, et al. A randomized, double-blind comparison of antiepileptic drug treatment in the elderly with new-onset focal epilepsy. Epilepsia 2015; 56: 450-9.
25. Marigold R, Günther A, Tiwari D, Kwan J. Antiepileptic drugs for the primary and secondary prevention of seizures after subarachnoid haemorrhage. Cochrane Database Syst Rev 2013; CD008710.
26. Shetty AK. Prospects of levetiracetam as a neuroprotective drug against status epilepticus, traumatic brain injury, and stroke. Front Neurol 2013; 4: 172.
27. Strzelczyk A, Zöllner JP, Willems LM, et al. Lacosamide in status epilepticus: systematic review of current evidence. Epilepsia 2017; 58: 933-50.
28. Belcastro V, Vidale S, Pierguidi L, et al. Intravenous lacosamide as treatment option in post-stroke non convulsive status epilepticus in the elderly: a proof-of-concept, observational study. Seizure 2013; 22: 905-7.
29. Lossius MI, Hessen E, Mowinckel P, et al. Consequences of antiepileptic drug withdrawal: a randomized, double-blind study (Akershus Study). Epilepsia 2008; 49: 455-3.
30. Naidech AM, Garg RK, Liebling S, et al. Anticonvulsant use and outcomes after intracerebral hemorrhage. Stroke 2009; 40: 3810-5.
31. Taylor S, Heinrichs RJ, Janzen JM, Ehtisham A. Levetiracetam is associated with improved cognitive outcome for aatients with intracranial hemorrhage. Neurocrit Care 2010; 15: 80-4.
32. van Tuijl JH, van Raak E, de Krom M, Lodder J, Aldenkamp A. Early treatment after stroke for the prevention of late epileptic seizures: a report on the problems performing a randomised placebo-controlled double-blind trial aimed at anti-epileptogenesis. Seizure 2011; 20: 285-1.
33. Walker MC. Diagnosis and treatment of nonconvulsive status epilepticus. CNS Drugs 2001; 15: 931-9.
