VIRGINIA S. MIRETTI1, RODOLFO A. ÁVILA1, JEREMÍAS T. SIERRA1, JUAN JOSÉ GARCÍA1,
MARÍA VICTORIA LABORIÉ2
1Servicio de Oncología, 2Servicio de Anatomía Patológica, Hospital Universitario Privado de Córdoba, Argentina
Resumen El cáncer de próstata es una causa extremadamente rara de síndrome de secreción inadecuada de hormona antidiurética (SIADH). Se trata de tumores agresivos asociados a un síndrome que puede aparejar consecuencias graves. Un paciente de 64 años fue diagnosticado de adenocarcinoma de próstata Gleason 4+3: 7 en 2014 y recibió terapia de bloqueo hormonal. En 2015 debió ser ingresado por hiponatremia sintomática y se le diagnosticó un SIADH, sin otra causa probable más que el cáncer de próstata. Sufrió rápida progresión de su enfermedad oncológica, llamativamente cuando su PSA se encontraba en valores normales, y falleció al corto plazo. Existe gran variabilidad clínica e histopatológica de los casos informados en la literatura de asociación de carcinoma de próstata y SIADH, sin embargo, todos coinciden en la agresividad de estos tumores. Estas características se presentan en tumores con diferenciación neuroendocrina, frecuentemente resistentes al tratamiento hormonal y que pueden presentar síndromes paraneoplásicos como el SIADH. El perfil de sus alteraciones moleculares se encuentra en estudio para el desarrollo de terapias target. La asociación de adenocarcinoma de próstata y SIADH es muy infrecuente y podría implicar diferenciación neuroendocrina. Por tal motivo es esencial una nueva biopsia del tumor o de sus metástasis a la progresión de la enfermedad para poder conducir un tratamiento adecuado de acuerdo a sus características morfológicas, inmunohistoquímicas y, en un futuro, moleculares.
Palabras clave: carcinoma de próstata, síndrome de secreción inadecuada de hormona antidiurética (SIADH), carcinoma neuroendocrino de la próstata
Abstract Prostate carcinoma and syndrome of inappropriate antidiuretic hormone secretion. Prostate cancer is an extremely rare cause of syndrome of inappropriate antidiuretic hormone (SIADH) secretion. These tend to be aggressive tumors and SIADH can carry serious clinical consequences. A 64 years old patient was diagnosed with Gleason 4+3: 7 prostate adenocarcinoma in December 2014 and received hormonal blockade therapy. By March 2015 he was admitted for symptomatic hyponatremia and SIADH secretion was diagnosed, with no other probable cause than prostate cancer. He suffered a rapid progression of his oncologic disease, surprisingly with PSA in normal range, and died in the short term. There is great clinical and histopathological variability in the cases reported in the literature of association of prostate carcinoma and SIADH. However, they all agree on the aggressiveness of these tumors. This characteristic is present in tumors that have neuroendocrine features. They are frequently resistant to hormonal treatment and may present with paraneoplastic syndromes such as SIADH. The profile of its molecular alterations is under study for the development of target therapies. The association of prostate adenocarcinoma and SIADH is very uncommon and could involve neuroendocrine differentiation. For this reason, it is essential to perform a new biopsy of the tumor or its metastases at the progressive disease in order to conduct an appropriate treatment according to its morphological, immunohistochemical and, in the future, molecular characteristics.
Key words: prostate carcinoma, syndrome of inappropriate antidiuretic hormone secretion (SIADH), neuroendocrine carcinoma of the prostate
Recibido: 20-III-2017 Aceptado: 30-IV-2018
Dirección postal: Dra. Virginia S. Miretti, Servicio de Oncología, Hospital Universitario Privado de Córdoba, Naciones Unidas 346, 5000 Córdoba, Argentina
e-mail: virginiamiretti85@gmail.com
El síndrome de secreción inapropiada de hormona antidiurética (SIADH) constituye una de las causas más frecuentes de hiponatremia en los pacientes internados. Puede estar asociado a efectos medicamentosos o afecciones clínicas benignas o malignas. El cáncer que con mayor frecuencia se asocia a SIADH es el carcinoma de células pequeñas de pulmón. El cáncer de próstata es una causa extremadamente rara de este síndrome.
Existen en la literatura casos individuales de esta asociación desde 1969, con gran variabilidad en las características clínicas e histopatológicas1-9. Siendo que se trata de tumores particularmente agresivos asociados a un síndrome clínico que puede aparejar graves consecuencias, presentamos el caso de un paciente con diagnóstico de cáncer de próstata que desarrolló SIADH y con evolución agresiva de su enfermedad neoplásica.
Caso clínico
Se trata de un paciente con antecedentes de hipertensión, hipotiroidismo y mielitis transversa con paraparesia secuelar. Medicado con nifedipina, levotiroxina, carvedilol y espironolactona.
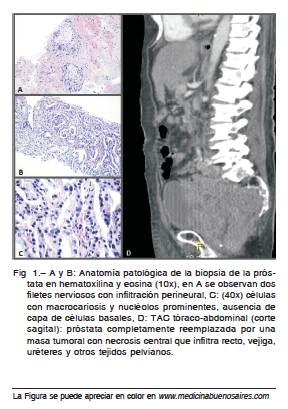
A sus 64 años, a fines de 2014, fue diagnosticado en otra institución, por punción-biopsia, de adenocarcinoma de próstata, estadio IIA (T2bN0M0), PSA 13 ng/ml, Gleason 4+3: 7 con invasión perineural (Fig. 1 A, B y C). Se realizó un centellograma y una TAC tóraco-abdomino-pelviana que fueron negativos para enfermedad a distancia. Realizó tratamiento con radioterapia por 2 meses (78 Gy) y quedó en observación. Inicialmente presentó PSA en descenso y posteriormente, ascenso (115 ng/ml en octubre 2015) coincidente con la aparición de síntomas digestivos y febrículas vespertinas. El sodio fue de 135 mmol/l. La TAC objetivó la próstata de tamaño normal, múltiples adenopatías pelvianas (40 mm la mayor) y un centellograma óseo mostró múltiples metástasis óseas. Ante este nuevo estadio avanzado se indicó tratamiento con bicalutamida 50mg/día por 4 semanas, y a los 15 días inició goserelin 3.6 mg SC cada 30 días. A los pocos días presentó marcada mejoría sintomática y tras 3 meses de goserelin el PSA descendió a 3.83 ng/ml.
Tras la cuarta aplicación, en marzo 2016, sufrió una convulsión generalizada tónico-clónica. Por TAC y RMN de cerebro se descartaron lesiones agudas. Los datos relevantes del laboratorio fueron: leucocitos: 12 400, sodio: 118 mmol/l, cloro: 65 mmol/l, osmolaridad: 251 mosm/l, calcio iónico: 1.05 m mol/l, creatinina 0.88 mg/dl, glucosa 167 mg/dl. La muestra de orina aislada informó: sodio: 109 mmol/l, creatinina: 23 mg/dl, urea: 3.4 g/l, osmolaridad urinaria: 344 mosmol/l. El cortisol y TSH se encontraron dentro de parámetros normales y la testosterona estaba correctamente bloqueada (12 ng/dl). El PSA persistió en un nivel bajo, de 3.9 ng/ml.
Al tratarse de una hiponatremia hipoosmolar euvolémica sintomática se inició tratamiento con cloruro de sodio al 3%. Se cumplieron los criterios diagnósticos del síndrome de secreción inadecuada de hormona antidiurética y por ende se indicó también restricción hídrica a 500 ml por día. Evolucionó favorablemente con ascenso gradual del sodio y fue dado de alta con indicación de continuar restricción hídrica. Posteriormente la natremia se mantuvo normal-baja.
En junio 2016 consultó nuevamente, esta vez por oclusión intestinal. En la TAC con contraste EV se observó que la próstata se encontraba completamente reemplazada por una masa tumoral con necrosis central que infiltraba recto, vejiga, uréteres y otros tejidos pelvianos (Fig. 1D), por lo que fue sometido a colostomía y nefrostomías percutáneas bilaterales. Cursó una internación prolongada y finalmente falleció como consecuencia de complicaciones infecciosas y deterioro general.
Discusión
La asociación de SIADH y carcinoma de próstata es infrecuente y son escasas las publicaciones. Se consideraron en primer lugar las causas más frecuentes de SIADH y por tal motivo se realizó una TAC de tórax que descartó un carcinoma pulmonar de células pequeñas. Se consideraron también las causas farmacológicas; sin embargo, no existen en la literatura ni en las comunicaciones sobre la prescripción, informes de SIADH asociado a bicalutamida o goserelin, y además la natremia se mantuvo estable posteriormente a pesar de haber continuado con goserelin. El resto de la medicación administrada era prolongada y no existió por lo tanto la asociación temporal.
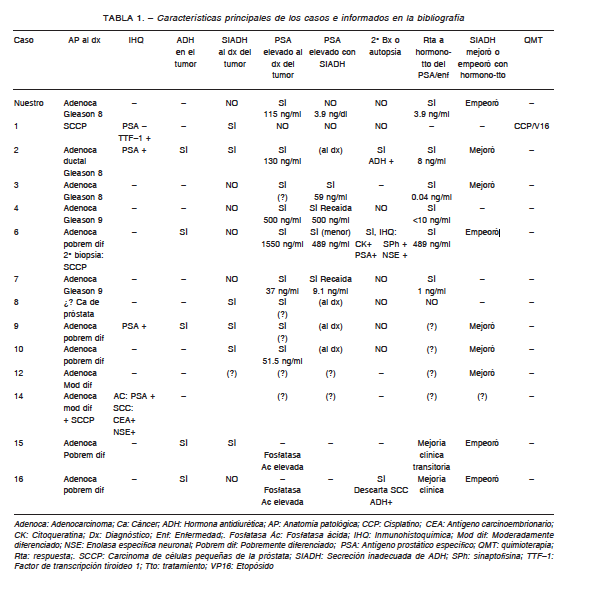
Existe gran variabilidad en las características clínicas e histopatológicas de los casos comunicados en la literatura de asociación de carcinoma de próstata y SIADH (Tabla 1). Sin embargo, los autores coinciden en general en la agresividad de estos tumores, que se manifiesta en la corta supervivencia global de 1 a 12 meses. En dichos casos el SIADH fue diagnosticado en diferentes etapas de la evolución de la enfermedad y la respuesta a los tratamientos hormonales fue variable. Existen evidencias que indican que ciertos grupos de células tumorales productoras de ADH expresan receptores androgénicos, mientras que otros grupos no los expresan, y por ende son seleccionados tras el bloqueo hormonal. Este comportamiento disímil nos da una idea de la heterogeneidad de esta asociación, lo que se refleja también en las diferencias anátomo-patológicas de los tumores de los casos informados.
En dicho sentido, la histología del tumor primario puede ser variada, y se mencionan el adenocarcinoma, el adenocarcinoma con diferenciación neuroendocrina, el carcinoma de células pequeñas de la próstata, y un caso de adenocarcinoma ductal1-9. La mayoría de los adenocarcinomas tuvieron un score de Gleason de 8 o más, y otros fueron moderadamente diferenciados. La producción hormonal por las células prostáticas tumorales hace pensar en cierta diferenciación neuroendocrina. Existen en el tejido prostático normal células neuroendocrinas con variable expresión de receptores androgénicos y PSA10.
Los carcinomas neuroendocrinos de la próstata (CNEP) presentan altas tasas de proliferación tumoral, mayor resistencia hormonal, y mayor agresividad. Los que se presentan con enfermedad metastásica tienen una supervivencia de 9.8 a 13.1 meses10. Más del 50% de estos tumores no son puros y se asocian al adenocarcinoma. En la clasificación de la OMS del 2016 los CNEP se dividen en adenocarcinoma con diferenciación neuroendocrina, tumor neuroendocrino bien diferenciado, carcinoma neuroendocrino de células pequeñas y carcinoma neuroendocrino de células grandes.
Se plantean 3 hipótesis acerca de su origen: las células neuroendocrinas normales, las del adenocarcinoma, de células madres pluripotenciales. En ocasiones el tumor expresa marcadores epiteliales y neuroendocrinos en las pruebas por IHQ, sugiriendo una diferenciación hacia ambas líneas celulares1, 6, 10.
El adenocarcinoma con diferenciación neuroendocrina se caracteriza por focos dispersos de células neoplásicas con expresión neuroendocrina por IHQ, y se da en el 5-10% de los adenocarcinomas de próstata, preferentemente con Gleason alto11. Pueden ser primarios o más frecuentemente aparecer tras el tratamiento de deprivación hormonal,
con promedio en 20 meses, como un fenómeno de resistencia. Se cree que la diferenciación aumenta a medida que la enfermedad progresa y su presencia constituye un factor de mal pronóstico10.
La caracterización molecular de los tumores resistentes a la castración ha podido demostrar que un 50% de éstos presenta amplificación o mutación de los receptores androgénicos. Además, se demostró que la vía PTEN/PI3K se encuentra activada en 50% de los tumores y que el bloqueo androgénico estimula su activación, motivo por el cual se ha propuesto un bloqueo simultáneo12. En 2011 se publicó el descubrimiento de dos genes (aurora quinasa A y N-Myc) expresados en un 40% de los CNEP, mientras que solo se evidenciaron en el 5% de los adenocarcinomas de la próstata y en ninguno de los extendidos de tejido normal. Cuando el oncogén aurora quinasa A, desregula a N-Myc, conduce a las células a transformarse en células neuroendocrinas con cualidades de crecimiento rápido y descontrolado. Existe un estudio clínico fase II en marcha con un inhibidor de la actividad de Aurora quinasa A para cáncer de próstata neuroendocrino metastásico hormono-resistente, aunque por el momento los resultados no han sido alentadores12, 13. También se investiga el bloqueo de las proteínas anti-apoptóticas para lograr inducir la apoptosis de las células neoplásicas a través de este inhibidor14.
La asociación de adenocarcinoma de próstata y SIADH es muy infrecuente y podría implicar la existencia de diferenciación neuroendocrina. Siendo que nuestro paciente no fue sometido a cirugía al diagnóstico ni a segunda biopsia tras la progresión de la enfermedad, desconocemos si la presentó en algún sector de su tumor o momento de su evolución. Sin embargo, a juzgar por el SIHAD y la agresividad de su tumor con un nivel bajo de PSA, esta diferenciación probablemente haya estado presente y hubiese sido de vital importancia la obtención de una segunda biopsia. Existen muchas dudas acerca de la anatomía patológica, evolución clínica y respuesta al tratamiento hormonal de estos tumores que se irán dilucidando gradualmente, ya que es un tema de marcado interés. Tampoco conocemos si estos tumores deberían recibir un tratamiento más acorde a esta estirpe originada en otros tejidos del cuerpo. A la luz de los nuevos descubrimientos, y siguiendo los consejos de Tagawa15, es esencial llevar a cabo una nueva biopsia del tumor o de sus metástasis a la progresión de la enfermedad para poder conducir un tratamiento más adecuado. Principalmente en aquellos pacientes resistentes a la castración que progresan rápido o en sitios no habituales, sobre todo si su nivel de PSA es desproporcionadamente bajo para la carga de enfermedad.
Agradecimientos: A la Dra. Liliana Gelman, especialista en Anatomía Patológica por su participación en el diagnóstico anátomo-patológico
Conflictos de intereses: Ninguno que declarar
Bibliografía
1. Lee WY, Butt M, Campbell A, Greenstone M. Small cell carcinoma of the prostate and the syndrome of inappropriate antidiuretic hormone: a rare entity and presentation. Isr Med Assoc J 2014; 16: 458-60.
2. Shaaban H, Thomas D, Guron G. A rare case of metastatic ductal type prostate adenocarcinoma presenting with syndrome of inappropriate secretion of antidiuretic hormone: a case report and review. J Cancer Res Ther 2012; 8: 308-10.
3. Pérez-Llantada Amunarriz E, Acha Salazary O, Tejido García R. Síndrome de secreción inadecuada de hormona antidiurética y cáncer de próstata: una asociación muy infrecuente. Rev Clin Esp 2010; 210: 200-7.
4. Lee KS, Kang TW, Ma SK, Kim SW, Kim NH, Choi KC. SIADH associated with prostate cancer. Electrolyte Blood Press 2007; 5: 47-9.
5. Bogdanos J, Karamanolakis D, Milathianakis C, Koutsilieris M. Syndrome of inappropriate antidiuretic hormone secretion in a patient with hormone refractory prostate cancer. Anticancer Res 2003; 23: 1755-6.
6. Kawai S, Hiroshima K, Tsukamoto Y, et al. Small cell carcinoma of the prostate expressing prostate-specific antigen and showing syndrome of inappropriate secretion of antidiuretic hormone: an autopsy case report. Pathol Int 2003; 53: 892-6.
7. Garzotto M, Beer TM. Syndrome of inappropriate antidiuretic hormone secretion: a rare complication of prostate cancer. J Urol 2001; 166: 1386.
8. Yalçin S, Erman M, Tekuzman G, Ruacan S. Syndrome of inappropriate antidiuretic hormone secretion (SIADH) associated with prostatic carcinoma. Am J Clin Oncol 2000; 23: 384-5.
9. Ito H, Nishimura T, Abe H, et al. Adenocarcinoma of the prostate with ectopic antidiuretic hormone production: a case report. Hinyokika Kiyo 2000; 46: 499-503.
10. Parimi V, Goyal R, Poropatich K, Yang XJ. Neuroendocrine differentiation of prostate cancer: a review. Am J Clin Exp Urol 2014; 2: 273-85.
11. Wang HT, Yao YH, Li BG, Tang Y, Chang JW, Zhang J. Neuroendocrine prostate cancer (NEPC) progressing from conventional prostatic adenocarcinoma: factor associated with time to development of NEPC and survival from NEPC diagnosis. A systematic review and pooled analysis. J Clin Oncol 2014; 32: 3383-90.
12. Roychowdhury S, Chinnaiyan AM. Advancing precision medicine for prostate cancer through genomics. J Clin Oncol 2013; 31: 1866-73.
13. Beltran H, Rickman DS, Park K, et al. Molecular characterization of neuroendocrine prostate cancer and identification of new drug targets. Cancer Discov 2011; 1: 487-95.
14. Hilton JF, Shapiro GI. Aurora Kinase inhibition as an anticancer strategy. J Clin Oncol 2014; 32: 57-9.
15. Tagawa, ST. Neuroendocrine prostate cancer after hormonal therapy: knowing is half the battle. J Clin Oncol 2014; 32: 3360-4.
