ALEJANDRA T. RABADÁN, DIEGO HERNÁNDEZ
División Neurocirugía, Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires, Argentina
Resumen Los tumores del tronco cerebral son infrecuentes en la población adulta. Las controversias surgen cuando se considera la necesidad de confirmar el diagnóstico histopatológico en esta área elocuente del cerebro, balanceando los beneficios de obtener un diagnóstico certero y las desventajas de los procedimientos invasivos. Existen escasas publicaciones acerca de su tratamiento quirúrgico en adultos, todas series pequeñas analizadas retrospectivamente. Presentamos nuestra experiencia con el propósito de contribuir al proceso de toma de decisiones. Diez de 13 pacientes fueron intervenidos. Las lesiones se clasificaron en focales (n:7), infiltrativa difusa (n:1), tectal (1) y exofítica (1). El estado neurológico según la escala Karnofsky Performance Status fue ≥ 70 en 6 casos y < 70 en 7. Las muestras fueron obtenidas mediante abordaje microquirúrgico directo o por biopsia estereotáctica. Los hallazgos histopatológicos fueron confirmados en todos los casos: astrocitoma pilocítico (n:1), glioma de bajo grado (n:1), glioblastoma (n:1), hemangioblastoma celular (n:1), subependimoma (n:1), disgerminoma (n:1), y lesiones pseudotumorales (n:4, 3 cavernomas, 1 pseudotumor inflamatorio). La amplia variedad de hallazgos patológicos en esta localización en adultos exige una precisa definición histopatológica, que no solo determina la terapéutica adecuada sino que también previene las consecuencias potencialmente catastróficoas de los tratamientos empíricos.
Palabras clave: tumores del tronco cerebral, adulto, biopsia, cirugía
Abstract Relevance of histopathological diagnosis in the treatment of brainstem lesions in adults. Brainstem tumors are uncommon beyond childhood. Controversies arise regarding the need of histological diagnosis in this eloquent area of the brain, weighting the benefits of a reliable diagnosis against the disadvantages of invasive procedures. There are scant publications about the surgical management of brainstem tumors in adults, all of them involving small retrospective cohorts. We are reporting our experience with the aim of contributing to the decision making process. Out of a series of 13 patients, 10 were approached surgically. According to Guillamo´s classification the lesions were: focal (n:7), diffuse infiltrative (n:1), tectal (n:1), and exo- phytic (n:1). According to the Karnofsky Performance Status scale, the neurological status was ≥ 70 in 6 cases and < 70 in 7. Histopathology was confirmed in all 10 treated cases and the samples were obtained by a direct microsurgical approach or by stereotactic biopsy. Histopathological findings were: pilocytic astrocytoma (n:1), low grade glioma (n:1), glioblastoma (n:1), cellular haemangioblastoma (n:1), subependimoma (n:1), pseudotumoral lesions (n:4; 3 cavernomas, 1 inflammatory pseudotumor), and disgerminoma (n:1). As a broad variety of pa- thologies could be found in this brain localization, an accurate histopathological definition can not only determine the adequate therapy, but also avoid the disastrous consequences of empiric treatments.
Key words: brain stem tumors, adult, biopsy, surgery
Recibido: 4-V-2018 Aceptado: 26-VII-2018
Dirección postal: Alejandra T. Rabadán, Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina
e-mail: rabadan.alejandra@gmail.com
Los tumores del tronco cerebral representan aproximadamente el 10-15% de los tumores del sistema nervioso central (SNC) en niños, pero son infrecuentes en los adultos, motivo por el cual existe poca información sobre su diagnóstico y tratamiento más allá de la infancia1-5. En los niños suelen ser astrocitomas infiltrantes difusos con pésimo pronóstico en el corto plazo6-8. Es posible que la mala evolución en los niños haya desalentado su tratamiento en adultos. A partir de la década de 1990, y probablemente en relación con los avances en el diagnóstico por imágenes y las nuevas tecnologías intraoperatorias, comenzaron a aparecer publicaciones de lesiones troncales tratadas quirúrgicamente con éxito. Son series con pequeños números de casos y análisis retrospectivo que focalizan en la factibilidad técnica de los tratamientos5, 9-12. Surge entonces una controversia, especialmente en pacientes adolescentes y adultos, sobre la necesidad de confirmar el diagnóstico histopatológico considerando las dificultades de la cirugía y asumiendo que los riesgos podrían ser muy elevados debido a la complejidad anátomo-funcional de las estructuras comprometidas11, 13.
Debido a estas consideraciones, el objetivo del estudio ha sido evaluar la influencia que tuvo nuestro conocimien- to de la histopatología de los tumores del tronco cerebral sobre el tratamiento de los pacientes para contribuir a la toma de decisiones.
Materiales y métodos
Se evaluó retrospectivamente una cohorte de 13 pacientes con lesiones intrínsecas del tronco cerebral (1996-2016). Las edades oscilaron entre 27 y 66 años.
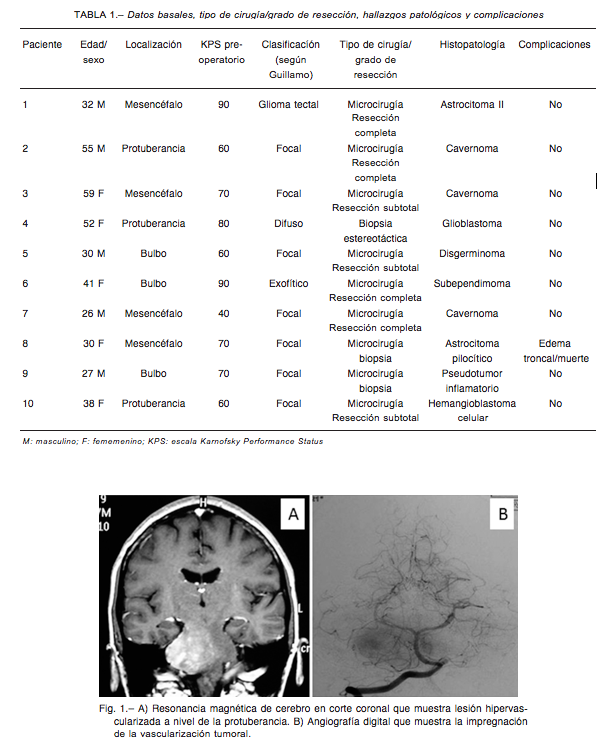
Los estudios por imágenes utilizados para el diagnóstico fueron resonancia magnética (RM) de cerebro y de todo el SNC con y sin gadolinio, RM con espectroscopía, tensor de difusión y tractografía en los últimos casos; angiografía por RM o por cateterismo en caso de sospecha de lesión vascular subyacente. Los estudios por imágenes fueron concluyentes en cuanto a localización de la lesión pero no pudieron predecir la histopatología. Las localizaciones fueron: mesencéfalo (n:6), protuberancia (n: 4), y bulbo raquídeo (n:3). De acuerdo a la clasificación de Guillamo, las lesiones fueron: I, difusa; II, focal; III, glioma tectal y IV, exofítico4. Diez pacientes tuvieron una lesión focal intrínseca, en uno la lesión fue difusa, en otro tectal, y en el restante exofítica.
El estado neurológico, medido con la escala Karnofsky Performance Status, fue ≥ 70 en 6 casos; y < 70 en 7 casos. Desde el punto de vista clínico e imagenológico, no fue posible alcanzar diagnósticos concluyentes como para definir conduc- ta terapéutica, siendo éste el fundamento para la obtención de material tisular mediante cirugía.
Se obtuvo confirmación histopatológica de la lesión en 10 casos. Nueve pacientes fueron sometidos a microcirugía obteniéndose resección completa en cinco casos, resección parcial en dos, biopsia directa microquirúrgica en dos y en uno el diagnóstico se confirmó mediante biopsia estereotáxica. No se confirmó el diagnóstico histopatológico en tres pa- cientes: (i) una con cáncer avanzado de mama, metástasis óseas y lesión metastásica cerebral única en protuberancia, quien fue tratada con radiocirugía, y (ii) dos con lesiones fo- cales intrínsecas pequeñas asintomáticas, quienes continúan bajo el régimen de observación y control periódico.
Resultados
Los hallazgos histopatológicos intraoperatorios en la congelación fueron: astrocitoma pilocítico (n:1), astroci- toma grado II (n:1), glioblastoma (n:1), cavernoma (n:3), hemangioblastoma celular (n:1), subependimoma (n:1), pseudotumor inflamatorio (n:1), y disgerminoma (n:1). Las afecciones fueron confirmadas por estudios histopa- tológicos diferidos. La extensión de la resección estuvo relacionada con la definición de la histopatología intrao- peratoria. La resección fue parcial en dos casos, completa en cuatro, y subtotal en un caso de hemangioblastoma celular (caso 10, Tabla 1, Figs. 1 y 2). En tres pacientes, se realizó solo biopsia. Dos de estos tres fueron sometidos a biopsia directa microquirúrgica, y uno fue tratado con biopsia estereotáxica. Hubo una complicación grave en una paciente tratada con biopsia directa microquirúrgica que falleció a las 96 horas postoperatorias debido a un cuadro de edema fatal de tronco cerebral. En el resto de los pacientes no hubo complicaciones atribuibles al procedimiento (Tabla 1).
De acuerdo a la histopatología, solo cuatro recibieron tratamiento específico complementario postoperatorio acorde a la lesión, los seis restantes no requirieron tra- tamientos ulteriores.
Discusión
Aunque la RM ha evolucionado significativamente en cuanto a sensibilidad diagnóstica en lesiones cerebrales, en el caso del tronco cerebral los diagnósticos histopato- lógicos no pueden ser confirmados con certeza mediante imágenes todavía14-16. La espectroscopía por RM muestra un grado variable de discordancia con la patología en esta localización, probablemente por el efecto de volu- men parcial del tejido normal adyacente y/o del líquido cefalorraquídeo7, 17, 18. Por tal motivo, las neuroimágenes no son lo suficientemente específicas como el diagnóstico histológico en esta región del SNC.
Se suma al concepto anterior el hecho de que el conocimiento anatómico preciso logrado en los últimos años, sumado a los aportes técnicos tales como cirugías guiadas por imágenes y neurofisiología intraoperatoria, representan importantes contribuciones sin las cuales el abordaje del tronco cerebral no sería posible. Respecto de la metodología para obtener el material histopatológico, la biopsia estereotáxica es un procedimiento mínimamente invasivo que se realiza habitualmente en los servicios de neurocirugía. Sin embargo, en el tronco cerebral solo puede realizarse con riesgo aceptable a nivel de la pro- tuberancia, estando contraindicado el procedimiento en lesiones altamente vascularizadas o en otras topografías del tronco cerebral, como mesencéfalo o bulbo raquídeo, en los cuales los riesgos estimados de la biopsia estereo- táxica son muy elevados, motivo por el cual es preferible la vía directa11, 19.
El desarrollo de la neuropatología en los últimos años representa también una importante contribución que en nuestra experiencia fue decisiva para determinar la ex- tensión de la resección20. Los resultados histopatológicos obtenidos en nuestro grupo de pacientes han sido muy variados y confirmados en los estudios diferidos, demos- trándose que muchas de las lesiones logran la curación exclusivamente con la resección lesional; en otros casos, la confirmación diagnóstica permitió aplicar el tratamiento específico adecuado a cada una de ellas.
Con respecto a los tratamientos específicos las conductas varían según el tipo histológico. El astrocitoma
tectal de bajo grado se opera solamente cuando es sintomático y, dado su curso relativamente benigno, no requiere tratamiento oncológico posterior21-24. El subepen- dimoma es un tumor muy infrecuente, considerado dentro de las lesiones gliales de bajo grado de malignidad, con comportamiento benigno desde el punto de vista oncoló- gico, cuyo único tratamiento cuando es sintomático es la resección quirúrgica12, 25-29. El disgerminoma es un tumor
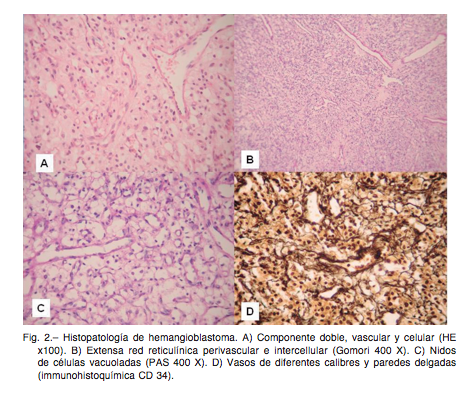
muy radiosensible y que responde a la quimioterapia específica con carboplatino, etopósido e ifosfamida, por lo que la confirmación de la biopsia es suficiente12, 30-34. Las lesiones inflamatorias pseudotumorales del SNC comprenden un amplio espectro de entidades no onco- lógicas, que suelen presentar dificultades diagnósticas mediante RM, aún con espectroscopía, y cuyo diagnóstico no siempre puede lograrse sin biopsia. Su confirmación diagnóstica es muy importante por la probable asociación con esclerosis múltiple, otras enfermedades desmielini- zantes, o linfomas35-40. El hemangioblastoma es un tumor histológicamente benigno asociado en el 20% de los casos a enfermedad de von Hippel Lindau. En el 80% de los casos son esporádicos y su origen es la inclusión de células progenitoras de hemangioblastoma en la capa molecular del cerebelo, afectando usualmente a adultos jóvenes. La enfermedad de von Hippel Lindau presenta una mutación en el gen supresor de tumores a nivel del cromosoma 3p25. El gen puede también estar mutado en 4%-14% de los casos de hemangioblastoma esporádico. Estas lesiones representan un desafío quirúrgico debido a su gran vascularización, similar a una malformación arte- riovenosa. Requiere un abordaje quirúrgico amplio como para permitir una resección circunferencial de la lesión. Es una lesión radiorresistente, por lo cual la radioterapia convencional no tiene indicación, y la radiocirugía no se recomienda como primera opción, excepto en casos de lesiones muy pequeñas, múltiples o residuales39-49. Los cavernomas representan el 5-10% de todas las malfor- maciones vasculares, con una prevalencia en el tronco cerebral del 4% al 35%, según las distintas series. Los potenciales efectos devastadores relacionados con el sangrado en esta localización del SNC han sugerido en los últimos años que los pacientes que han sufrido más de una hemorragia sintomática, o una única hemorragia grave, en el tronco cerebral se benefician de la resección quirúrgica del cavernoma, aun sin evidencia radiológica clara de malformación vascular, mientras que la radioci- rugía no ha demostrado efectividad terapéutica en estas lesiones hasta el momento50, 51.
En conclusión, la diversidad de hallazgos histopatológicos en la población adulta sostiene por sí misma la necesidad de conocer el diagnóstico preciso. Este conocimiento de la histopatología es crucial para deter- minar el tratamiento. Simultáneamente, permite evitar las consecuencias deletéreas, en ocasiones catastróficas, de los tratamientos médicos o radiantes empíricos.
Agradecimientos: Nuestro reconocimiento a los Dres. Gustavo Sevlever, Silvia Christiansen y Leonardo Paz por los estudios histopatológicos realizados.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Grigsby PW, Garcia DM, Simpson JR, Fineberg BB, Schwartz HJ. Prognostic factors and results of therapy for adult thalamic and brainstem tumors. Cancer 1989; 63: 2124-9.
2. Selvapandian S, Rajshekhar V, Chandy MJ. Brainstem glioma: comparative study of clinic-radiological presentation, pathology and outcome in children and adults. Acta Neurochir (Wien) 1999; 141: 721-7.
3. Association des Neuro-oncologues d’Expression Francoise (ANOCEF) Brain 2001; 124: 2528-39.
4. Guillamo JS, Monjour A, Taillander L, et al. Brainstem gliomas in adults: prognostic factors and classification. Brain 2001; 124: 2528-39.
5. Frazier JL, Lee J, Thomale UW, et al. Treatment of diffuse intrinsec brainstem gliomas: failed approaches and future strategies. J Neurosurg Pediatrics 2009; 3: 259-69.
6. Landolfi JC, Thaler HT, DeAngelis LM. Adult brainstem gliomas. Neurology 1998; 51: 1136-9.
7. Salmaggi A, Fariselli L, Milanesi I, et al. Natural history and management of brainstem gliomas in adults. A retrospective Italian study. J Neurol 2008; 255: 171-7.
8. Walker DA, Liu J, Kieran M, et al. A multi-disciplinary consensus statement concerning surgical approaches to low-grade, high-grade astrocytomas and diffuse intrinsic pontine gliomas in childhood (CPN Paris 2011) using the Delphi method. Neuro Oncol 2013; 15: 462-8.
9. Bricolo A, Turazzi S, Cristofori L, et al. Direct surgery for brainstem tumours. Acta Neurochir Suppl (Wien) 1991; 53: 148-58.
10. Pincus DW, Richter EO, Yachnis AT, et al. Brain stem stereotactic biopsy sampling in children. J Neurosurg 2006; 104 (2 Suppl): 108-14.
11. Lesniak MS, Klem JM, Weingart J, et al. Surgical outcome following resection of contrast-enhanced pediatric brainstem gliomas. Pediatr Neurosurg 2003; 39: 314-22.
12. Rabadán AT, Campero A, Hernandez D. Surgical application of the suboccipital subtonsillar approach to reach the Inferior half of medulla oblongata tumors in adult patients. Front Surg 2016; 2: 72.
13. Mursch K, Halatsch ME, Markakis E, et al. Intrinsec brain stem tumors in adults: results of microneurosurgical treatment of 16 consecutive patients. Br J Neurosurg 2005; 19: 128-36.
14. Schumacher M, Schulte-Monting J, Stoeter P, Warmuth- Metz M, Solymosi L. Magnetic resonance imaging compared with biopsy in the diagnosis of brainstem diseases of childhood: a multicenter review. J Neurosurg 2007; 106: 111-9.
15. Rachinger W, Grau S, Holtmannspotter M, Herms J, Tonn JC, Kreth FW. Serial stereotactic biopsy of brainstem lesions in adults impacting diagnostic accuracy compared with MRI only. J Neurol Neurosurg Psychiatry 2009; 80: 1134-9.
16. Sanai N, Wachhorst SP, Gupta NM, McDermott MW. Transcerebellar stereotactic biopsy for lesions of the brainstem and peduncles under local anesthesia. Neurosurgery 2008; 63: 460-6.
17. Boviatsis EJ, Kouyialis AT, Stranjalis G, Korfias S, Sakas DE. CT-guided stereotactic biopsies of brain stem lesions: personal experience and literature review. Neurol Sci 2003; 24: 97-102.
18. Massager N, Davi P, Goldman S. Combined magnetic resonance imaging and positron emission tomography-guided stereotactic biopsy in brainstem mass lesions: diagnostic yield in a series of 30 patients. J Neurosurg 2000; 93: 951-7.
19. Kondziolka D, Lundsford LD. Stereotactic biopsy for intrinsec lesions of the medulla through the long-axis of the brain stem: technical considerations. Acta Neurochir (Wien) 1994; 129: 89-91.
20. Theeler BJ, Ellezam B, Melguizo-Gavilanes I, et al. Adult brainstem gliomas: correlation of clinical and molecular features. J Neurol Sci 2015; 353: 92-7.
21. May PL, Blaser SI, Hoffman HJ, Humphreys RP, Harwood- Nash DC. Benign intrinsic tectal “tumors” in children. J Neurosurg 1991; 74: 867-71.
22. Lázaro BC, Landeiro JA. Tectal plate tumors. Arq Neuropsiquiatr 2006; 64: 432-6.
23. Yeh DD, Warnick RE, Ernst RJ. Management strategy for adult patients with dorsal midbrain gliomas. Neurosurgery 2002; 50: 735-8.
24. Stuer C, Vilz B, Majores M, Beccker A, Schramm J, Simon M. Frequent recurrence and progression in pilocytic astrocytoma in adults. Cancer 2007; 110: 2799-808.
25. Scheinker IM. Subependymoma: a newly recognised tumor of the subependymal derivation. J Neurosurg 1945; 2: 232-40.
26. Azzarelli B, Rekate HL, Roessmann U. Subependymoma: a case report with ultrastructural study. Acta Neuropathol 1977; 40: 279-82.
27. Polivka M, Lot G, Woimant F, et al. Seven cases of subependymoma. Anatomoclinical study and review of the literature. Arch Anat Cytol Pathol 1994; 42: 141-8.
28. Romoli S, Abbruzzese A, Castagna M, et al. Unusual exophytic subependymoma in the blubo-cerebellar angle. Case report. J Neurosurg Sci 2007; 51: 81-4.
29. Koral K, Kedzierski RM, Gimi B, et al. Subependymoma of the cerebellopontine angle and prepontine cistern in a 15-year-old adolescent boy. AJNR Am J Neuroradiol 2008; 29: 190-1.
30. Scheinker IM. Subependymoma: a newly recognised tumor of the subependymal derivation. J Neurosurg 1945; 2: 232-40.
31. Azzarelli B, Rekate HL, Roessmann U. Subependymoma: a case report with ultrastructural study. Acta Neuropathol 1977; 40: 279-82.
32. Polivka M, Lot G, Woimant F, et al. Seven cases of subependymoma. Anatomoclinical study and review of the literature. Arch Anat Cytol Pathol 1994; 42: 141-8.
33. Romoli S, Abbruzzese A, Castagna M, et al. Unusual exophytic subependymoma in the blubo-cerebellar angle. Case report. J Neurosurg Sci 2007; 51: 81-4.
34. Koral K, Kedzierski RM, Gimi B, et al. Subependymoma of the cerebellopontine angle and prepontine cistern in a 15-year-old adolescent boy. AJNR Am J Neuroradiol 2008; 29: 190-1.
35. Lucchinetti CF, Gavrilova RH, Metz I, et al. Clinical and radiographic spectrum of pathologically confirmed tumefactive multiple sclerosis. Brain 2008; 131: 1759-75.
36. Seewann A, Enzinger C, Filippi M, et al. MRI characteristics of atypical idiopathic inflammatory demyelinating lesions of the brain: A review of reported findings. J Neurol 2008; 255:1-10.
37. Yavuzer D, Dalbayrak S, Oz B, Yilmaz M, Akansel G. Intracranial inflammatory pseudotumor: case report and review of the literature. Clin Neuropathol 2010; 29: 151-5.
38. Rabadán AT, Tarulla A, Santoro P, Paz L. Pseudotumor cerebral inflamatorio. Una variante de enfermedad desmielinizante que simula glioma de alto grado. Medicina (B Aires) 2015; 75: 52.
39. Conway JE, Chou D, Clatterbuck RE, et al. Hemangioblastomas of the central nervous system in von Hippel-Lindau syndrome and sporadic disease. Neurosurgery 2001; 48: 55-62.
40. Padhi S, Sarangi R, Challa S, et al. A 10-year retrospective study of hemangioblastomas of the central nervous system with reference to von Hippel-Lindau (VHL) disease. J Clin Neurosci 2011; 18: 939-44.
41. Shively SB, Falke EA, Li J, et al. Developmentally arrested structures preceding cerebellar tumors in von Hippel- Lindau disease. Mol Pathol 2011; 24: 1023-30.
42. Catapano D, Muscarella LA, Guarnieri V, et al. Hemangioblastomas of the central nervous system. Molecular genetic analysis and clinical management. Neurosurgery 2005; 56: 1215-21.
43. Brundl E, Schodel P, Ullrich O, Brawanski A, Schebesch K. Surgical resection of sporadic and hereditary hemangioblastoma: Our 10-year experience and a literature review. Surg Neurol Int 2014; 5: 138.
44. Rachinger J, Buslei R, Prell J, et al. Solid haemangioblastomas of the CNS: a review of 17 consecutive cases. Neurosurg Rev 2009; 32: 37-47.
45. Kano H, Niranjan A, Mongia S, et al. The role of stereotactic radiosurgery for intracranial hemangioblastomas. Neurosurgery 2008; 63: 443-51.
46. Rabadán AT, Hernández DA, Paz L. Hemangioblastoma located in the posterior incisural space mimicking a tentorial meningioma: a case report. J Med Case Rep 2016; 10: 183-6.
47. Cervio A, Villalonga JF, Liñares JM, Mormandi R, Condomí Alcorta S, Salvat J. Tratamiento quirúrgico de los hemangioblastomas del sistema nervioso central. Rev Arg Neuroc 2015; 29: 117-31.
48. Campero A, Ajler P, Fernández J, Isolan G, Paiz M, Rivadeneira C. Hemangioblastomas de fosa posterior: reporte de 16 casos y revisión de la literatura. Rev Arg Neuroc 2016; 30: 62-8.
49. Parker F, Aghakhani N, Ducati LG, et al. Results of microsurgical treatment of medulla oblongata and spinal cord hemangioblastomas: a comparison of two distinct clinical patient groups. J Neurooncol 2009; 93: 133-7.
50. Duffau H, Capelle L, Sichez JP, et al. Early radiologically proven rebleeding from intracranial cavernous angiomas: report of 6 cases and review of the literature. Acta Neurochir (Wien) 1997; 139: 914-22.
51. Xie MG, Li D, Guo FZ, et al. Brainstem cavernous malformations: surgical indications based on natural history and surgical outcomes. World Neurosurg 2018; 110: 55-63.
– – – –
LA TAPA
José A. Malanca. «Esquina de pueblo». Año: 1965
Técnica: Óleo sobre lienzo. Medidas: 54 × 76 cm.
José Américo Malanca nació en Córdoba el 10 de diciembre de 1897. Es considerado el más importante paisajista cordobés. Trabajaba en Río Ceballos en su paraíso que se llamaba La Estancita. En sus obras nos muestra las sierras de Córdoba y también el producto de su vida nómade con obras realizadas en México, Perú, Bolivia y en el interior de nuestro país, llegando hasta Bariloche.
Había comenzado a pintar desde muy pequeño en el patio de su casa. Fue el maestro Alejandro Carbó quien le regaló sus primeras herramientas de trabajo: una caja de pinturas y una paleta que conservó hasta el fin de sus días. Estudió en la Academia Provincial de Bellas Artes donde tuvo como profesores a Bignozzi, Caraffa y Cardeñosa, entre otros. En 1922 recibió el Tercer Premio en el Salón Nacional de Bellas Artes y entabló una amistad con uno de los padres de la pintura serrana: Fernando Fader. En 1923 ganó una beca otorgada por el gobierno provincial y viajó a estudiar a Italia y España. En Europa afinó su técnica y realizó una profusa formación cultural. De regreso en la Argentina, en 1926, obtuvo una beca de perfeccionamiento que le permitió viajar por toda América. Malanca quedó atrapado por la América precolombina y colonial, refulgente y sufrida. Murió en La Rioja el 1º de agosto de 1967.
Fuentes: https://www.zurbaran.com.ar/jose-malanca-1897-1967/
http://www.artedelaargentina.com.ar/disciplinas/artista/pintura/jose-malanca
