MATÍAS OTTO-YÁÑEZ1-3, RODRIGO TORRES-CASTRO1, 3, JOAQUÍN NIETO-PINO2, 4, MERCEDES MAYOS5-7
1Centro de Estudios Integrados en Neurorrehabilitación, Clínica Los Coihues, Chile, 2Escuela de Kinesiología, Universidad Autónoma de Chile, Chile, 3Departamento de Kinesiología, Facultad de Medicina, Universidad de Chile, Santiago, Chile, 4Servicio de Neurología Adulto, Hospital Clínico La Florida, Santiago, Chile, 5Departamento de Medicina, Universitat Autònoma de Barcelona, Barcelona, España, 6Unidad de Sueño, Servicio de Neumología, Hospital de la Santa Creu i Sant Pau, Barcelona, España, 7CIBER Enfermedades Respiratorias (CibeRes) (CB06/06), España
Resumen El accidente cerebrovascular, una de las principales causas de discapacidad y muerte a nivel global, se asocia con frecuencia al síndrome de apneas-hipopneas obstructivas del sueño. Se ha demostrado que este trastorno del sueño es un factor de riesgo independiente de accidente cerebrovascular, por lo que se ha recomendado su estudio y tratamiento. Entre los mecanismos que relacionan estos dos cuadros clínicos se destacan: el estrés oxidativo, las alteraciones del flujo sanguíneo cerebral, la disfunción autonómica y la hipercoagulabilidad, como también la persistencia del foramen oval, la hipertensión arterial y los trastornos del ritmo cardiaco. Evidencias incipientes tienden a respaldar el tratamiento del accidente cerebrovascular con presión positiva continua en la vía aérea, pero aún son necesarios más ensayos clínicos aleatorizados para avalar ese tratamiento. Este trabajo presenta una revisión de la literatura sobre epidemiología, fisiopatología, clínica y tratamiento del síndrome de apneas-hipopneas asociado al accidente cerebrovascular.
Palabras clave: accidente cerebrovascular, presión positiva continua de la vía aérea, síndrome de apneas obstructivas del sueño
Abstract Obstructive sleep apnea-hypopnea and stroke. Stroke, one of the main causes of disability and
death worldwide, is frequently associated to the obstructive sleep apnea-hypopnea syndrome. This sleep disorder has been demonstrated to be an independent risk factor for stroke, and therefore its investigation and treatment has been recommended for patients with stroke. Mechanisms relating these two clinical disorders include: oxidative stress, cerebral blood flow alterations, autonomic dysfunction, and hypercoagulability, as well as patent foramen ovale, blood pressure, and heart rhythm disorders. Increasing amount of evidence supports continuous airway positive pressure therapy in patients with stroke, but further randomized clinical trials are needed to obtain solid conclusions. This work reviews the literature on epidemiology, pathophysiology, clinical assessment, and treatment of apnea-hypopnea syndrome in patients with stroke.
Key words: stroke, continuous positive airway pressure, obstructive sleep apnea
Recibido: 11-IV-2018 Aceptado: 17-IX-2018
Dirección postal: Rodrigo Torres-Castro, Departamento de Kinesiología, Facultad de Medicina, Universidad de Chile, Independencia 1027, Santiago, Chile
e-mail: klgorodrigotorres@gmail.com
El síndrome de apneas-hipopneas obstructivas del sueño (SAHOS) es el trastorno respiratorio del sueño más frecuente. Se caracteriza por una disminución total o parcial del flujo aéreo durante el sueño que genera hipoxemia intermitente y microdespertares, asociado a la presencia de somnolencia diurna excesiva1. El SAHOS ha sido relacionado con el desarrollo de diversos trastornos clínicos, como hipertensión arterial, diabetes, enfermedad cardiovascular, enfermedad cerebrovascular y también con un incremento en la mortalidad, aunque la evidencia que apoya la asociación con diabetes no es aún concluyente2. Clásicamente, la gravedad se determina mediante el índice de apnea-hipopnea/hora (IAH), y se clasifica como leve (IAH 5-14.9), moderado (IAH 15-29.9) o grave (IAH ≥ 30)3, aunque algunos autores sugieren incorporar parámetros como IAH en supino, IAH en no supino, IAH en sueño REM y NREM, tipo y duración de los eventos respiratorios, índice de desaturación, saturación promedio, saturación bajo 90% y sintomatología4, 5. Un estudio realizado en Brasil ha estimado una prevalencia de SAHOS de 32.9% en la población general, siendo mayor en hombres y en personas de edad avanzada6. La prevalencia de SAHOS moderado-grave en la población general podría llegar al 15%7, 8 y las guías prácticas de la Asociación Argentina de Medicina Respiratoria recomiendan el tratamiento en este grupo de pacientes9.
El accidente cerebrovascular (ACV) se define como el desarrollo rápido de signos clínicos de alteración, focal o global, de la función cerebral, con síntomas que duran 24 horas o más, o que conducen a la muerte, asociado a una alteración vascular10. Se puede originar por una alteración isquémica y/o hemorrágica, con consecuencias motoras, defectos del campo visual, alteraciones cognitivas, depresión y ansiedad11, generando déficits en el funcionamiento diario y deterioro de la calidad de vida después del evento12.
Se ha observado una alta prevalencia de trastornos respiratorios durante el sueño en pacientes con ACV y accidente isquémico transitorio. El SAHOS es el más frecuente13, con una prevalencia entre 30 y 70%14.
Relación entre síndrome de apneas-hipopneas obstructivas del sueño y accidente cerebrovascular
La evidencia disponible permite considerar al SAHOS como factor de riesgo independiente del ACV. Un estudio multicéntrico de seguimiento realizado a 5422 personas durante 8.7 años relacionó el diagnóstico de SAHOS con el riesgo de ACV. El estudio mostró que los hombres que presentaban un IAH >19 tenían un riesgo casi tres veces mayor que los controles de presentar un ACV isquémico, y en mujeres, el riesgo aumentaba con un IAH > 2515. Un estudio previo realizado en 6424 personas investigó el riesgo de padecer alguna enfermedad cardiovascular a consecuencia del SAHOS. Señala que los sujetos que presentan un IAH > 19 tienen un riesgo relativo 1.55 veces mayor que los controles de padecer un ACV16. Además, un meta-análisis mostró que personas con SAHOS moderado a grave tienen un riesgo 2.5 veces mayor que los controles de presentar enfermedad cardiovascular y 2 veces mayor de presentar ACV17. Es en base a esta evidencia que la American Heart Association junto con la American Stroke Association (AHA/ASA) reconocen al SAHOS como un potencial factor de riesgo modificable, recomendando realizar estudio del sueño y tratar el SAHOS mediante presión positiva continua en la vía aérea (Continuous Positive Airway Pressure, CPAP), debido a la evidencia emergente que apoya su utilidad clínica18 (Tabla 1). Posteriormente, la actualización de 2017 de las Canadian stroke best practice recommendations para la prevención secundaria de ACV propone que la detección y el tratamiento del SAHOS debe ser parte de la atención primaria rutinaria de estos pacientes19.
El SAHOS puede estar subdiagnosticado20 debido, principalmente, a la baja percepción de los síntomas por parte de los pacientes y a las dificultades que suele tener esta población para acceder a laboratorios de estudio del sueño21. Es por esto que se han evaluado alternativas de diagnóstico más simples y económicas. La oximetría nocturna ha sido utilizada con buenos resultados como test de detección en pacientes con ACV22, y en algunos estudios ha sido respaldado su uso como herramienta diagnóstica en poblaciones de alto riesgo de SAHOS23, 24. Por otra parte, las guías prácticas de diagnóstico y tratamiento del síndrome de apneas e hipopneas obstructivas del sueño recomienda la realización de poligrafía respiratoria en pacientes con sospecha clínica de SAHOS9. Su uso domiciliario ha sido validado principalmente en pacientes con un IAH elevado, por lo que se requiere una correcta selección de sujetos con alta sospecha de SAHOS, para una apropiada utilidad25. Los cuestionarios para determinar un nivel de sospecha de SAHOS han sido estudiados en pacientes con ACV. El cuestionario de Berlin (CB), la Escala de Somnolencia de Epworth (ESE), el Sleep Obstructive apnea score optimized for Stroke (Método combinado entre CB y ESE)26, el método de 4 variables y el STOP-BANG test27, han sido valorados positivamente para el uso en esta población. A la vez, también existen estudios que no han avalado su uso en secuelados de ACV 28, 29, por lo que sigue siendo tema de discusión, siendo

las principales diferencias sobre si debemos usarlas dentro del hospital o son de uso ambulatorios, o en que fase posterior al ACV presentan una mayor utilidad.
La asociación entre SAHOS y ACV se ha relacionado con mayor tiempo de recuperación y mayores requerimientos de rehabilitación30, peor pronóstico funcional31 y aumento de la mortalidad32. En un seguimiento de 10 años en 132 pacientes con ACV, aquellos sujetos con diagnóstico de SAHOS (n = 23) moderado o grave (≥ 15 IAH) presentaron un riesgo de mortalidad prematura 75% mayor que el grupo control. No se encontró riesgo en aquellos que presentaron apnea central del sueño (n = 28)33. Aaronson et al. evaluaron la presencia de SAHOS mediante poligrafía respiratoria en 147 pacientes con diagnóstico de ACV. El grupo con SAHOS (≥ 15 IAH, n = 80) presentó peores resultados en pruebas de atención, función ejecutiva, percepción visual, habilidad psicomotora e inteligencia, además de un mayor deterioro funcional, menor recuperación y hospitalización más prolongada, en comparación al grupo control34.
Los trastornos respiratorios del sueño, de causa obstructiva o central, también pueden ser una consecuencia del ACV, y en ese caso su manifestación dependerá de la evolución neurológica y de la fase en que se encuentre el ACV. Bassetti y su grupo de investigación describieron una disminución del IAH en la fase aguda, y su progresiva normalización en el tránsito hacia la fase subaguda (6 meses) en 40% de los pacientes35. Los autores sugieren que podría deberse a una disminución de los eventos centrales.
Aspectos fisiopatológicos
Entre los cambios que podrían favorecer la aparición de un ACV (Fig. 1), están la hipoxia intermitente, los microdespertares y la generación de presión negativa intratorácica, que producen un aumento de la actividad simpática. Los episodios repetidos de hipoxia-reoxigenación, y el aumento de la actividad simpática pueden activar diferentes vías patogénicas como estrés oxidativo, disfunción endotelial, hipercoagulabilidad y resistencia a la insulina, que favorecen la aterogénesis14, 15. La hiperestimulación simpática provoca además cambios en la presión arterial y la frecuencia cardíaca, que se han relacionado con alteraciones de la perfusión cerebral36. A continuación revisamos los factores más relevantes.
Hipoxemia intermitente
La hipoxemia intermitente (HI) se ha propuesto como uno de los mecanismos generadores del riesgo de enfermedades cardiovasculares asociado al SAHOS. La HI produce cambios en la respuesta cardíaca mediada por modificaciones del sistema nervioso autónomo impulsadas por la disminución de la ventilación37. La HI inducida por la apnea y la retención de CO2 causan esfuerzos inspiratorios ineficaces y una mayor generación de presión intratorácica negativa que, al aumentar la diferencia entre presión intracardíaca y extracardíaca, incrementa la presión transmural del ventrículo izquierdo (aumenta la poscarga, estimulante de la hipertrofia ventricular
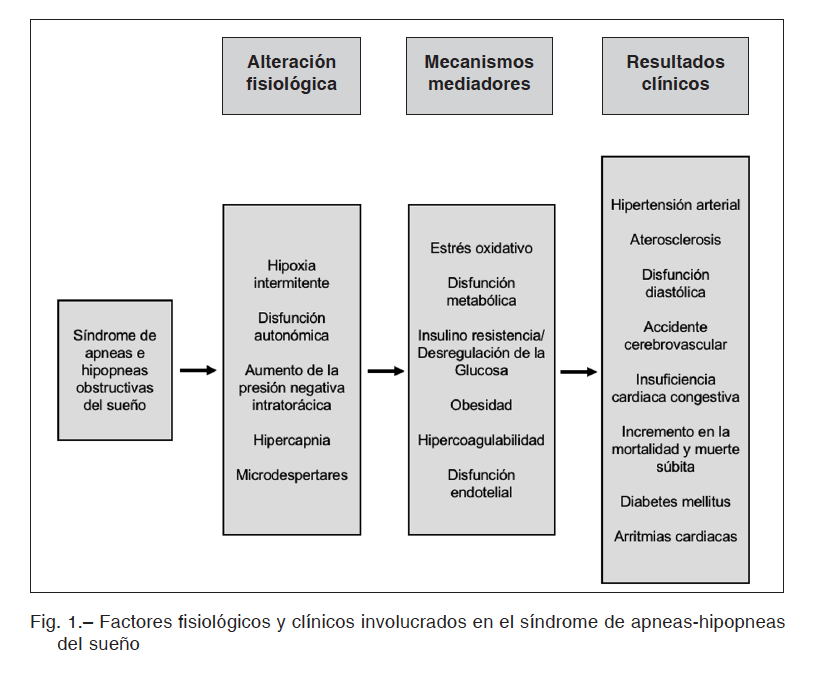
izquierda)38. Estos ciclos de HI provocan modificaciones en la vasoconstricción periférica mediada por el sistema simpático, generando aumentos de la poscarga al elevar la presión arterial sistémica39. Al final de la apnea se desencadena una breve activación del sueño que abruptamente aumenta la actividad simpática y suprime el tono vagal, lo que provoca un mayor aumento en la presión arterial y la frecuencia cardíaca40. Estos efectos agudos se pueden mantener incluso en vigilia, lo que provoca un aumento de la presión sanguínea y una alteración de la frecuencia cardíaca mediada por el vago39, 41-43. La HI puede inducir la producción de radicales libres de oxígeno44, 45 activando las vías inflamatorias que deterioran la función endotelial vascular46, 47 y aumentar la presión arterial independientemente de la activación del sistema nervioso simpático48.
Estrés oxidativo
La hipoxia intermitente genera una lesión producto de la liberación de especies reactivas de oxígeno (ERO), como consecuencia del fenómeno de desaturación/ resaturación. Estas ERO son precursoras del estrés oxidativo, responsable de la disfunción endotelial49. Las ERO favorecen también la peroxidación de lípidos, que altera el equilibrio homeostático y promueve la aterosclerosis50. La hipoxia intermitente crónica puede causar activación del sistema renina-angiotensina-aldosterona, llevando a un aumento de la producción de ERO, aumentando la presión arterial51. Además, la hipoxia intermitente altera la actividad de las enzimas óxido nítrico sintasas, disminuyendo la producción de óxido nítrico, que previene la formación de ateromas. En pacientes con SAHOS y ACV, el estrés oxidativo induce un mayor número de citoquinas inflamatorias tales como IL-6, que es un marcador pro-aterogénico52.
Alteraciones en el flujo sanguíneo cerebral
El SAHOS interfiere en los mecanismos básicos de control que regulan el flujo cerebral, a través de un deterioro de la auto-regulación y del descenso de la reserva cerebrovascular. Se ha descrito una alteración en la vasorreactividad definida como el cambio del flujo cerebral en respuesta a estímulos vasoactivos tales como la hipercapnia53. El SAHOS se caracteriza por episodios de hipoxia intermitente e hipercapnia, por lo que una respuesta cerebrovascular inadecuada puede generar hipoperfusión cerebral y mayor riesgo de isquemia cerebral54. Durante la apnea, el flujo sanguíneo cerebral aumenta inicialmente, pero hacia el final cae por debajo del nivel basal, generando periodos de hipoperfusión55, que pueden mantenerse permanentes en pacientes con SAHOS56.
Disfunción autonómica
La disminución de la ventilación aumenta la descarga simpática y disminuye la sensibilidad vagal. Esto genera un aumento de la frecuencia cardíaca y la presión arterial, que se regula una vez que el sueño se reanuda, y aumenta nuevamente cuando se produce un nuevo ciclo de apnea-hiperpnea36. El SAHOS se ha relacionado con una alteración de la función autonómica durante el sueño y la vigilia, caracterizada por un aumento de la actividad del sistema nervioso simpático, disminución de la sensibilidad del barorreflejo, variabilidad del ritmo cardiaco y variabilidad de la presión arterial57.
Hipercoagulabilidad
La hipercoagulabilidad puede predisponer a la formación de trombos, generando riesgo de ACV58. En el SAHOS se produce hipercoagulabilidad por un aumento de la agregación plaquetaria, aumento del fibrinógeno59 y aumento de las catecolaminas circulantes60. Esta hipercoagubilidad puede alcanzar un punto máximo durante la noche61. Todo esto, más una posible vasoconstricción coronaria, podría incrementar aún más el riesgo a la trombosis coronaria60.
Microdespertares
Los microdespertares asociados a episodios de apnea pueden ser la causa principal de los cambios en la actividad simpática y parasimpática, con variaciones significativas en la presión arterial e inestabilidad del ritmo cardíaco62. Los episodios repetidos de la hipertensión nocturna en pacientes con SAHOS no tratada pueden conducir eventualmente a la hipertensión sostenida63.
Hipertensión
En el SAHOS, la hipertensión puede ser el resultado de la activación simpática y del sistema renina-angiotensina-aldosterona39, de una sensibilidad alterada de los quimiorreceptores64 y de la disfunción endotelial. Durante el episodio de apnea se producen adaptaciones cardiovasculares como mecanismos compensatorios a la disminución de la oxigenación, generando un aumento de la presión arterial, que puede permanecer durante el periodo de vigilia del sujeto63.
Arritmias
La generación de la presión intratorácica negativa, que surge como compensación al final de la apnea, causa estiramiento y remodelación de las aurículas y de los ostium de las venas pulmonares que predisponen a anomalías de la conducción65. El SAHOS es un fuerte predictor de riesgo de fibrilación auricular, y la prevalencia aumenta en el SAHOS moderado y grave. En un estudio de pacientes con SAHOS y fibrilación auricular, el riesgo de generar un primer ACV fue 5.3 veces mayor que en el grupo control sin SAHOS. Aunque no es concluyente, la evidencia actual sugiere que el SAHOS juega un papel en la generación de fibrilación auricular en pacientes con ACV66.
Foramen oval permeable
El foramen oval permeable (FOP) es una variante anatómica común que afecta al septo auricular. Es una estructura que comunica la aurícula izquierda con la derecha durante la etapa fetal, y que generalmente cierra durante los primeros años de vida. Su apertura permanente ha sido relacionada con algunas alteraciones cardiovasculares, entre ellas el ACV67. Además, podría tener relación con el SAHOS68, debido a que se ha encontrado una prevalencia mayor de foramen oval permeable y eventos de desaturación más graves en estos pacientes69. Una investigación realizada en 40 pacientes con FOP permitió evidenciar que el cierre quirúrgico del FOP disminuyó el IAH en una media de 7.9 eventos por hora, y logró reducir la presión arterial sistólica y diastólica en 7 mmHg y 3 mmHg, respectivamente70.
Apneas centrales durante el sueño
La apnea central del sueño y la respiración de Cheyne- Stokes se han observado en 6-24% de los pacientes con ACV agudo71, y disminuye una vez que evoluciona el ACV13. Además, al parecer existe relación entre el tipo de lesión y la respiración de Cheyne-Stokes72. Lesiones en la ínsula, tálamo, región prefrontal, capsula interna, podrían estar relacionadas con la aparición de Cheyne- Stokes, mientras que lesiones en la ínsula izquierda y el mesencéfalo se relacionaron con una baja frecuencia de aparición de apneas centrales y respiración de Cheyne- Stokes73. Una insuficiencia cardíaca, facilitadora de la aparición de apnea central del sueño, podría estar presente en un subconjunto de pacientes71.
Valoración del síndrome de apneas-hipopneas obstructivas del sueño en accidente cerebrovascular
La evaluación clínica del SAHOS incluye la historia, el examen físico y la anamnesis mediante cuestionarios tales como la ESE o el CB28,29, los cuales son difíciles de valorar en sujetos con ACV, quienes incluso pueden presentar una ESE normal74.
El Gold Standard para el diagnóstico de SAHOS es la polisomnografía (PSG). Sin embargo, la poligrafía respiratoria (PR) es utilizada comúnmente ya que es más económica y sencilla de realizar. La recomendación de AHA/ASA hace referencia a la falta de herramientas de cribado adecuadas para esta población18. Basados en estas dificultades es que han aparecido herramientas multidimensionales que incorporan aspectos adicionales como las apneas observadas por los cuidadores, la presión arterial, el índice de masa corporal o la circunferencia del cuello27, 75. La recomendación más reciente es la anteriormente mencionada Canadian stroke best practice recommendations, en donde se destaca que la detección debe ser parte de la evaluación rutinaria de estos pacientes19. En tanto, la actualización de la norma de la American Academy for Sleep Medicine recomienda (recomendación fuerte, pero con muy bajo nivel de evidencia) realizar PSG en una unidad del sueño acreditada (Nivel I en estudios del sueño) en aquellos pacientes con historia de ACV, en vez de pruebas realizadas en el domicilio (nivel II y III en estudios del sueño)76, a pesar de tener evidencia de que estas últimas son factibles de implementar como estrategias para facilitar el diagnóstico y el manejo en esta población77. Es importante mencionar que estas normas y recomendaciones no hacen mención a los pacientes hospitalizados, o aquellos de unidades de pacientes críticos, o a quienes presenten un compromiso del sensorio. Un estudio de validación ha demostrado una excelente sensibilidad y especificidad para un dispositivo portátil (AHI> 10 eventos por hora) en una cohorte de ACV y, por lo tanto, aunque las preocupaciones con respecto a los estudios domiciliarios son válidas, pueden ser sobreestimadas78. Recientemente se ha publicado un protocolo de investigación para evaluar la validez de los estudios de poligrafía domiciliaria en pacientes con ACV y el seguimiento con telemedicina para favorecer los niveles de adherencia79, por lo que se debe esperar sus resultados para determinar su aporte en terminos de utilidad de estas herramientas no supervisadas.
Tratamiento del síndrome de apneas-hipopneas en accidente cerebrovascular
La AHA/ASA recomienda el tratamiento con CPAP a todos los pacientes con SAHOS moderados y graves asociados a ACV. No existe recomendación formal para pacientes con SAHOS leve18. La recomendación canadiense indica el uso de CPAP bajo los mismos criterios en que se entrega el tratamiento para los sujetos sin ACV19. En aquellos que reciben tratamiento con CPAP, la efectividad podría verse limitada por una baja adherencia y cumplimiento, limitando sus beneficios en directa relación al número de horas de utilización. Se estima que entre el 46 y el 83% de los pacientes no alcanzan a usar más de 4 horas por noche el equipo80. En contraste, un reciente meta-análisis indica que la media de uso fue de 4.5 horas, además de demostrar que es un tratamiento seguro y que presenta potenciales beneficios en la neurorrehabilitación81.
El SAHOS ha sido asociado con resultados desfavorables en pacientes con ACV, que incluyen alta mortalidad, delirio, depresión y peor estado funcional82,83. Un estudio aleatorizado y controlado de 55 pacientes con ACV agudo y CPAP por un mes, utilizando el equipo de CPAP desde el primer día, demostró una gran mejoría en la escala National Institute of Health Stroke Scale, una escala clínica para evaluar la gravedad del ACV84. De manera similar, otro estudio de 50 pacientes con ACV también mostró mejoría, medida por el mismo índice, con el uso de CPAP los primeros 8 días posterior al ACV85. En cuanto al accidente isquémico transitorio, en un ensayo clínico aleatorizado que involucró 70 pacientes, aquellos que comenzaron a usar el CPAP tempranamente (≈40 horas post comienzo de los síntomas) presentaron menor tasa de eventos vasculares (accidente isquémico transitorio recurrente, ACV, internación por insuficiencia cardíaca congestiva, infarto de miocardio, muerte)86.
En cuanto al estado cognitivo, en un ensayo clínico aleatorizado y controlado en 20 sujetos, 70% con ACV isquémico, el tratamiento con CPAP durante 4 semanas presentó mejoras significativas en el estado cognitivo durante la rehabilitación posterior a la hospitalización. Específicamente, los pacientes del grupo intervención mostraron cambios significativos en los dominios cognitivos de atención y funcionamiento ejecutivo respecto al grupo control87. Los resultados fueron positivos a pesar de que la media de uso por noche fue de apenas 2.5 horas.
Respecto a resultados a largo plazo, Parra et al. evaluaron la supervivencia a 5 años en pacientes con un primer evento de ACV y SAHOS moderado-grave, quienes recibieron tratamiento precoz (3-6 días post ACV) con CPAP (n = 71) y terapia convencional, comparados con los que recibieron solo terapia convencional (n = 69). Sus resultados demostraron que el grupo con CPAP tuvo una supervivencia significativamente mayor en relación al grupo control88. Los autores de estos trabajos consideran que cuanto más precozmente sea establecido el tratamiento con CPAP, más beneficios clínicos generará89. Esto se atribuye a que los eventos de apnea son perjudiciales para la zona de penumbra isquémica –tejido dañado por hipoperfusión después de un ACV isquémico con potencial de reversión– lo cual es de gran importancia durante los primeros meses post-ACV debido a su rol en el proceso de neuroplasticidad. Si evitamos los eventos de apneas durante el sueño mediante el CPAP, podríamos evitar que la zona de penumbra isquémica consolide su daño, además de aumentar el tiempo de sueño REM (rapid eye movement) y de ondas lentas, ya que son periodos fundamentales para el proceso de consolidación del aprendizaje90. Un ensayo clínico prospectivo y aleatorizado en pacientes con ACV incorporados 6 semanas después del ictus, demostró diferencias estadísticamente significativas en la tasa de recuperación neurológica y reducción de nuevos eventos vasculares (1 vs. 6 eventos vasculares, aunque esta diferencia no fue estadísticamente significativa) después de 1 año de seguimiento, al comparar un grupo con tratamiento CPAP y un grupo control sin CPAP91. A pesar de que la lógica invita a un tratamiento lo más precoz posible, la literatura no ha sido contundente para apoyar esta afirmación.
Un estudio multicéntrico que lleva por nombre Sleep Apnea Cardiovascular Endpoints (SAVE), con una muestra de 2717 pacientes con SAHOS, ACV y/o enfermedad coronaria, donde 1346 utilizaron CPAP en un seguimiento a 3 años, no logró demostrar que el tratamiento con presión positiva fuera efectivo para disminuir los eventos cardiovasculares, pero sí demostró sus beneficios en la mejoría en calidad de vida, disminución de la somnolencia, además de entregar los primeros resultados con mayor nivel de evidencia de que el tratamiento con presión positiva puede aumentar la productividad laboral y ser efectivo contra la depresión92. Es importante mencionar que quizás un seguimiento de 3 años no es suficiente para evaluar la efectividad del CPAP en disminuir los eventos cardiovasculares, lo cual es una limitación de este estudio.
En cuanto al cumplimiento del tratamiento, los estudios muestran rangos muy amplios, desde 11%35 hasta 81%36. Martinez-Garcia93 observó que un mayor cumplimiento se asociaba a un menor número de nuevos eventos cardiovasculares (6.7 vs 36%). El mismo autor en un estudio posterior32 con seguimiento de 5 años, observa una asociación entre adherencia y cumplimiento y la disminución del riesgo de muerte (49.6 vs 68.3%). El estudio SAVE reporta una media de uso de 3.3 horas por noche, lo que representa un nivel bajo de uso, tiempo quizás no suficiente para lograr disminuir los eventos cardiovasculares, y que podría influenciar los resultados obtenidos, por lo que debemos interpretar con precaución los hallazgos en esta investigación92.
Sin duda que la adherencia es un problema transversal a los pacientes con SAHOS, independiente de la comorbilidad. Este aspecto se debe abordar con programas de entrenamiento a las familias, una adecuada elección de interfaces y con seguimiento a través de telemedicina, aunque la bibliografía que evalúa estas intervenciones es escasa. Existen aspectos clínicos en relación a la gravedad del SAHOS, el proceso de titulación, los efectos adversos del tratamiento, aspectos psicológicos en relación a la aceptación de la enfermedad, componentes biopsicosociales, que podrían ser importantes en relación a la adherencia al tratamiento94.
Un reciente meta-análisis y revisión sistemática concluye que el tratamiento con CPAP en pacientes con ACV y SAHOS es seguro y genera mejorías clínicas en la recuperación neurológica, pero no ha demostrado efectos en supervivencia ni en la prevención de nuevos eventos vasculares81,95.
En síntesis, los pacientes con ACV presentan mayor prevalencia de SAHOS que la población general, probablemente debido a que las alteraciones cardiovasculares y metabólicas relacionadas con el SAHOS son también las que aumentan el riesgo de ACV. La literatura actual indica que estas alteraciones se relacionan con un peor pronóstico de la enfermedad y una peor recuperación neurológica. El tratamiento con CPAP en el SAHOS moderado y grave debería ser precoz y mandatorio, en base a las publicaciones que respaldan su seguridad y eficacia a partir de la fase aguda. El tratamiento con CPAP ha demostrado mejorías clínicas en esta población, pero aún no ha demostrado disminución de nuevos eventos vasculares ni de mortalidad, aunque la baja adherencia y un seguimiento reducido pueden haber influido en los resultados publicados. Son necesarios estudios con adecuado poder estadístico y de largo seguimiento para poder evaluar efectos sobre la morbi-mortalidad, con estrategias para poder controlar niveles de adherencia que favorezcan los efectos clínicos en esta población.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Young T, Evans L, Finn L, Palta M. Estimation of the clinically diagnosed proportion of sleep apnea syndrome in middle-aged men and women. Sleep 1997; 20: 705-6.
2. Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet 2005; 365: 1046-53.
3. McNicholas WT. Diagnosis of obstructive sleep apnea in adults. Proc Am Thorac Soc 2008; 5: 154-60.
4. Borsini E, Nogueira F, Nigro C. Apnea-hypopnea index in sleep studies and the risk of over-simplification. Sleep Sci 2018; 11: 45-8.
5. Rapoport DM. POINT: Is the apnea-hypopnea index the best way to quantify the severity of sleep-disordered breathing? Yes. Chest 2016; 149: 14-6.
6. Tufik S, Santos-Silva R, Taddei JA, Bittencourt LR. Obstructive sleep apnea syndrome in the Sao Paulo Epidemiologic Sleep Study. Sleep Med 2010; 11: 441-6.
7. Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Increased prevalence of sleep-disordered breathing in adults. Am J Epidemiol 2013; 177: 1006-14.
8. Senaratna CV, Perret JL, Lodge CJ, et al. Prevalence of obstructive sleep apnea in the general population: a systematic review. Sleep Med Rev 2017; 34: 70-81.
9. Nogueira F, Nigro C, Cambursano H, Borsini E, Silio J, Ávila J. Guías prácticas de diagnóstico y tratamiento del síndrome de apneas e hipopneas obstructivas del sueño. Medicina (B Aires) 2013; 73: 349-62.
10. Word Health Organization. Cerebrovascular disorders: a clinical and research classification. Geneva: World Health Organization, 1978.
11. Lerdal A, Bakken LN, Kouwenhoven SE, et al. Poststroke fatigue-a review. J Pain Symptom Manage 2009; 38: 928-49.
12. Meyer S, Verheyden G, Brinkmann N, et al. Functional and motor outcome 5 years after stroke is equivalent to outcome at 2 months follow-up of the Collaborative Evaluation of Rehabilitation in Stroke Across Europe. Stroke 2015; 46: 1613-9.
13. Parra O, Arboix A, Bechich S, et al. Time course of sleep-related breathing disorders in first-ever stroke or transient ischemic attack. Am J Respir Crit Care Med 2000; 161: 375-80.
14. Johnson KG, Johnson DC. Frequency of sleep apnea in stroke and TIA patients: a meta-analysis. J Clin Sleep Med 2010; 6: 131-7.
15. Redline S, Yenokyan G, Gottlieb DJ, et al. Obstructive sleep apnea-hypopnea and incident stroke: the sleep heart health study. Am J Respir Crit Care Med 2010; 182: 269-77.
16. Shahar E, Whitney CW, REdline S, et al. Sleep-disordered breathing and cardiovascular disease: cross-sectional results of the Sleep Heart Health Study. Am J Respir Crit Care Med 2001; 163: 19-25.
17. Dong J-Y, Zhang Y-H, Qin L-Q. Obstructive sleep apnea and cardiovascular risk: meta-analysis of prospective cohort studies. Atherosclerosis 2013; 229: 489-95.
18. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014; 45: 2160-236.
19. Wein T, Lindsay MP, Côté R, et al. Canadian stroke best practice recommendations: Secondary prevention of stroke, practice guidelines, update 2017. Int J Stroke 2018; 13: 420-43.
20. Kapur V, Strohl KP, Redline S, Iber C, O’Connor G, Nieto J. Underdiagnosis of sleep apnea syndrome in US communities. Sleep Breath 2002; 6: 49-54.
21. Altevogt BM, Colten HR. Sleep Disorders and Sleep Deprivation: An Unmet Public Health Problem. Washington DC, USA: The National Academies Press, 2006.
22. Aaronson JA, van Bezeij T, van den Aardweg JG, van Bennekom CA, Hofman WF. Diagnostic accuracy of nocturnal oximetry for detection of sleep apnea syndrome in stroke rehabilitation. Stroke 2012; 43: 2491-3.
23. Nigro CA, Dibur E, Rhodius E. Accuracy of the clinical parameters and oximetry to initiate CPAP in patients with suspected obstructive sleep apnea. Sleep Breath 2012; 16: 1073-9.
24. Oeverland B, Skatvedt O, Kværner KJ, Akre H. Pulseoximetry: sufficient to diagnose severe sleep apnea. Sleep Med 2002; 3: 133-8.
25. Masa JF, Corral J, Pereira R, et al. Therapeutic decision-making for sleep apnea and hypopnea syndrome using home respiratory polygraphy: a large multicentric study. Am J Respir Crit Care Med 2011; 184: 964-71.
26. Camilo MR, Sander HH, Eckeli AL, et al. SOS score: an optimized score to screen acute stroke patients for obstructive sleep apnea. Sleep Med 2014; 15: 1021-4.
27. Boulos MI, Wan A, Im J, et al. Identifying obstructive sleep apnea after stroke/TIA: evaluating four simple screening tools. Sleep Med 2016; 21: 133-9.
28. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1991; 14: 540-5.
29. Netzer NC, Stoohs RA, Netzer CM, Clark K, Strohl KP. Using the Berlin Questionnaire to identify patients at risk for the sleep apnea syndrome. Ann Intern Med 1999; 131: 485-91.
30. Turkington PM, Allgar V, Bamford J, Wanklyn P, Elliott MW. Effect of upper airway obstruction in acute stroke 367-71.
31. Cherkassky T, Oksenberg A, Froom P, Ring H. Sleep-related breathing disorders and rehabilitation outcome of stroke patients: a prospective study. Am J Phys Med Rehabil 2003; 82: 452-5.
32. Martínez-García MÁ, Soler-Cataluña JJ, Ejarque-Martínez L, et al. Continuous positive airway pressure treatment reduces mortality in patients with ischemic stroke and obstructive sleep apnea: a 5-year follow-up study. Am J Respir Crit Care Med 2009; 180: 36-41.
33. Sahlin C, Sandberg O, Gustafson Y, et al. Obstructive sleep apnea is a risk factor for death in patients with stroke: a 10-year follow-up. Arch Intern Med 2008; 168: 297-301.
34. Aaronson JA, van Bennekom C, Hofman WF, et al. Obstructive sleep apnea is related to impaired cognitive and functional status after stroke. Sleep 2015; 38: 1431-7.
35. Bassetti CL, Milanova M, Gugger M. Sleep-disordered breathing and acute ischemic stroke diagnosis, risk factors, treatment, evolution, and long-term clinical outcome. Stroke 2006; 37: 967-72.
36. Bradley TD, Floras JS. Obstructive sleep apnoea and its cardiovascular consequences. Lancet 2009; 373: 82-93.
37. Bonsignore MR, Romano S, Marrone O, Chiodi M, Bonsignore G. Different heart rate patterns in obstructive apneas during NREM sleep. Sleep 1997; 20: 1167-74.
38. Tkacova R, Rankin F, Fitzgerald FS, Floras JS, Bradley TD. Effects of continuous positive airway pressure on obstructive sleep apnea and left ventricular afterload in patients with heart failure. Circulation 1998; 98: 2269-75.
39. Somers VK, Dyken ME, Clary MP, Abboud FM. Sympathetic neural mechanisms in obstructive sleep apnea. J Clin Inves 1995; 96: 1897-904.
40. Horner RL, Brooks D, Kozar LF, Tse S, Phillipson EA. Immediate effects of arousal from sleep on cardiac autonomic outflow in the absence of breathing in dogs. J Appl Physiol (1985) 1995; 79: 151-62.
41. Arabi Y, Morgan BJ, Goodman B, Puleo DS, Xie A, Skatrud JB. Daytime blood pressure elevation after nocturnal hypoxia. J Appl Physiol (1985) 1999; 87: 689-98.
42. Brooks D, Horner RL, Kozar LF, Render-Teixeira CL, Phillipson EA. Obstructive sleep apnea as a cause of systemic hypertension. Evidence from a canine model. J Clin Invest 1997; 99: 106-9.
43. Narkiewicz K, Montano N, Cogliati C, Van De Borne PJ, Dyken ME, Somers VK. Altered cardiovascular variability in obstructive sleep apnea. Circulation 1998; 98: 1071-7.
44. Dyugovskaya L, Lavie P, Lavie L. Increased adhesion molecules expression and production of reactive oxygen species in leukocytes of sleep apnea patients. Am J Respir Crit Care Med 2002; 165: 934-9.
45. Schulz R, Mahmoudi S, Hattar K, et al. Enhanced release of superoxide from polymorphonuclear neutrophils in obstructive sleep apnea: impact of continuous positive airway pressure therapy. Am J Respir Crit Care Med 2000; 162: 566-70.
46. Ryan S, Taylor CT, McNicholas WT. Selective activation of inflammatory pathways by intermittent hypoxia in obstructive sleep apnea syndrome. Circulation 2005; 112: 2660-7.
47. Ryan S, Taylor CT, McNicholas WT. Predictors of elevated nuclear factor-kappaB–dependent genes in obstructive sleep apnea syndrome. Am J Respir Crit Care Med 2006; 174: 824-30.
48. Vongpatanasin W, Thomas GD, Schwartz R, et al. C-reactive protein causes downregulation of vascular angiotensin subtype 2 receptors and systolic hypertension in mice. Circulation 2007; 115: 1020-8.
49. Lavie L. Oxidative stress in obstructive sleep apnea and intermittent hypoxia–revisited–the bad ugly and good: implications to the heart and brain. Sleep Med Rev 2015; 20: 27-45.
50. Barcelo A, Miralles C, Barbe F, Vila M, Pons S, Agusti A. Abnormal lipid peroxidation in patients with sleep apnoea. Eur Respir J 2000; 16: 644-7.
51. Foster GE, Hanly PJ, Ahmed SB, Beaudin AE, Pialoux V, Poulin MJ. Intermittent hypoxia increases arterial blood pressure in humans through a renin-angiotensin system-dependent mechanism. Hypertension 2010; 56: 369-77.
52. Medeiros C, De Bruin V, Andrade G, Coutinho W, de Castro‐Silva C, De Bruin P. Obstructive sleep apnea and biomarkers of inflammation in ischemic stroke. Acta Neurol Scand 2012; 126: 17-22.
53. Stevenson SF, Doubal FN, Shuler K, Wardlaw JM. A systematic review of dynamic cerebral and peripheral endothelial function in lacunar stroke versus controls. Stroke 2010; 41: e434-42.
54. Urbano F, Roux F, Schindler J, Mohsenin V. Impaired cerebral autoregulation in obstructive sleep apnea. J Appl Physiol (1985) 2008; 105: 1852-7.
55. Bålfors E, Franklin KA. Impairment of cerebral perfusion during obstructive sleep apneas. Am J Respir Crit Care Med 1994; 150: 1587-91.
56. Nasr N, Traon A, Czosnyka M, Tiberge M, Schmidt E, Larrue V. Cerebral autoregulation in patients with obstructive sleep apnea syndrome during wakefulness. Eur J Neurol 2009; 16: 386-91.
57. Leung RS, Douglas Bradley T. Sleep apnea and cardiovascular disease. Am J Respir Crit Care Med 2001; 164: 2147-65.
58. Wiklund P-G, Nilsson L, Ardnor SN, et al. Plasminogen activator inhibitor-1 4G/5G polymorphism and risk of stroke replicated findings in two nested case–control studies based on independent cohorts. Stroke 2005; 36: 1661-5.
59. Shamsuzzaman A, Amin RS, Calvin AD, Davison D, Somers VK. Severity of obstructive sleep apnea is associated with elevated plasma fibrinogen in otherwise healthy patients. Sleep Breath 2014; 18: 761-6.
60. Guardiola JJ, Matheson PJ, Clavijo LC, Wilson MA, Fletcher EC. Hypercoagulability in patients with obstructive sleep apnea. Sleep Med 2001; 2: 517-23.
61. Wessendorf TE, Thilmann AF, Wang Y-M, Schreiber A, Konietzko N, Teschler H. Fibrinogen levels and obstructive sleep apnea in ischemic stroke. Am J Respir Crit Care Med 2000; 162: 2039-42.
62. Thomas RJ. Arousals in sleep-disordered breathing: patterns and implications. Sleep 2003; 26: 1042-7.
63. Narkiewicz K, Somers VK. The sympathetic nervous system and obstructive sleep apnea: implications for hypertension. J Hypertens 1997; 15: 1613-9.
64. Cooper V, Pearson S, Bowker C, Elliott M, Hainsworth R. Interaction of chemoreceptor and baroreceptor reflexes by hypoxia and hypercapnia-a mechanism for promoting hypertension in obstructive sleep apnoea. J Physiol 2005; 568: 677-87.
65. Gladstone DJ, Spring M, Dorian P, et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014; 370: 2467-77.
66. Mansukhani MP, Calvin AD, Kolla BP, et al. The association between atrial fibrillation and stroke in patients with obstructive sleep apnea: a population-based case-control study. Sleep Med 2013; 14: 243-6.
67. Kar S. Cardiovascular implications of obstructive sleep apnea associated with the presence of a patent foramen ovale. Sleep Med Rev 2014; 18: 399-404.
68. Johansson MC, Eriksson P, Dellborg M. The significance of patent foramen ovale: a current review of associated conditions and treatment. Int J Cardiol 2009; 134: 17-24.
69. Shanoudy H, Soliman A, Raggi P, Liu JW, Russell DC, Jarmukli NF. Prevalence of patent foramen ovale and its contribution to hypoxemia in patients with obstructive sleep apnea. Chest 1998; 113: 91-6.
70. Rimoldi SF, Ott S, Rexhaj E, et al. Patent foramen ovale closure in obstructive sleep apnea improves blood pressure and cardiovascular function. Hypertension 2015; 66: 1050-7.
71. Nopmaneejumruslers C, Kaneko Y, Hajek V, Zivanovic V, Bradley TD. Cheyne-Stokes respiration in stroke: relationship to hypocapnia and occult cardiac dysfunction. Am J Respir Crit Care Med 2005; 171: 1048-52.
72. Rowat AM, Wardlaw JM, Dennis MS. Abnormal breathing patterns in stroke: relationship with location of acute stroke lesion and prior cerebrovascular disease. J Neurol Neurosurg Psychiatry 2007; 78: 277-9.
73. Siccoli MM, Valko PO, Hermann DM, Bassetti CL. Central periodic breathing during sleep in 74 patients with acute ischemic stroke–neurogenic and cardiogenic factors. J Neurol 2008; 255: 1687-92.
74. Ryan CM, Bayley M, Green R, Murray BJ, Bradley TD. Influence of continuous positive airway pressure on outcomes of rehabilitation in stroke patients with obstructive sleep apnea. Stroke 2011; 42: 1062-7.
75. Katzan IL, Thompson NR, Uchino K, Foldvary-Schaefer N. A screening tool for obstructive sleep apnea in cerebrovascular patients. Sleep Med 2016; 21: 70-6.
76. Kapur VK, Auckley DH, Chowdhuri S, et al. Clinical practice guideline for diagnostic testing for adult obstructive sleep apnea: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med 2017; 13: 479-504.
77. Boulos MI, Elias S, Wan A, et al. Unattended hospital and home sleep apnea testing following cerebrovascular events. J Stroke and Cerebrovasc Dis 2017; 26: 143-9.
78. Ryan CM, Wilton K, Bradley TD, Alshaer H. In-hospital diagnosis of sleep apnea in stroke patients using a portable acoustic device. Sleep Breath 2017; 21: 453-60.
79. Kotzian ST, Schwarzinger A, Haider S, Saletu B, Spatt J, Saletu MT. Home polygraphic recording with telemedicine monitoring for diagnosis and treatment of sleep apnoea in stroke (HOPES Study): study protocol for a single-blind, randomised controlled trial. BMJ Open 2018; 8: e018847.
80. Weaver TE, Grunstein RR. Adherence to continuous positive airway pressure therapy: the challenge to effective treatment. Proc Am Thorac Soc 2008; 5: 173-8.
81. Brill A-K, Horvath T, Seiler A, et al. CPAP as treatment of sleep apnea after stroke: A meta-analysis of randomized trials. Neurology 2018; 90: e1222-30.
82. Good DC, Henkle JQ, Gelber D, Welsh J, Verhulst S. Sleep-disordered breathing and poor functional outcome after stroke. Stroke 1996; 27: 252-9.
83. Sandberg O, Franklin KA, Bucht G, Gustafson Y. Sleep apnea, delirium, depressed mood, cognition, and ADL ability after stroke. J Am Geriatr Soc 2001; 49: 391-7.
84. Bravata DM, Concato J, Fried T, et al. Continuous positive airway pressure: evaluation of a novel therapy for patients with acute ischemic stroke. Sleep 2011; 34: 1271.
85. Minnerup J, Ritter MA, Wersching H, et al. Continuous positive airway pressure ventilation for acuteischemic stroke: a randomized feasibility study. Stroke 2012; 43: 1137-9.
86. Bravata DM, Concato J, Fried T, et al. Auto-titrating continuous positive airway pressure for patients with acute transient ischemic attack. Stroke 2010; 41: 1464-70.
87. Aaronson J, Hofman W, van Bennekom C, et al. Effects of continuous positive airway pressure on cognitive and functional outcome of stroke patients with obstructive sleep apnea: A randomized controlled trial. J Clin Sleep Med 2016; 12: 533-41.
88. Parra O, Sánchez‐Armengol Á, Capote F, et al. Efficacy of continuous positive airway pressure treatment on 5‐year survival in patients with ischaemic stroke and obstructive sleep apnea: a randomized controlled trial. J Sleep Res 2015; 24: 47-53.
89. Bravata DM, Yaggi HK. Response to the letter to the editor from Parra and Arboix. Sleep 2012; 35: 749.
90. Duss SB, Seiler A, Schmidt MH, et al. The role of sleep in recovery following ischemic stroke: a review of human and animal data. Neurobiol Sleep Circadian Rhythms 2017; 2: 94-105.
91. Gupta A, Shukla G, Afsar M, et al. Role of positive airway pressure therapy for obstructive sleep apnea in patients with stroke: a randomized controlled trial. J Clin Sleep Med 2018; 14: 511-21.
92. McEvoy RD, Antic NA, Heeley E, et al. CPAP for prevention of cardiovascular events in obstructive sleep apnea. N Engl J Med 2016; 375: 919-31.
93. Martínez-García MA, Galiano-Blancart R, Román-Sánchez P, Soler-Cataluna JJ, Cabero-Salt L, Salcedo-Maiques E. Continuous positive airway pressure treatment in sleep apnea prevents new vascular events after ischemic stroke. Chest 2005; 128: 2123-9.
94. Borsini E, Decima T. ¿Cómo debemos organizar el seguimiento de los pacientes con síndrome de apneas-hipopneas durante sueño? Rev Am Med Resp 2014; 14: 187-9.
95. Tsivgoulis G, Alexandrov AV, Katsanos AH, et al. Noninvasive ventilatory correction in patients with acute ischemic stroke: a systematic review and meta-analysis. Stroke 2017; 48: 2285-8.
