Resumen Las encefalitis autoinmunes son un nuevo grupo de enfermedades de gran trascendencia clínica
y terapéutica debido a la buena respuesta en gran parte de los casos a la terapia inmunomoduladora indicada, con un gran porcentaje de curación, sin secuelas neurológicas importantes (cognitivo, motor, crisis o movimientos involuntarios). En el año 2007 se demostró la presencia de auto anticuerpos neuronales en la patogenia de este grupo de enfermedades, con síntomas psicóticos y de movimientos involuntarios como indicadores de la enfermedad. La presente revisión enfatiza el salto crucial y el cambio de paradigmas suscitados tras el descubrimiento de estas encefalitis asociadas a anticuerpos.
Palabras clave: encefalitis autoinmune, auto anticuerpos anti neuronales, encefalitis límbica
Abstract Autoimmune encephalitis. New diagnosis for an old condition. Autoimmune encephalitis is a
new group of diseases of great clinical and therapeutic importance due to the good response in most cases to the immunomodulatory therapy indicated, with a large percentage of healing without significant neurological effects (cognitive, motor, seizures or involuntary movements). Since 2007, the presence of neuronal autoantibodies in the pathogenesis of this group of diseases has been demonstrated, with psychotic symptoms and involuntary movements as clinical markers of the disease. The present review emphasizes the crucial leap and change of paradigms arising after the discovery of these encephalitis associated with antibodies.
Key words: autoimmune encephalitis, antineuronal auto antibodies, limbic encephalitis
e-mail: rco@neuropediatrica.com
Muy pocos descubrimientos en el campo de la neurología y de la neuropediatría han tenido tanto impacto como el descubrimiento de la patogenia de los anticuerpos anti neuronales (AAN) en las encefalitis, previamente consideradas de causa “viral” o “aséptica” y reconocidas actualmente como de etiología autoinmune1. Cuadros clínicos característicos con alteración del nivel de conciencia, movimientos involuntarios facio-oro-linguales, atetósicos, junto a un estado alucinatorio permanente u ondulante, o simplemente acompañados de una rigidez catatónica, fueron vistos en las camas de los hospitales, sin poder encontrar un tratamiento eficaz por décadas. Siglos antes, muchas de estas encefalitis eran atribuidas a causas mágico-religiosas y de posesión demoníaca2. El reconocimiento de esta nueva entidad, que permitió el “salto crucial” en este campo de la neurología, se produjo con el descubrimiento de un nuevo grupo de encefalitis asociadas a anticuerpos contra estructuras de la misma neurona –encefalitis autoinmune (EAI)– ocasionando por tanto un cambio de paradigma: las encefalitis asépticas tienen un origen inmunológico y se pueden diagnosticar, tratar, y mejorar drásticamente y radicalmente el resultado final de la afección, eliminando las secuelas comúnmente encontradas, permitiendo el auge de una nueva subespecialidad, la neuroinmunología.
Antecedentes
Entre 1917 y 1928, varios millones de personas murieron en Europa oriental, debido a un tipo de encefalitis epidémica, conocida como encefalitis letárgica o “enfermedad del sueño”, descrita por el médico psiquiatra rumano, Constantin von Economo. Produjo una gran mortalidad, y morbilidad en los pacientes afectados, con trastornos motores y rigidez invalidantes en los supervivientes, dejándolos postrados, en un estado más o menos profundo de estupor e inconsciencia3, 4. Diversas hipótesis etiológicas fueron estimadas en esa época como causa posible de la pandemia, se pensó primeramente en la afectación directa por el virus de la influenza, o del estreptococo del grupo A5. Años después, estudiando los sueros de las personas convalecientes de la epidemia de encefalitis letárgica, se encontró seroconversión a diversos virus como Coxsackie B3, virus de la encefalitis japonesa, virus de la influenza N1H1, virus de St. Louis, virus del herpes humano tipo 8, virus del Nilo Occidental y poliovirus. Las autopsias evidenciaron una afectación prevalente de ganglios basales y cerebro medio6. Otra variante clínica con afectación del sistema límbico con síntomas de agitación, alucinaciones auditivas, problemas de memoria e impulsividad, se la denominó encefalitis límbica (EL). Posteriormente, ya en fase de estudios, se describió la encefalitis alérgica experimental como una entidad con clara sospecha de un mecanismo autoinmune involucrado. Con el advenimiento de la resonancia magnética cerebral (RM), se pudieron documentar encefalitis autoinmunes de localización extra límbica.
Los primeros síndromes paraneoplásicos asociados a síntomas neurológicos fueron descritos en un grupo de pacientes portadores de tumores causantes de enfermedades distintas a la condición puramente neoplásica. Dentro de este grupo, los tumores pulmonares de células en avena (SCLC), neuroblastomas, timomas, teratomas y de células germinales, son los más frecuentemente citados.
Si bien ya había comunicaciones que indicaban una asociación entre enfermedad neurológica y cáncer, el salto crucial se produjo en el año 2007, cuando el Dr. Joseph Dalmau junto a un grupo de investigadores de la universidad de Pensilvania (EE. UU.), lograron el aislamiento de anticuerpos contra la sub unidad 1 A del receptor NMDA de glutamato, en un grupo de mujeres jóvenes portadoras de teratomas ováricos y cuadros psiquiátricos paraneoplásicos7. Desde entonces, se han descrito nuevos anticuerpos antineuronales (AAN) asociados a nuevas enfermedades de características inmunofenotípico-específicas. De todo lo comentado se desprende la clasificación de las encefalitis autoinmunes que se muestra en la Tabla 1.
Los anticuerpos antineuronales (AAN), involucrados en la patogenia de las EAI, son de dos tipos: de superficie e intracelulares. De los AAN de superficie, el anti-NMDA-R es el más representativo, afectando al receptor ionotrópico del glutamato, presente en la membrana post sináptica neuronal, localizado prevalentemente en la región hipocampal del lóbulo temporal y en otras zonas del sistema límbico, pudiendo estar asociado a síndromes paraneoplásicos como los ya descritos y también a reacciones antígeno-anticuerpo producidos por cuadros para o postinfecciosos virales o bacterianos, o postvacunales, frecuentemente relacionados con niños. Se los denomina también patogénicos debido a que es la afección del receptor(s) lo que condiciona la disfunción de los canales iónicos involucrados, distorsionando la función de la misma neurona. Estos anticuerpos contra antígenos de superficie de la membrana celular son un grupo heterogéneo que se han ido describiendo en forma progresiva, así se tienen aquellos contra el complejo VGKC (LGI1, CASPR2, contactin-2) y los receptores NMDA, AMPA, GABAA, GABAB y glicina.
En esta categoría es mucho menos frecuente la asociación con malignidad y se piensa que la enfermedad neurológica está mediada por los propios anticuerpos. En estas enfermedades, aunque la afectación pueda ser muy grave, dichas encefalitis son muy sensibles a las terapias inmunomoduladoras.
Los anticuerpos intracelulares fueron los primeros en los que se sospechó su existencia. Son denominados también onconeuronales porque se encuentran asociados a tumores y a síndromes paraneoplásicos. Debido a la presencia de tumor, la respuesta al tratamiento y su pronóstico no son tan buenos. El daño neuronal ocasionado es casi siempre irreversible y el pronóstico es usualmente pobre, con excepción del anticuerpo anti-GAD, donde los pacientes pueden tener encefalopatía isquémica hipóxica (AIE), epilepsia u otros síndromes neurológicos, la asociación a tumores es muy poco frecuente y la recuperación es posible, aunque los pacientes a menudo son menos reactivos a las inmunoterapias, salvo el caso del Ma2 asociado a cáncer testicular, que es curable en un inicio.
Se dicen que son no patogénicos porque no actúan directamente sobre las estructuras neuronales, sino a través de mecanismos citotóxicos involucrados a los linfocitos T.
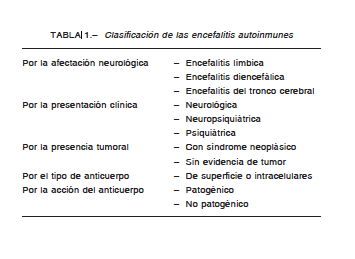

Se describen los más frecuentes: HU, MA2-1, CV2, GAD y la antifisina en la Tabla 2.
Cuadro clínico
Debido al aumento en tipos de anticuerpos anti neuronales descubiertos, los cuadros clínicos son cada vez más diversos en cuanto a presentación, afectación por género, asociación a neoplasias, síntomas acompañantes, afección topográfica y/o funcional neurológica. Sin embargo, los signos cardinales de las EAI en la gran mayoría de los casos, son el deterioro de la memoria a corto plazo, que suele desarrollarse durante semanas o meses, síntomas psiquiátricos (irritabilidad, depresión y alucinaciones) y convulsiones meso temporales. Aparte de este típico “síndrome límbico”, existen otras características neurológicas asociadas que a menudo reflejan la presencia de diferentes anticuerpos asociados, produciendo inmunofenotipos o diversas EAI8.
Anticuerpos contra antígenos de membrana celular
– Anticuerpos anti-NMDA-R: Afectan a los receptores ionotrópicos del glutamato, llamados R-NMDA, que son canales iónicos dependientes del ligando e importantes en los procesos de transmisión sináptica y plasticidad neuronal. Estos receptores tienen dos subunidades: NR1 (al cual se liga la glicina) y NR2 (al cual se liga el glutamato). La activación exagerada de los receptores NMDA produce excitotoxicidad, un mecanismo que puede producir muerte neuronal y que se ha postulado como un factor importante en la génesis de la epilepsia, demencia y enfermedad cerebrovascular. Se describió inicialmente en mujeres jóvenes con teratomas ováricos, preferentemente negras. En población masculina y pediátrica se describe no asociada a enfermedad tumoral, aunque existen excepciones a la regla.
El cuadro clínico característico comienza con una etapa psicótica y convulsiones, seguida por reducción de la conciencia, inestabilidad autonómica (que incluye fluctuación de la presión arterial y temperatura, taquicardia, bradicardia, pausas cardíacas y diaforesis). Las disquinesias oral-lingual-faciales son las más características, pero también pueden ocurrir otros movimientos anormales, como opistótonos y estado catatónico. Una característica curiosa es una respuesta disociativa a los estímulos: los pacientes pueden resistir la apertura de los ojos, pero muestran una respuesta reducida o ausente a los estímulos dolorosos. La ventilación invasiva y la admisión a una unidad de cuidados intensivos son frecuentemente necesarias. Las recaídas de la enfermedad pueden ocurrir en el 15-25% de los casos, especialmente en los no paraneoplásicos sin inmunoterapia adecuada durante su episodio encefalítico previo. En cuanto a las investigaciones, el líquido cefalorraquídeo (LCR) revela típicamente una pleocitosis linfocítica temprana seguida de síntesis intratecal de anticuerpos. La RM suele ser normal, pero los cambios pueden observarse en la región medial de los lóbulos temporales y en la sustancia blanca.
– VGKC-complejo (LGI1, CASPR2, contactin-2): Se ha reconocido recientemente que los anticuerpos VGKC están dirigidos no directamente al canal de potasio sino a componentes particulares del complejo VGKC, más comúnmente LGI1, CASPR2 y contactin-2, que fue el primero en ser reconocido en esta categoría. Presenta encefalitis límbica asociada a compromiso temprano de la memoria a corto plazo y crisis epilépticas. La presentación afecta preferentemente a los hombres, en una relación de 2:1, siendo los mayores de 40 años el grupo etario más prevalente. Pueden presentar trastornos de conducta durante la fase REM del sueño, hipotermia, síndrome de persona rígida, ataxia, cuadros de pseudooclusión intestinal y crisis distónicas faciobraquiales (FBDS), caracterizadas por breves paroxismos asimétricos en cara y brazo del mismo lado, se ha asociado a LGI1. Esta sigla corresponde a la leucina rich glioma inactivated protein 1, que es una proteína secretada por las neuronas y produce hiperexcitabilidad, interactuando pre sinápticamente (ADAM23), o post sinápticamente (ADAM 22), asociadas también a epilepsias genéticas o hereditarias9, 10. Los movimientos no están restringidos a extremidades superiores o región orofacial, puede haber un correlato entre crisis tónicas características pero no patognomónicas y EEG con ondas beta. El LCR puede ser normal o con moderada linfocitosis y aumento de proteínas. El 80% responde a esteroides, IgIV o plasmaféresis. Un 60% cursa con hiponatremia por síndrome de secreción inadecuada de hormona antidiurética (SIADH).
Los anticuerpos anti CASPR-2 son parte de este complejo de canales de potasio voltaje-dependientes, la CASPR-2, llamada así por “proteína símil asociado a contactina-2”, es una proteína axonal asociada a la familia de las neurexinas, localizado en la región yuxtanodal en el hipocampo y cerebelo11. Los pacientes afectados están entre los 19 a 80 años, en promedio mayores de 60, con encefalitis difusa, multifocal, límbica, ataxia y mioclonus, puede asociarse también hiperexcitabilidad del nervio periférico y neuromiotonía adquirida o síndrome de Isaac, caracterizado por ser un desorden inmunomediado de la neurona motora periférica asociado a una actividad continua de la fibra muscular en reposo, dando como consecuencia rigidez muscular, mioquimia, pseudomiotonía o la combinación de ambos, o síndrome de Morvan asociado a encefalopatía e insomnio, con alto riesgo de timomas12. Los calambres y fasciculaciones, que pueden preceder a la EL, en un 62% presenta dolor neuropático, arreflexia, hipoestesia, disfunción autonómica (hiperhidrosis e inestabilidad cardiovascular) y debilidad muscular. El LCR muestra pleocitosis hasta en un 25%, con proteinorraquia y bandas oligoclonales positivas. En la RM, típicamente puede observarse afección del lóbulo mesial temporal, en T2 y FLAIR y se describe hasta en un 84% de los casos. Rara vez se asocia a tumores de células en avena (SCLC) o timomas y leucemia mieloide, la recaída es inusual.
– AMPA-R: Afecta los receptores metabotrópicos de glutamato, que consta de dos subunidades: GluR1y GluR2. Está descrito que afecta a mujeres quienes tiene EAI con frecuentes recaídas, en el 64% de los casos se asocia a cáncer de mama o SCLC. El LCR muestra pleocitosis y síntesis intratecal de proteínas13.
– GABA A: Tiene un inicio temprano de los síntomas, con convulsiones prominentes y frecuentemente estatus epilépticos, están asociadas a EL, se describe asimismo rash, cefalea y movimientos involuntarios14. La afectación topográfica es multifocal, con involucro de lóbulos frontales, temporales y occipitales. Se ha asociado a pacientes con miastenia gravis y timomas. Se produce una disminución del número de receptores GABA A en las sinapsis15,16.
– GABA B: Produce pérdida de memoria, crisis convulsivas prominentes y cuadros confusionales asociados a EL. Se ha asociado a SCLC. La neuroimagen presenta hiperintensidad en la región medial de los lóbulos temporales. Se ha descrito síndrome de opsoclonus mioclonus asociado a este anticuerpo17, 18.
– GLICINA-R: Produce encefalomielitis rápidamente progresiva con mioclonus y rigidez (PERM), con hiperecplexia, signos de tronco cerebral o espasmos musculares. Un 10% presenta el inmunofenotipo de síndrome de persona rígida. La RM es normal, mientras que el LCR muestra cambios inflamatorios.
– m-GLUR: Está asociado a un cuadro típico de EL y a linfoma de Hodking -síndrome de Ofelia- , donde hay involucro del córtex del lóbulo parieto-occipital, además del sistema límbico. El LCR presenta pleocitosis. Se ha informado en niños síndrome séptico, movimientos involuntarios óculo-facio-linguales, rigidez, signos cerebelosos con disartria y ataxia19, 20.
– Dopamina D2: La encefalitis de ganglios basales se presenta frecuentemente en niños (1:1) en etapa escolar. Se describen EL con síntomas psiquiátricos como psicosis y trastorno de los movimientos, como parkinsonismo, un tercio corea de Sydenham, un 10% síndrome de Guilles de La Tourette. La fisiopatología está asociada a la internalización del receptor DR2, con disminución de su densidad en la superficie.
– DPPX: Encefalitis asociada a confusión, diarrea, pérdida de peso, también puede haber temblores e hiperecplexia. No produce alteraciones en las neuroimágenes. Se asocia a cánceres de células B. Hay internalización del receptor de superficie DPPX y Kv4.221.
– Neuroexina 3α: Presenta crisis convulsivas y cuadros confusionales. Se produce la internalización de la neuroexina en las sinapsis neuronales en desarrollo. No se asocia a cuadro neoplásico.
Anticuerpos contra antígenos intracelulares
Estos se han descrito en síndromes paraneoplásicos y representan marcadores de tumores en diversas localizaciones.
– Hu (ANNA-1): Es el más común dentro de los oncoautoanticuerpos. El factor de riesgo más frecuentemente asociado es el tabaquismo, y preferentemente en varones. Están presentes en el 75% de los pacientes que tienen carcinoma de pulmón de células pequeñas (CPCP). Estos pueden afectar cualquier parte del sistema nervioso, como el cerebelo en el opsoclonus mioclonus, o afectación de nervios periféricos, ganglios de la raíz dorsal y médula espinal. El pronóstico suele ser pobre a pesar de la inmunoterapia. Se describe síndrome de Ondina de origen paraneoplásico asociado a anti Hu y Zic48, 22 .
-Ma 2 (Ta): Produce compromiso hipotalámico, causando somnolencia diurna, narcolepsia, cataplejía, hiperfagia y déficits hormonales. Produce disfunción a nivel del tronco encefálico causando parálisis de la mirada supra nuclear. Está asociado con el tumor testicular de células germinales en los hombres más jóvenes, pero en los individuos mayores puede haber un CPCP subyacente o cáncer de mama. Los hombres con encefalitis de anticuerpos Ma2, en los que no hay tumor testicular detectable, pueden tener un tumor microscópico por debajo del umbral de detección de las técnicas de imagen. Por esta razón, la orquidectomía puede ser necesaria antes del deterioro clínico23, 24.
– CV2 (CRMP5): Produce síntomas neurológicos como corea, opsoclonus, característicamente hay afección de ganglios basales conocida como encefalitis estriatal. La afección de otros sistemas han sido documentados, sistema visual (uveítis, neuritis óptica).
Puede haber un SCLC subyacente, timomas maligno u otros tumores25.
– Anti GAD: Aunque la descarboxilasa del ácido glutámico -GAD- es una enzima intracelular, los anticuerpos dirigidos contra esta enzima se asocian generalmente con AIE no paraneoplásica. Tiende a ocurrir en mujeres sin ningún tumor identificado. La epilepsia resistente a fármacos es común y los anticuerpos anti GAD también están asociados con el síndrome de la persona dura o del hombre rígido y la ataxia26. Estos anticuerpos son muy comunes en otros trastornos autoinmunes, típicamente diabetes mellitus tipo 1, a menudo en niveles más bajos27.
– YO-(PCA-1) y RI-(ANNA2): Se asocia a degeneración cerebelosa paraneoplásica, opsoclonus mioclonus, encefalitis de tronco, concurrentemente a cáncer de mama, ovario y útero en mujeres, y cáncer de pulmón en hombres.
Diagnóstico
Debe tenerse en cuenta la presencia de cuadros confusionales, psicóticos o epilépticos de novo, es decir en pacientes sin antecedentes personales ni familiares previos, con síntomas de inicio subagudo dominando notoriamente el cuadro clínico, la encefalopatía asociado a movimientos involuntarios oro-linguales, coreicos o posturas rígidas, incluso opistótonos, característicamente con muy poca fiebre, o ausencia de la misma, LCR relativamente poco
Fig. 1.– Esquema de tratamiento protocolizado (ESSALUD/Hospital Nacional Edgardo Rabagliati Martins, Lima, Perú)
EAI: Encefalitis autoinmune; TEM: Tomografía helicoidal multicorte; PL: Punción lumbar; AAN: Anticuerpos antinucleares; RM: Resonancia magnéticapatológico y estudios virales de PCR negativos para los principales virus estacionales. Las imágenes de RM nos ayudan en un grupo de EAI, pero su normalidad no las descarta, de hecho la positividad es 40-60% y se acerca al 90% si la asociamos a un PET28,29. El EEG puede presentar ondas característica denominadas delta brush, lentificación difusa del ritmo de base o grafo elementos paroxísticos en caso de epilepsias o estatus epilépticos refractarios de origen inmunomediado.
Conducta y tratamiento
Los pacientes deben estar vigilados y monitorizados tanto por el compromiso del sensorio, que muchas veces es fluctuante, como por la inestabilidad autonómica concurrente. La toma de muestras de LCR y plasma previa a cualquier intervención terapéutica es importante, la congelación de la muestra y en caso que no se pueda hacer inmediatamente, el estudio de anticuerpos es una práctica usual. El tratamiento con corticoides y gammaglobulinas en forma empírica a las dosis recomendadas debe ser precoz, ya que mejora el pronóstico, y el uso de plasmaféresis, en casos seleccionados, constituyen el arsenal de primera línea, pudiendo darse uno o más pulsos de metilprednisolona o cursos de inmunoglobulinas, en caso que sea necesario debido a la gravedad de los síntomas, o recurrir a rituximab como droga de segunda línea30 (Fig. 1). La mayoría recobra su estado de postración, sin secuelas neurológicas evidentes (más
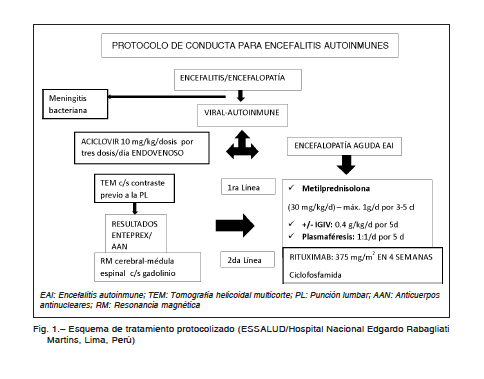
del 80%), un pequeño porcentaje tiene una evolución más tórpida, con recuperación tardía. En niños no hemos visto recaídas, debido a que son pocos los casos asociados a tumores, en caso que existieran, la exéresis del tumor es el tratamiento de elección.
En conclusión, ha sido reconocida una nueva enfermedad, demostrándose excelente respuesta al tratamiento con inmunomoduladores. Sin embargo, queda por consensuar en base a la evidencia descrita, guías de manejo adecuadas a nuestra realidad, la respuesta al tratamiento indicado, el grado probado de efectividad y el reconocimiento de estos medicamentos como piedra angular del manejo. Requerimos por tanto que las EAI sean agregadas a las indicaciones de medicamentos de alto costo -gammaglobulinas y rituximab- dentro del inserto o etiqueta, dada la actual evidencia para el tratamiento de esta y otras enfermedades de origen autoinmune.
De esta manera podrán ser más fácilmente accesibles, ya que el actual manejo fuera de «etiqueta» es una realidad con la cual es difícil lidiar, al crear vacíos terapéuticos y posteriormente legales e impide tratar estas EAI, dificultando el resultado óptimo al tener la mayoría de las veces un tratamiento poco oportuno y con severas restricciones para su uso.
Conflicto de intereses: Ninguno que declarar
Bibliografía
1. Bseikri MR, Barton JR, Kulhanjian JA, et al. Anti-N-methyl D-aspartate receptor encephalitis mimics viral encephalitis. Pediatr Infect Dis J 2012; 31:202-4.
2. Lhermitte J. Demonomania caused by epidemic lethargic encephalitis. Prog Med (Paris) 1955; 83:115-6.
3. Lethargic Encephalitis. Br Med J 1919; 1:45-6.
4. Dhunjibhoy JE. Encephalitis lethargica- A brief description of the disease, with short notes on the post-encephalitic lethargic cases treated at the Ranchi Indian Mental Hospital. Ind Med Gaz 1929; 64:362-71.
5. Calvo Melendro J, Sanchez-Malo Granados P. Encefalitis letárgica. Rev Clin Esp 1957; 67:184-6.
6. Anderson NE. Limbic encephalitis and anti-neuronal antibodies. Pathology 1989; 21:152-3.
7. Dalmau J, Tuzun E, Wu HY, et al. Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Ann Neurol 2007; 61:25-36.
8. Dalmau J, Furneaux HM, Rosenblum MK, Graus F, Posner JB. Detection of the anti-Hu antibody in specific regions of the nervous system and tumor from patients with paraneoplastic encephalomyelitis/sensory neuronopathy. Neurology 1991; 41:1757-64.
9. Sweeney M, Galli J, McNally S, et al. Delayed LGI1seropositivity in voltage-gated potassium channel (VGKC)-complex antibody limbic encephalitis. BMJ Case Rep 2017; pii: bcr201621889.
10. Li Z, Cui T, Shi W, Wang Q. Clinical analysis of leucine-rich glioma inactivated-1 protein antibody associated with limbic encephalitis onset with seizures. Medicine (Baltimore) 2016; 95:e4244.
11. Joubert B, Saint-Martin M, Noraz N, et al. Characterization of a subtype of autoimmune encephalitis with anti-contactin-associated protein-like 2 antibodies in the cerebrospinal fluid, prominent limbic symptoms, and seizures. JAMA Neurol 2016; 73:1115-24.
12. Patterson KR, Dalmau J, Lancaster E. Mechanisms of Caspr2 antibodies in autoimmune encephalitis and neuromyotonia. Ann Neurol 2018; 83:40-51.
13. Lai M, Hughes EG, Peng X, et al. AMPA receptor antibodies in limbic encephalitis alter synaptic receptor location. Ann Neurol 2009; 65:424-34.
14. Petit-Pedrol M, Armangue T, Peng X, et al. Encephalitis with refractory seizures, status epilepticus, and antibodies to the GABAA receptor: a case series, characterisation of the antigen, and analysis of the effects of antibodies. Lancet Neurol 2014; 13:276-86.
15. Simabukuro MM, Petit-Pedrol M, Castro LH, et al. GABAA receptor and LGI1 antibody encephalitis in a patient with thymoma. Neurol Neuroimmunol Neuroinflamm 2015; 2:e73.
16. Spatola M, Petit-Pedrol M, Simabukuro MM, et al. Investigations in GABAA receptor antibody-associated encephalitis. Neurology 2017; 88:1012-20.
17. Lancaster E, Lai M, Peng X, et al. Antibodies to the GABA(B) receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurol 2010; 9:67-76.
18. Hoftberger R, Titulaer MJ, Sabater L, et al. Encephalitis and GABAB receptor antibodies: novel findings in a new case series of 20 patients. Neurology 2013; 81:1500-6.
19. Mat A, Adler H, Merwick A, et al. Ophelia syndrome with metabotropic glutamate receptor 5 antibodies in CSF. Neurology 2013; 80:1349-50.
20. Spatola M, Sabater L, Planaguma J, et al. Encephalitis with mGluR5 antibodies: Symptoms and antibody effects. Neurology 2018; 90:e1964-e1972.
21. Piepgras J, Holtje M, Michel K, et al. Anti-DPPX encephalitis: pathogenic effects of antibodies on gut and brain neurons. Neurology 2015; 85:890-7.
22. Bataller L, Wade DF, Graus F, Stacey HD, Rosenfeld MR, Dalmau J. Antibodies to Zic4 in paraneoplastic neurologic disorders and small-cell lung cancer. Neurology 2004; 62:778-82.
23. Kimura M, Onozawa M, Fujisaki A, et al. Anti-Ma2 paraneoplastic encephalitis associated with testicular germ cell tumor treated by carboplatin, etoposide and bleomycin. Int J Urol 2008; 15:942-3.
24. Mathew RM, Vandenberghe R, Garcia-Merino A, et al. Orchiectomy for suspected microscopic tumor in patients with anti-Ma2-associated encephalitis. Neurology 2007; 68:900-5.
25. Sabater L, Saiz A, Dalmau J, Graus F. Pitfalls in the detection of CV2 (CRMP5) antibodies. J Neuroimmunol 2016; 290:80-3.
26. Schiff D, Dalmau J, Myers DJ. Anti-GAD antibody positive stiff-limb syndrome in multiple myeloma. J Neurooncol 2003; 65:173-5.
27. Akin O, Kilinc Ugurlu A, Akbas ED, et al. Autoimmune limbic encephalitis associated with type 1diabetes mellitus. J Clin Res Pediatr Endocrinol 2017; 9:387-8.
28. Leypoldt F, Buchert R, Kleiter I, et al. Fluorodeoxyglucose positron emission tomography in anti-N-methyl-D-aspartate receptor encephalitis: distinct pattern of disease. J Neurol Neurosurg Psychiatry 2012; 83:681-6.
29. Graus F, Dalmau J. Role of (18)F-FDG-PET imaging in the diagnosis of autoimmune encephalitis – Authors’ reply. Lancet Neurol 2016; 15:1010.
30. Lee WJ, Lee ST, Byun JI, et al. Rituximab treatment for autoimmune limbic encephalitis in an institutional cohort. Neurology 2016; 86:1683-91.
