Resumen Las enfermedades autoinmunes del sistema nervioso periférico son frecuentes en pediatría. Las
más importantes son el síndrome de Guillain-Barré, la miastenia gravis juvenil y la dermatomiositis juvenil. Tienen en común ser causadas por acción de anticuerpos específicos que producen la signología clínica, reacción que puede ser gatillada por un cuadro viral o bacteriano, como ocurre principalmente en SGB. La polineuropatía aguda inflamatoria desmielinizante es más frecuente. Existe también la forma axonal motora. Ambas tienen clínica progresiva ascendente. El tratamiento específico es la inmunoglobulina 2 g/ kg. La miastenia gravis juvenil se expresa por signos oculares, generalizados y fatigabilidad fluctuante. Puede comprometer la función respiratoria desencadenando crisis miasténica. Se trata con anticolinesterásicos, corticoides, inmunoglobulinas e inmunosupresores. La timectomía ha mostrado recientemente su efectividad. La dermatomiositis juvenil se expresa por signos cutáneos y musculares. Se diagnostica por elevación de enzimas musculares, biopsia y resonancia musculares y se trata con corticoides, inmunoglobulinas e inmunosupresores. Tanto el síndrome de Guiilain-Barré, como la miastenia gravis y la dermatomiositis juvenil, tienen buen pronóstico.
Palabras clave: síndrome de Guillain-Barré, miastenia gravis juvenil, dermatomiositis, inmunoglobulina, corticoides, timectomía
Abstract Peripheral nervous system immunological disorder. Autoimmune diseases of the peripheral
nervous system are common in pediatrics. Guillain-Barré syndrome, juvenile myasthenia gravis, and juvenile dermatomyositis are the most important. Their common pathogenesis involves the action of specific autoantibodies which are frequently triggered by viral or bacterial infection. Acute inflammatory demyelinating polyneuropathy is the most frequent pathological feature. There is also a motor axonal form. Both have a progressive ascending clinical course. The specific treatment is immunoglobulin 2 g/kg. Juvenile myasthenia gravis is expressed by ocular signs and generalized and fluctuating fatigability. It can involve respiratory functions triggering a myasthenic crisis. It is treated with anticholinesterase agents, corticosteroids, immunoglobulins, and immunosuppressants. Thymectomy has recently shown effectiveness. Juvenile dermatomyositis is expressed by skin and muscle signs. Elevated muscle enzymes, muscle biopsy, and magnetic resonance imaging contribute to the diagnosis. It is treated with corticosteroids, immunoglobulins, and immunosuppressants. All three disorders, Guillain-Barré, juvenile myasthenia gravis, and juvenile dermatomyositis have a good prognosis.
Key words: Guillain-Barré syndrome, juvenile myasthenia gravis, dermatomyositis, corticoids, immunoglobuline, thymectomy
e-mail: ricardoerazo@yahoo.com
Las enfermedades inmunomediadas del sistema nervioso periférico (SNP) son cuadros adquiridos que se expresan fundamentalmente como parálisis flácida aguda, denominada también debilidad muscular aguda.
Se trata específicamente de cuadros que comprometen la unidad motora en cualquiera de sus niveles: motoneurona inferior, nervio periférico, unión neuromuscular y músculo. Los cuadros más frecuentes son el síndrome de Guillain Barré, la miastenia gravis y la dermatomiositis, que se describirán en detalle por la importancia que tiene su detección temprana y tratamiento precoz para fines pronósticos.
Polineuropatía aguda inflamatoria o síndrome de Guillain Barré
La polineuropatía aguda inflamatoria o síndrome de Guillain Barré (SGB) es la causa principal de parálisis flácida aguda en pediatría desde que se erradicó la poliomielitis en casi todo el mundo1. Puede constituir del 30 al 70% de los casos de parálisis flácida aguda que se informan anualmente en EE. UU. Tiene una incidencia de 0.5-1.5 casos por 100 000 en poblaciones de 0-17 años2. Es un cuadro monofásico de progresión variable que suele llegar al máximo compromiso en 1 a 2 semanas. La forma más frecuente es la polineuropatía inflamatoria aguda desmielinizante (AIDP) sensitivo-motora que representa el 85-90% de los casos en Norteamérica, Europa y la mayoría de los países desarrollados3.
Fisiopatología
El SGB es en realidad un grupo de cuadros clínicos más que una entidad aislada, lo cual se refleja también en la fisiopatología. La lesión de la mielina en el SGB clásico y en el síndrome de Miller-Fisher (SMF) se produce por acción de la inmunidad humoral y celular. Existe una reacción cruzada de anticuerpos contra el gangliósido GM1en el SGB desmielinizante y axonal, y epítopes similares a gangliósidos del Campylobacter jejuni, especialmente los serotipos 019 y 041, lo que provoca daño axonal directo, pero también desmielinización en un porcentaje significativo de casos4-6. En el SMF la patogenia es similar, pero el gangliósido responsable es el GQ1b, presente en la mielina de los pares craneales y que es atacado por anticuerpos específicos contra el Campylobacter jejuni que muestran reacción cruzada contra él. Hay un anticuerpo que se correlaciona con SGB sin compromiso de pares craneales que es el antigangliósidos N-acetilgalactosaminil GD1a (GalNAc-GD1a). Este anticuerpo GD1a es el más específico en neuropatía axonal aguda motora (AMAN) y no se observa en AIDP4-6.
Clínica
Clínicamente el SGB comienza con debilidad distal de extremidades inferiores, con progresión simétrica ascendente en horas o días, 2 a 4 semanas después de infección respiratoria o gastrointestinal (60-70% de casos) de etiología bacteriana o viral (citomegalovirus, virus de Epstein-Barr, Campylobacter jejuni, etc.). En 30-40% de los casos existe compromiso de pares craneales, especialmente del VII par. El compromiso motor puede variar desde debilidad exclusiva de extremidades inferiores a cuadriplejia flácida con insuficiencia respiratoria1-6.
Además de AIDP, otra forma frecuente de SGB es la AMAN, descrita en 19867 y posteriormente observada en forma epidémica en el norte de China8, 9. Fue reconocida como entidad clínica en el año 1995 y actualmente se ha demostrado en todo el mundo, con mayor incidencia en China y Bangladesh6, 8, 9.
AIDP y AMAN son los dos tipos principales de SGB que se distinguen como desmielinizante (AIDP) y axonal (AMAN), en el cual la mielina no se afecta. Raramente el compromiso axonal involucra también los axones sensitivos, configurando un cuadro de SGB grave denominado neuropatía axonal sensitivo-motora aguda (ASMAN). El dolor neuropático es un signo común en todos los tipos de SGB pediátrico, especialmente al inicio del cuadro, por compromiso radicular o de nervio periférico a nivel cervical, lumbar o de extremidades, pero su localización es difícilmente reconocible en el niño que generalmente lo expresa por irritabilidad6, 8, 9.
Síndrome de Miller-Fisher
Un subtipo de SGB es el síndrome de Miller Fisher (SMF) que se caracteriza por la tríada clínica de ataxia, oftalmoplejia y arreflexia. El signo cardinal que lo diferencia de la encefalomielitis y encefalitis de Bickerstaff es la ausencia de ptosis palpebral y la presencia de parálisis de la mirada superior voluntaria con signo de Bell positivo5,6 (experiencia personal). Tiene pronóstico favorable y generalmente no requiere un tratamiento específico, pero cuando es más grave, el SMF responde a inmunoglobulina endovenosa (Ig EV). Existen variantes del SGB, como la neuropatía craneal múltiple, la debilidad faringo-cérvico-braquial (DFCB), paraparesia, diplejía facial/parestesias y combinación entre SMF y DFCB y entre SMF y SGB4-6.
Polineuropatía desmielinizante inflamatoria crónica
La polineuropatía desmielinizante inflamatoria crónica (CIPD) es una entidad diferente al SGB, puede tener inicialmente clínica similar a AIDP, pero la progresión de los síntomas va más allá de los 28 días e incluso puede seguir avanzando durante 2 o más meses. El compromiso es motor y sensitivo proximal y distal. Generalmente se afectan más las extremidades inferiores, pero puede predominar el compromiso de extremidades superiores. La debilidad suele ser simétrica y el compromiso sensitivo distal puede ser significativo5, 6, 10, 11. Un 5-35% de los casos de CIDP tienen predominio sensitivo, expresado por ataxia progresiva o compromiso sensitivo distal exclusivo11. El tratamiento del CIDP es diferente al del SGB, pues los corticoides son el tratamiento de primera línea por ser especialmente efectivos. La terapia esteroidal no produce efectos en SGB. La Ig EV y el rituximab son también útiles, aunque aún no hay consenso respecto al tratamiento con este anticuerpo monoclonal en CIDP5, 6, 10, 11.
Diagnóstico
El diagnóstico del SGB se basa en las manifestaciones clínicas, alteraciones electrofisiológicas y disociación albuminocitológica del líquido cefalorraquídeo (LCR). A partir de los criterios diagnósticos establecidos en 1978 por el National Institute of Neurological and Communicative Disorders and Stroke (NINDS)12, Asbury y Cornblath realizaron una actualización de estos criterios en 199013 y más recientemente el Brighton Collaboration los detalló mejor14 (Tabla 1). Sin embargo, estos criterios diagnósticos no abarcan las variantes del SGB. Especial importancia tiene la debilidad progresiva ascendente relativamente simétrica. La disociación albúminocitológica, pilar importante para la confirmación diagnóstica del SGB, se expresa generalmente en la segunda semana en AIDP y en la tercera semana en SMF.

El estudio neurofisiológico puede mostrar alteraciones que orientan al diagnóstico de SGB en la primera semana, (bloqueo de onda H, prolongación de onda F y latencias distales); sin embargo, las alteraciones neurofisiológicas pueden no presentarse precozmente o variar radicalmente en las semanas siguientes4-6, 10. Por eso la diferenciación entre SGB desmielinizante (velocidad de conducción nerviosa (VCN) disminuida) o axonal (potencial de acción de unidad motora (PAUM) de bajo voltaje) debe confirmarse en la tercera semana de evolución10. La resonancia magnética de columna con medio de contraste puede mostrar hiperintensidad de las raíces medulares que orientan al diagnóstico de SGB y CIDP10, 15.
Tratamiento
El SGB se trata con medidas generales de acuerdo al nivel de compromiso de cada paciente, con preservación de las funciones respiratoria y cardiovascular (que pueden alterarse por el compromiso autonómico del SGB) y manteniendo hidratación y nutrición adecuadas. De especial importancia es la prevención o control precoz de infecciones que pueden agravar el curso del SGB. El tratamiento del dolor neuropático se realiza con gabapentina y carbamazepina, también se utiliza la duloxetina. En los casos más graves, los corticoides pueden ser especialmente beneficiosos16. El tratamiento específico del SGB en niños es la administración de inmunoglobulina en dosis de 0.4 g/kg por 5 días o 1 g/kg por 48 horas (actualmente considerada más efectiva)4-6, 10. Esta terapia se recomienda en los siguientes casos: 1) Progresión rápida de la debilidad muscular. 2) Insuficiencia respiratoria o necesidad de ventilación mecánica. 3) Compromiso de pares craneales bulbares y 4) Incapacidad para deambular en forma independiente. Existe controversia respecto a si una segunda dosis de Ig puede ser efectiva en pacientes que no respondieron a la primera dosis, pero en la práctica sí se efectúa en algunos casos4, 6, 17. Al respecto, el estudio prospectivo en desarrollo del International Guillain-Barré Syndrome Outcome Study18 podrá dar luces respecto a este punto. La plasmaféresis (4-5 volemias) es igualmente efectiva que la Ig, pero como es un tratamiento más invasivo y riesgoso, se reserva solo para los casos infantiles que no responden a la inmunoglobulina. Los corticoides no son eficaces en el SGB4-6, 10, 17, 18.
Pronóstico
El pronóstico del SGB en niños es generalmente bueno. Más del 90% de los casos de AIDP y la totalidad de los casos de SMF se recuperan íntegramente. La gravedad del cuadro clínico es importante como factor pronóstico. El 40% de los niños afectados pierde la marcha y el 15% requiere ventilación mecánica en el período de máximo compromiso. Los niños con las formas más graves del SGB demoran entre 6 meses a 1 año en lograr la recuperación completa. Un 5-10% de los casos queda con secuelas sensitivas o motoras, generalmente distales de extremidades inferiores1-4, 17, 18..
La mortalidad llega al 1-5% en países desarrollados, pero puede alcanzar al 15% en países subdesarrollados como Bangladesh6.
Miastenia gravis
La miastenia gravis es un trastorno crónico de la transmisión neuromuscular que produce fatiga y debilidad fluctuante19-22. Se clasifica en dos tipos principales: congénita y adquirida. Los síndromes miasténicos congénitos tienen causa genética, por lo cual no se describirán en esta revisión. La miastenia gravis adquirida autoinmune puede presentarse en el período neonatal, constituyendo la miastenia neonatal transitoria (hijo de madre miasténica) o desarrollarse desde 1 a 18 años de vida, constituyendo la miastenia gravis juvenil (MGJ)18-21.
La MGJ de acuerdo a la presentación clínica, se divide en miastenia ocular y generalizada. Los casos de MG ocular pueden evolucionar a MG generalizada en más del 50% de los casos en un plazo de 2-3 años. Después de 1-3 años de evolución de la MGJ, el 80% de los casos corresponden a MG generalizada y el 20% a MG ocular19-22. La incidencia anual de MG en los primeros 18 años de vida oscila entre 1-4 por 100 000 habitantes19, 21.
Patogénesis
La unión neuromuscular (UNM) es una sinapsis del sistema nervioso periférico (SNP) constituida por una región presináptica formada por el terminal nervioso que contiene las vesículas de acetilcolina (AC); una sináptica, formada por el espacio sináptico donde se encuentra la acetilcolinesterasa (ACE) que inactiva (hidroliza) a la AC, y una región postsináptica, constituida por la membrana de la fibra muscular plegada, donde se encuentran los receptores de acetilcolina (RAC) que son activados por la AC para la generación de la contracción muscular. Los RAC son glicoproteínas formadas por 5 sub unidades: 2 a donde se une la AC y 3 subunidades diferentes: 2 b y 1 d (embrionaria) o e (adulta) con un canal iónico central. También existen otras proteínas que colaboran en la síntesis de RAC, como la tirosina quinasa específica del músculo (TKEM) que forma parte del receptor agrina19, 21. La unión de la TKEM con la agrina mantiene los RAC agregados en presencia de rapsina19, 21. El potencial de acción generado en el axón de la motoneurona alfa de la médula espinal permite la apertura de los canales de calcio dependientes de voltaje en el terminal sináptico, lo cual desencadena la liberación o exocitosis de AC en el espacio sináptico y su unión a los RAC que permite la apertura de los canales de sodio. Esto genera un potencial de acción post sináptico (PPS) de 40 mV, que produce la contracción muscular.
La naturaleza autoinmune de la MG se basa en varios datos entre los que destacan: 1) El 80-90% de los pacientes tienen IgG séricos anti RAC. 2) El paso transplacentario de anticuerpos anti RAC de la madre con MG produce MG neonatal transitoria. 3) La inoculación de IgG purificada de pacientes con MG en animales produce síntomas miasténicos. 4) Cambios tímicos patológicos caracterizados por expansión de los espacios perivasculares con infiltrados linfoides y células B en los centros germinales19-22.
En pacientes con MG los anticuerpos anti RAC bloquean los RAC, acelerando su degradación, lo cual impide la unión de AC, produciendo un bloqueo parcial o total de la transmisión neuromuscular a nivel post sináptico, con la consiguiente generación de la sintomatología caracterizada por fatigabilidad y/o debilidad. El timo ha sido relacionado como factor causal posible, pues el 75% de los pacientes con MG tienen alteraciones del timo, especialmente hiperplasia en el 85% de los casos. Un 15% de los pacientes de más de 20 años tiene timoma. La respuesta favorable a la timectomía en la mayoría de los casos con MG avala esta teoría19-22. Los RAC de las células mioides del timo podrían actuar como auto antígenos, desencadenando la respuesta inmune anti RAC a nivel del timo.
Clínica
La MGJ generalizada comienza generalmente con signos oculares, principalmente ptosis palpebral uni o bilateral y oftalmoparesia expresada comúnmente por diplopía. Posteriormente, en plazos variables (3 a 6 meses), aparece fatigabilidad generalizada de predominio vespertino19-22.
Cuando no existen signos oculares y lo que predomina es la afección de pares bulbares, el diagnóstico es más difícil. La evolución de la enfermedad suele ser progresiva en semanas o meses. Las crisis miasténicas, con compromiso respiratorio asociado, son más frecuentemente desencadenadas por cuadros infecciosos respiratorios virales o bacterianos19-22.
Diagnóstico
La sospecha de MGJ se basa primero en los signos clínicos del niño, especialmente ptosis palpebral y/o fatigabilidad fluctuantes. Con la prueba de edrofonio (tensilón) o administración de piridostigmina se demuestra el síndrome miasténico, al observar la reversión de la signología clínica18-21. Los estudios electrofisiológico son de gran ayuda en la MG. La estimulación repetitiva del nervio a 3 Hz puede mostrar respuesta decremental con caída del 4° y 5° potencial motor, y representa la definición electrofisiológica de síndrome miasténico. Un examen más específico, pero que requiere de la cooperación del paciente, es la electromiografía (EMG) de fibra única. Permite ver el desfase de aparición del PAUM entre dos fibras contiguas. Ese desfase se denomina jitter, y resulta aumentado en el 95% de los casos, ayudando al diagnóstico19-22. El diagnóstico de certeza de miastenia gravis autoinmune se realiza al demostrar presencia de anticuerpos anti RAC, se obtiene en el 85% de los pacientes con MG generalizada y en el 50% de los niños con MG ocular. Un porcentaje pequeño de pacientes, especialmente adultos, pueden tener anticuerpos anti MUSK o Lrp4 positivos, apoyando el diagnóstico de MG autoinmune19,22,23.
Tratamiento
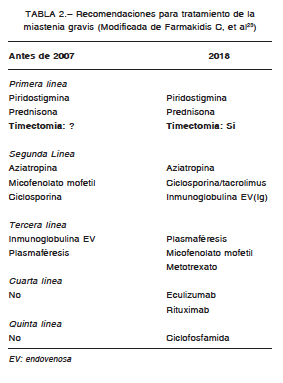
El tratamiento de la MGJ se basa en la administración de medicamentos anticolinesterásicos que permiten revertir los síntomas de fatigabilidad y debilidad muscular, al permitir que la AC actúe durante más tiempo en los RAC no bloqueados por los anticuerpos anti RAC. El medicamento de elección es la piridostigmina en dosis de 2-4 mg por kg/dosis cada 4-6 horas19-24. Los corticoides deben agregarse frecuentemente en el inicio de la terapia, en dosis de 1-2 mg por kg/día, de acuerdo a la gravedad19, 21, 22.. En casos refractarios a ambos fármacos se debe administrar inmunoglobulina 2 g/kg (dosis total) en 2 a 5 días. Posteriormente debe tratarse con inmunosupresores como la ciclosporina, azapioprina, micofenolato u otros 20-24 (Tabla 2).
La timectomía es un tratamiento unánimemente validado en los últimos dos años, a partir de nuevos estudios multicéntricos realizados en pacientes adultos21-24. En niños no hay consenso, pero varios informes confirman su efectividad en MGJ. En nuestro hospital realizamos timectomía precoz (desde la confirmación diagnóstica con resultado de anticuerpos anti receptores de acetilcolina) a los pacientes con MGJ desde el año 1998 con buenos resultados, considerando nuestra experiencia25, 26 y publicaciones extranjeras27.
Dermatomiositis
La polimiositis/dermatomiositis, definida como una microangiopatía muscular crónica autoinmune, es una enfermedad de progresión en semanas o meses que produce debilidad muscular de predominio en cintura. Si se acompaña de signos dérmicos se denomina dermatomiositis juvenil (DMJ), la forma más frecuente de presentación en el niño (85%)28, 29. El niño con dermatomiositis juvenil, además del rash típico, debe tener 3 de los siguientes 4 criterios diagnósticos: elevación de enzimas musculares
(creatinfosfoquinasa),EMG con signos de miopatía inflamatoria, biopsia muscular compatible con DMJ y debilidad muscular proximal.29 Cada vez más, la resonancia muscular es considerada como otro criterio importante para apoyar el diagnóstico de DMJ29. Las manifestaciones de la piel pueden ser, muy ocasionalmente, la única expresión de la enfermedad (dermatomiositis sine miositis)28,29.
La incidencia de DMJ es de 3.7 casos por millón al año y sube a 4.3 casos por millón al año a los 10-14 años28. Hay predominio femenino en proporción 2:1 y un predominio en personas blancas (71%)28. El retraso en el diagnóstico o instalación de terapia efectiva aumentan claramente la frecuencia de calcificaciones de tejidos blandos.
Patogénesis
La exposición previa a infecciones juega un rol en la patogénesis de DMJ. También es importante la existencia de factores genéticos facilitadores, como el factor de necrosis tumoral alfa (TNFa), que se puede exacerbar con la exposición a luz ultravioleta en los individuos susceptibles28.
Clínica y diagnóstico
Los signos clínicos fundamentales son la debilidad muscular proximal y las manifestaciones cutáneas, especialmente el edema y eritema palpebral y facial. Además, la piel de las articulaciones interfalángicas de las manos puede estar hipertrofiada y de color rojo pálido, constituyendo el signo de Gottron 28, 29.
Tratamiento
El tratamiento de elección son los corticoides en dosis de 1 mg por kg/día.
Al inicio del tratamiento es recomendable administrar primero bolos de metilprednisolona 30 mg/kg/día por 3 días seguidos o alternos28, 29. Si no hay respuesta a más largo plazo con los corticoides, se debe usar inmunosupresores. Para controlar definitivamente la enfermedad, pueden ser necesarios varios años de terapia.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Oostvogel PM, Spaendonek MA, Hirasing RA. Clinical and epidemiological features of Guillain –Barré syndrome. J Infect Dis 1997; 76: 55-62.
2. Hughes RA, Rees HT. Clinical and epidemiological features of Guillain –Barré syndrome. J Infect Dis 1997; 176(Suppl 2): S92-8.
3. Asbury AK. New concepts of Guillain –Barré. J Child Neurol 2000; 15:183-91.
4. Erazo R. Sindrome de Guillain Barré en pediatría. Medicina (B Aires) 2009; 69: 84-91.
5, Torricelli RE. Guillain-Barré syndrome in pediatrics. J Immunol Res 2016; 3: 1012.
6. Hughes RA, Cornblath DR, Willison HJ. Guillain-Barré in the 100 years since its description by Guillain, Barré and Strohl. Brain 2016; 139: 3041-7.
7. Feasby TE, Gilbert JJ, Brown WF, Bolton CF, Hahn AF, Koopman WF, et al. An acute axonal form of Guillain-Barré polyneuropathy. Brain 1986; 109:1115-26.
8. Mc Khann GM, Cornblath DR, Ho T, et al. Clinical and electrophysiological aspects of .acute paralytic disease of children and young adults in northern China. Lancet 1991; 338: 593-7.
9. Mc Khann GM, Cornblath DR, Griffin JW, et al. Acute motor axonal neuropathy: A frecuent cause of acute flaccid paralysis in China. Ann Neurol 1993; 33:333-42.
10. Korinthenberg R. Acute polyrradiculoneuritis: Guillain–Barre syndrome. Hanbook of Clinical Neurology. Dulac O, Lassonde M, Sarnat HB (es), 2013,112. Pediatric Neurology,120: 1157-62.
11. Mathey E,Park S, Hughes R et al. Chronic inflammatory demyelinating polyradiculoneoropathy: from pathology to phenotype. J Neurol Neurosurg Psychiatry 2015; 0:1-13.
12. Asbury AK, Cornblath DR. Assesment of current diagnostic criteria for Guillain-Barre syndrome. Ann Neurol 1990; 27 (Supp 1): S21-4.
13. Asbury AK, Arnason BGW, Karp HR, Mc Farlin DF. Criteria for diagnosis of Guillain-Barré syndrome. Ann Neurol 1978; 3: 565-6.
14. Sejvar JJ, Kohl KS, Gidudu J, et al. Guillain-Barré syndrome and Fisher syndrome: case definitions and guidelines for collection, analysis, and presentation of immunization safety data. Vaccine 2011; 29: 599-612.
15. Adachi Sato N Okamoto T, Sasaki M, Komaki H, Yamashita F, et al. Braquial and lumbar plexus in chronic inflammatory demyelinating polyrradiculopathy: MRI assessment including apparent difussion coefficient. Neuroradiology 2011; 53: 3-11.
16. Ropper AH, Shashani BT. Pain in Guillain-Barré syndrome. Arch Neurol 1984; 41: 511-4.
17. Willison HJ, Jacobs BC, van Doorn PA. Guillain-Barré syndrome. Lancet 2016; 388: 717-27.
18. van den Berg B, Walgaard C, Drenthen J, Fokke C, Jacobs BC, van Doorn PA. Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis. Nat Rev Neurol 2014; 10: 469-82.
19. Papazian O, Alfonso I, Araguez N. Miastenia gravis juvenil. Medicina (B Aires) 2009; 69:71-83.
20. Schmitdt N, Salinas M, Erazo R. Miastenia gravis en pediatría. Rev Chil Pediatr 2005; 76:291-8.
21. Huang X, Feng H, Chen P, Liu W. Clinical characteristics of juvenile myasthenia gravis in South China. Front Neurol 2018; 9:77.
22- Wolfe GI, Kaminski HJ, Aban IB, et al. Randomized trial of thimectomy in myasthenia gravis. N Engl J Med 2016; 375: 511-22.
23. Farmakidis C, Pasnoor M, Dimachki MM, Barohn RJ. Treatment of myastenia gravis. Neurol Clinic 2018; 36:311-37.
24. Evoli A. Myasthenia gravis: new developments in research and treatment. Curr Opin Neurol 2017; 30:464-470
25. Martin I, Erazo R. Miastenia gravis juvenil: evolución post-timectomía. Rev Chil Psiquiatr Infanc Adolesc 2008; 19:20-8.
26. Rodríguez M, Gómez MR, Howard FM, Taylor WF. Myastenia gravis in children: Long-term follow-up. Ann Neurol 1983; 13 504-10.
27. Erazo Torricelli R. Acute muscular weakness in children. Arq Neuropsiquiatr 2017; 75: 248-54.
28. Pachman LM. Juvenil dermatomyositis and other inflammatory myopathies in children. In: Darras BT, Jones HD Jr, Ryan MM, De Vivo DC (eds). Neuromuscular disorders in infancy, childhood and adolescence, 2014; p 834-81.
29. Pérez-Pérez L, Suárez-Amor O, Sánchez-Aguilar D, Ginar-te M, Pereiro M, Toribio J. Dermatomiositis clínicamente amiopática: presentación de 3 casos. Actas Dermosifiliogr 2005; 96: 295-8.
