HERNÁN JAVIER CUTULI 1, CAROLINA BARCIOCCO1, ÉRICA ROJAS BILBAO3, MARIANO BRZEZINSKI2, MARÍA NATALIA GANDUR QUIROGA1, LEONARDO PASIK2
1Departamento de Oncología Clínica, 2Departamento de Urología, 3Servicio de Anatomía Patológica, Instituto de Oncología Ángel H. Roffo, Universidad de Buenos Aires, Argentina
Resumen Los teratomas son tumores germinales malignos compuestos por dos o más capas de tejido, que ocasionalmente se transforman en estirpes con crecimiento agresivo. Se presenta el caso de un paciente de 29 años con un tumor germinal gonadal localizado en testículo, cuya evolución fue desfavorable por presentar transformación en un fenotipo correspondiente a un rabdomiosarcoma. La patología aquí descripta deviene del crecimiento diferencial de un componente ya existente en el tumor original o la transformación en un linaje somático que se hace dominante. Los tumores transformados como el del caso descripto son raros y presentan características diferentes de la mayoría de las neoplasias germinales respecto del comportamiento, el pronóstico y la sensibilidad a los tratamientos establecidos.
Palabras clave: tumor germinal, teratoma maduro, transformación maligna, rabdomiosarcoma
Abstract Transformation of teratoma in rabdomiosarcoma. Teratomas are malign germ cell tumors composed of two or more tissue layers. When there is specific organ differentiation they are called mature teratoma. They rarely grow aggressively. We report the case of a 29 year-old man with a diagnosis of gonadal germ cell tumor whose evolution was unfavorable owing to transformation into a different phenotype corresponding to a rhabdomyosarcoma. This phenomenon occurs through differential growth of a single histological component of the original tumor or transformation of a somatic lineage that becomes dominant. Transformed tumors such as the one herein described differ from most germ cell neoplasms regarding behavior, prognosis, and susceptibility to established treatments.
Key words: germ cell tumor, mature teratoma, malignant transformation, rhabdomyosarcoma
Recibido: 19-XII-2017 Aceptado: 18-IX-2018
Dirección postal: Hernán Cutuli, Departamento de Oncología Clínica, Instituto de Oncología Ángel H. Roffo, Av. San Martín 5481, 1417 Buenos Aires, Argentina
e-mail: hjcutuli10@gmail.com
Los teratomas son tumores germinales malignos compuestos por dos o más capas de tejido: ectodermo, endodermo y/o mesodermo. Aquellos que presentan diferenciación específica de órgano se llaman teratomas maduros y los que presentan características de la etapa fetal son conocidos como inmaduros1.
La transformación maligna ocurre ocasionalmente en tumores germinales. A esta entidad, la Organización Mundial de la Salud la definió como teratoma con transfor- mación maligna2, 3, la que presenta evidencia histológica de tejido somático con crecimiento diferencial respecto al resto de los componentes.
Los tumores germinales han sido reclasificado por la Organización Mundial de la Salud en dos tipos de neoplasias, unas que derivan de lesiones precursoras (malignidad in situ), y otras que se presentan en otro grupo etario (prepuberal) sin indicios de patología pre- maligna4. Esto se relaciona con diferencias biológicas que inciden luego en el comportamiento. Así es como los primeros, derivados de lesiones predecesoras pueden transformarse en malignidades somáticas. Esta transfor- mación debe ser sospechada en pacientes que presentan quimio-resistencia o progresión anatómica con descenso de marcadores serológicos, y un diagnóstico conocido de tumor germinal con componente de teratoma. Presentamos el caso de un teratoma maduro transformado en rabdomiosarcoma confirmado histológicamente.
Caso clínico
El paciente, de 29 años, presentaba aumento de tamaño indo- loro del testículo derecho de tres meses de evolución. Ingresó al Instituto Roffo luego de ser sometido a orquiectomía dere- cha, la que evidenció tumoración sólido-quística de 3 × 2.5
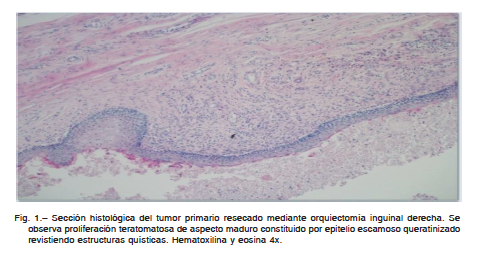
× 2.5 cm. Las secciones histológicas mostraron una mezcla heterogénea de tejidos que comprendía: epitelio respiratorio y digestivo tapizando estructuras quísticas rodeadas por tejido muscular y nervioso, pigmento melánico, glándulas salivales y cartílago rodeados de tejido fibroso. Esta descripción co- rresponde a un teratoma maduro (Fig. 1). Se presentó como estadio IIIB N3, S2 (estadificación American Joint Committee
on Cancer 2010)5 por imagen retroperitoneal de 25 cm de diámetro mayor (Fig. 2A) sumada a elevado nivel del marcador alfafetoproteína (>5000 ng/ml). Una vez confirmado este diag- nóstico mediante revisión anatomopatológica en el Instituto Roffo, se inició una primera línea de quimioterapia basada en bleomicina, etopósido y cisplatino, de la cual realizó 4 ciclos.
Ante la presencia de una lesión nueva de localización retroperitoneal según la valoración tomográfica (Fig 2A) y la persistencia de marcadores positivos (alfafetoproteína 214 UI/ ml y lactato deshidrogenasa 537 U/l), se realizó segunda línea de quimioterapia con paclitaxel, ifosfamida y cisplatino por 4 cursos, obteniéndose como resultado enfermedad estable. Debido a la persistente positividad de alfafetoproteína, con un valor de 141 UI/ml, la ausencia de respuesta anatómica en la masa residual única, y la histología con componente de tera- toma maduro en el tumor primario, se decidió la resección del tumor retroperitoneal. La anatomía patológica informó un tu- mor compatible con rabdomiosarcoma embrionario con áreas de teratoma maduro. Se interpretó como una transformación somática, y se decidió aplicar un esquema de quimioterapia con adriamicina, droga de demostrada utilidad en esta estirpe histológica. La enfermedad progresó rápidamente sin llegar a realizarse este nuevo régimen, y el paciente falleció por complicaciones relacionadas a la malignidad.
Discusión
Los tumores germinales son un ejemplo de enfermedad curable. Son erradicables en un 95% de los casos6. In- cluso en presencia de metástasis, aproximadamente el 70% de los pacientes puede curarse7.
En los fenotipos con teratoma maduro que presentan respuesta bioquímica disociada de la anatómica, debe ser considerado el diagnóstico de teratoma transformado. La diferenciación más frecuente es a rabdomiosarcoma, y siguen en frecuencia la estirpe epitelial gastrointestinal y el neuroectodermo8.
En nuestro caso se trató de un teratoma maduro sin signos de somatización maligna a nivel testicular como se observa en Fig. 1. En el contexto de una reducción de marcadores sin modificación de la masa en el retroperito- neo, se propuso realizar la cirugía llamada “de desespe- ración”, o “de salvataje”, procedimiento que consiste en resecar una lesión con marcadores tumorales positivos, asumiendo que es la única lesión residual9. En la pieza resecada se observó presencia de un componente me- senquimático con morfología e inmunofenotipo de CD56 y desmina positivo vinculables a un rabdomiosarcoma (Fig. 2B y 2C), en coexistencia con restos de teratoma maduro. Estos hallazgos fueron interpretados como una transformación mesenquimática maligna a partir de un teratoma maduro.
El sitio donde habitualmente ocurren estas transfor- maciones no es en el lugar primario sino en un territorio metastásico de una fracción diferente de tejido maligno asociada al componente de teratoma.
En esta enfermedad, el linaje germinal originario puede objetivarse por la presencia del isocromosoma 12, i (12p), presente en el 80% de los tumores de esta estirpe, lo cual permite diferenciarlo de un primario mesenquimático no derivado de un teratoma10.
La patogenia de la transformación podría derivar de la alteración genética de elementos de teratoma preexis- tentes o la diferenciación de células totipotenciales con transformación maligna concomitante11. Es infrecuente la transformación a otras estirpes histológicas en pacientes que realizan solo cirugía, sin quimioterapia ni radioterapias previas, y se informa solo un 0.3% en una serie de 712 pacientes con histología no seminoma de la Universidad de Indiana8.
Respecto al pronóstico, la literatura coincide en que la presencia de transformación de un teratoma solamente a nivel gonadal augura una evolución favorable comparada con el hallazgo de la misma en otros territorios1.
Según otras publicaciones, la presencia de enfer- medad mínima no germinal en las lesiones residuales a nivel retroperitoneal, parece ser un factor pronóstico favorable. A su vez, la carga tumoral alta predice una peor supervivencia junto con el sitio primario mediastinal y la presencia de teratoma inmaduro en la histología12.
En cuanto al tratamiento, es clave eliminar los clones quimio-sensibles a terapias convencionales para tumores germinales, los cuales se evidencian a través de la pre- sencia de marcadores positivos y una rápida evolución. Una vez hecho esto, la cirugía es el tratamiento de elec- ción para una transformación maligna de teratoma. Dado que la respuesta de los tumores resultantes es incierta y, en primera instancia, peor que la de los linajes origi- nales13, queda como alternativa la utilización de drogas dirigidas a la histología evidenciada, cuando las lesiones son irresecables o metastásicas14.
El fundamento de la presentación es generar una hipó- tesis diagnóstica adicional ante un paciente que presenta un tumor no seminomatoso con componente de teratoma y una respuesta no habitual caracterizada por disociación entre la evolución bioquímica y la anatómica. En estos casos se debe considerar la transformación en otra estirpe o el crecimiento diferencial de un componente histológico que forma parte del tumor original.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Ahmed T, Bosl GJ, Hajdu Sl. Teratoma with malignant transformation in germ cell tumors in men. Cancer 1985;
56: 860-3.
2. Mostofi, Fathollah Keshvar, Sobin, Leslie H. Histological typing of testis tumours / F. K. Mostofi, in collaboration with L. H. Sobin and pathologists in eight countries.
1977. Geneva: World Health Organization. En: http:// www.who.int/iris/handle/10665/41565; consultado sep- tiembre 2018.
3. Ulbright TM, Loehrer PJ, Roth LM, Einhorn LH, Williams SD, Clark SA. The development of non-germ cell malig- nancies within germ cell tumors. A clinicopathologic study of 11 cases. Cancer 1984; 54: 1824-33.
4. Williamson SR, Delahunt B, Magi-Galluzzi C, et al. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the Interna- tional Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70: 335-46.
5. Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol 2010; 17: 1471-4.
6. Einhorn LH. Testicular cancer as a model for a curable neoplasm: The Richard and Hinda Rosenthal Foundation Award Lecture. Cancer Res 1981; 41: 3275-80.
7. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008.
CA Cancer J Clin 2008; 58: 71-96.
8. Little JS Jr, Foster RS, Ulbright TM, Donohue JP. Unusual neoplasms detected in testicular cancer patients undergo- ing postchemotherapy retroperitoneal lymphadenectomy. World J Urol 1994; 12: 200-6.
9. Albers P, Ganz A, Hannig E, Miersch WD, Müller SC.
Salvage surgery of chemorefractory germ cell tumors with elevated tumor markers. J Urol 2000; 164: 381-4.
10. Bosl GJ, Ilson DH, Rodriguez E, Motzer RJ, Reuter VE, Chaganti RS. Clinical relevance of the i(12p) marker chromosome in germ cell tumors. J Natl Cancer Inst
1994; 86: 349-55.
11. Sumerauer D, Vicha A, Zuntova A, et al. Teratoma in an adolescent with malignant transformation into embryonal rhabdomyosarcoma: case report. J Pediatr Hematol On- col 2006; 28: 688-92.
12. Loehrer PJ Sr, Hui S, Clark S, et al. Teratoma following cisplatin-based combination chemotherapy for nonsemi-
nomatous germ cell tumors: a clinicopathological correla- tion. J Urol 1986; 135: 1183-9.
13. Kushner BH, Hajdu SI, Gulati SC, Erlandson RA, Exelby PR, Lieberman PH. Extracranial primitive neuroectoder- mal tumors. The Memorial Sloan-Kettering Cancer Center experience. Cancer 1991; 67: 1825-9.
14 Al-Hader AA, Jain A, Al-Nasrallah N, Einhorn LH. Meta- static malignant transformation of teratoma to primitive neuroectodermal tumor (PNET): results with PNET-based chemotherapy. Am J Clin Oncol 2015; 38: 364-6.
