ADRIÁN P. DÉVOLI 1, NATALIA M. VELAZQUEZ 1, PILAR PERACHINO 1,
TERESA SOLIZ GUARDIA 1, J. ALBERTO TURSI 1, JOSÉ LUIS LEONE 2
1 Servicio de Clínica Médica, 2 Departamento de Docencia e Investigación,
Sanatorio Clínica Modelo de Morón, Buenos Aires, Argentina
Resumen La arteritis de Takayasu es una vasculitis idiopática y granulomatosa crónica que se manifiesta en forma de panaortitis, de etiología desconocida, aunque se postula un origen autoinmune. Es progresiva y genera, tanto en adultos como en niños, estenosis segmentaria, oclusión, dilatación y/o aneurismas. La vasculitis aislada gastrointestinal sin afectación sistémica es rara. Este caso lleva a tener en cuenta la manifestación abdominal atípica de la arteritis de Takayasu en el diagnóstico diferencial de un síntoma frecuente, como la epigastralgia, y a destacar el rol que ocupan en la actualidad los métodos de imágenes no invasivos para su diagnóstico.
Palabras clave: vasculitis, Takayasu, arteritis células gigantes
Abstract Takayasu arteritis is an idiopathic and chronic granulomatous vasculitis manifested in the form of panaortitis, of unknown etiology, even though an autoimmune origin is postulated. It is progressive and generates, in adults and children, segmental stenosis, occlusion, dilation and / or aneurysms. Isolated gastrointestinal vasculitis without systemic involvement is rare. This case leads us to take into account the atypical abdominal manifestation of Takayasu arteritis in the differential diagnosis of a frequent symptom, such as epigastralgia, and to highlight the role currently played by non-invasive imaging methods for its diagnosis.
Key words: vasculitis, Takayasu, giant cell arteritis
Dirección postal: Adrián P. Dévoli, Sanatorio Clínica Modelo de Morón, República Oriental del Uruguay 224, 1708 Morón, Pcia. de Buenos Aires, Argentina
e-mail: trudy_devoli@yahoo.com.ar
La arteritis de Takayasu (AT) es la inflamación granulomatosa crónica de la aorta y sus ramas principales que causa estenosis, dilatación y aneurismas. Afecta principalmente mujeres de 10 a 40 años, más frecuente en Extremo Oriente y América Latina 1. El inicio de la AT sugiere mecanismos de obstrucción vascular diferentes a la aterosclerosis 2. Algunos pacientes muestran un curso de enfermedad monofásico y autolimitado, y otros desarrollan una arteritis progresiva que causa obstrucciones vasculares graves 2-8.
El diagnóstico combina el examen físico, pruebas de laboratorio e imágenes. Los criterios de Fiessinger 9 incluyen: origen en país endémico, tuberculosis o infección estreptocócica. Pero los criterios más ampliamente adoptados son los propuestos por Ishikawa (sensibilidad del 84%) y los del Colegio Americano de Reumatología (ACR). Estos se desarrollaron para distinguir AT de otras vasculitis. Cuando tres de seis criterios están presentes, tienen sensibilidad de 90.5% y especificidad de 97.8% para la clasificación correcta de AT.
Los síntomas se deben a claudicación e isquemia insidiosa o bien, si es lo suficientemente rápida, a la isquemia crítica. Sin embargo, el dolor abdominal es una manifestación poco común 2, 3. El tracto gastrointestinal se afecta en un 20% de los casos con compromiso sistemico3. No obstante, su presentación aislada es rara.
Comunicamos este caso debido a la presentación atípica, cuya manifestación inicial fue dolor abdominal,
encontrándose evidencia de vasculitis de grandes vasos en arteria hepática y tronco celíaco, compatible con AT.
Caso clínico
Un varón, de origen caucásico, de 48 años fue internado por epigastralgia de 8 horas de evolución con irradiación hacia flancos, intensidad 10/10 (EVA), vómitos y diarrea no disentérica. Negó fiebre o equivalentes, pérdida de peso, melena u otros síntomas gastrointestinales.
Como antecedentes personales es trabajador ferroviario nacido en Misiones (República Argentina) donde vivió hasta los 18 años realizando tareas ganaderas, hipertenso tratado con enalapril 20 mg/día hace 3 años, hernia discal L4-L5 intervenida quirúrgicamente hace 2 años y C6-C7 con cérvicobraquialgia bilateral, medicado con pregabalina 75 mg/día.
Al examen físico el pulso era 66 lpm, simétricos, frecuencia respiratoria 20 rpm, TA 170/100 mmHg con diferencial de 10 mmHg en miembros superiores, temperatura axilar 36 °C, peso 85 kg, talla 1.82 m, IMC 25.6. El resto de los exámenes, cardiovascular y respiratorio, fueron normales. El abdomen se encontraba blando, depresible, doloroso en epigastrio con peristalsis conservada, sin distensión y no se auscultaron soplos.
El laboratorio informó recuento celular normal, hematocrito 48%, Hb 16.2 g/100ml, glóbulos blancos 9520/mm 3, las enzimas hepáticas se hallaron duplicando su valor normal, la función renal, amilasa y perfil fosfocálcico no estaban alterados. La velocidad sedimentación globular (VSG) fue 6 y la proteína C reactiva (PCR) 15.
Las radiografías de abdomen (de pie y acostado) mostraron distribución de gas normal y la ecografía abdominal no identificó alteraciones en órganos sólidos, ni líquido libre. La angio-TC de abdomen mostró defecto de relleno, paso filiforme del contraste en tronco celíaco y tercio proximal de arteria hepática sin signos de disección o aneurisma, compatible con estenosis/trombosis y engrosamiento mural sugestivo de vasculitis (Fig. 1). Las demás arterias abdominales no tenían alteraciones. La TC de tórax solo informó como hallazgo dos imágenes compatibles con granulomas, uno en pulmón y otro hepático. La ecografía doppler de vasos subclavios no mostró signos sugestivos de lesión ni estenosis significativas.
El interrogatorio fue orientado a síndromes vasculíticos.
El paciente negó rash cutáneo, artralgias, fotosensibilidad, fenómeno de Raynaud, o dolor sobre trayectos arteriales superficiales. El examen osteoarticular y cutáneo fue normal, sin alteraciones al fondo de ojo.
Las determinaciones de ANA, ANCA, FR, anticoagulante lúpico, b2GLP1, complemento, crioglobulinas, homocisteína, mutación gen protrombina G20210A, PAI-1, factor V de Layden, proteínas C y S, antitrombina III, presentaron rango normal y las serologías virales (HVC, HVB, HIV) fueron no reactivas. Completó el estudio vascular abdominal con angioresonancia y arteriografía digital (Fig. 2).
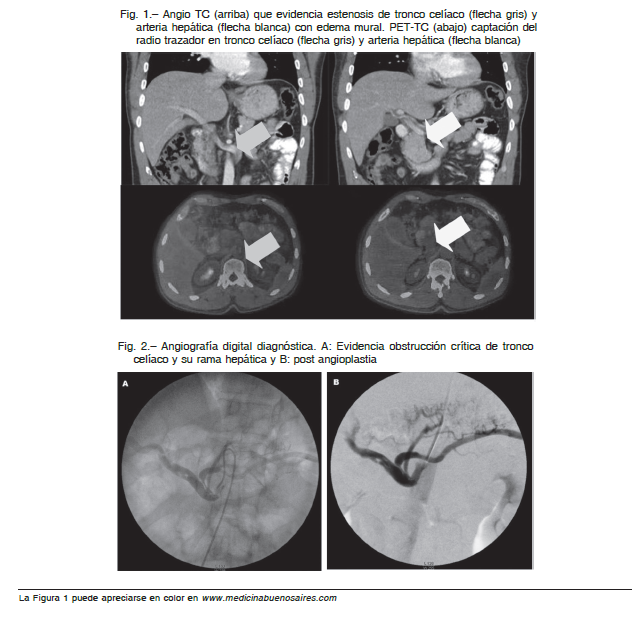
Dados los hallazgos en imágenes, se plantearon tres diagnósticos diferenciales: arteritis de grandes vasos, posible enfermedad de Takayasu (tipo IV de la clasificación angiográfica de Hata 6), poliarteritis nodosa y hemoglobinuria paroxística nocturna (HPN) por lo que se solicitó citometría de flujo para clon de HPN que incluyó CD55, CD59, CD14, CD16, todos negativos. No se identificaron poblaciones vinculables a proceso linfoproliferativo B. La población de linfocitos T CD4+: 61%, CD8+: 13%. La HPN se incluyó en los diagnósticos ya que los eventos trombóticos característicos no solo ocurren en territorios venosos, sino también arteriales7. Un PET-TC informó captación en tronco celíaco compatible con proceso vasculítico (Fig. 1).
Se decidió iniciar anticoagulación con enoxaparina y tratamiento con meprednisona 1 mg/kg/día. Al quinto día se realizó angioplastia con stent a tronco celíaco (Fig. 2) exitosa, con remisión total de la sintomatología. El paciente fue externado para seguimiento ambulatorio con evolución satisfactoria.
En consideración de los criterios propuestos por EULAR y ACR 11, nuestro paciente se diagnosticó como arteritis de Takayasu.
Discusión
Los signos y síntomas de la AT son diversos y reflejan tanto la etapa de la enfermedad como la vasculatura afectada. Inicialmente pueden ser inespecíficos, como fatiga, pérdida de peso y fiebre baja, pero a medida que avanza puede manifestarse como soplos vasculares, claudicación, retinopatía e isquemia por oclusión arterial.
La histología muestra un parche y engrosamiento fibroso transmural, lo que resulta en múltiples obstrucciones vasculares.
La estabilidad clínica o de laboratorio no siempre es sinónimo de remisión. El 50% de los pacientes en aparente remisión clínica, siguen desarrollando lesiones vasculares estenosantes, objetivables en imágenes 10. Por ello, para valorar la actividad de la enfermedad, es necesario aunar exámenes de laboratorio, imagen y síntomas clínicos que el médico deberá valorar en su conjunto.
Para el diagnóstico de AT, el Colegio Americano de Reumatología (ACR) 11 desarrolló un índice que contiene seis criterios: 1) edad de inicio < 40 años; 2) claudicación de extremidades; 3) disminución del pulso en arteria braquial; 4) presión arterial sistólica diferencial > 10 mmHg entre brazos; 5) soplo de arterias subclavias o aorta; y 6) anomalías en arteriograma. Si se cumplen tres o más de estos criterios, la sensibilidad alcanza 90.5% y la especificidad 98%. La actividad de la AT puede evaluarse con los criterios de los Institutos Nacionales de la Salud (NIH), con enfermedad activa definida como la nueva aparición o empeoramiento de dos de los siguientes criterios: 1) síntomas sistémicos, fiebre y malestar general, sin otra causa; 2) VSG) elevada; 3) síntomas de isquemia vascular o inflamación (claudicación, pulsos disminuidos o ausentes, soplos, dolor vascular, presión arterial asimétrica); y 4) daño objetivado angiográficamente.
El marcador inflamatorio VSG para distinguir enfermedad activa de inactiva, presenta solo 72% de sensibilidad. Además, tanto la VSG como la PCR pueden variar por factores distintos a la remisión de la enfermedad. La VSG puede ser influenciada por factores externos como medicamentos y viscosidad sanguínea y la PCR tener elevación inespecífica en respuesta a inflamación de tejidos e infección. Adicionalmente, la PCR se produce en el hígado en respuesta a la citocina IL-6, y no en el sitio de inflamación, lo que explica su baja sensibilidad.
Como resultado, confiar en estos marcadores puede conducir a la falsa suposición de que existe una remisión, mientras hay fibrosis activa en curso y oclusión progresiva.
Aunque las intervenciones vasculares iniciales son generalmente exitosas, la permeabilidad a largo plazo de los vasos es pobre. Un método es la angioplastia transluminal percutánea con balón, otra opción es implantar un stent. Sin embargo, la superioridad de la angioplastia con balón sola o con stent no ha sido dilucidada 12.
El tratamiento con glucocorticoides es efectivo en la mayoría de los casos, iniciando 1mg/kg/día el primer mes y luego pauta descendente, con control estricto de evidencia de actividad. Si hay compromiso vital, se indican pulsos de metilprednisolona 1g/día durante tres días consecutivos. En casos refractarios o no respondedores, pueden utilizarse inmunosupresores como ciclofosfamida en combinación con glucocorticoides 13.
En la etapa activa, el tratamiento médico con esteroides o inmunosupresores, antes de considerar la revascularización, mejora la inflamación. Por el contrario, la revascularización durante la fase activa podría aumentar el riesgo de complicaciones relacionadas al procedimiento, incluyendo reestenosis y disección. La angioplastia se considera una alternativa costo-efectiva, menos invasiva, y un método seguro para resolver la estenosis (81%-100% de efectividad) y baja morbimortalidad 12.
Los métodos de imágenes no invasivos cobran relevancia y son importantes en el diagnóstico, incluso en período presintomático, y en casos con alta sospecha clínica, que avala el inicio del tratamiento. Además, son costo efectivos y ampliamente disponibles en la mayoría de los centros 14.
En nuestro caso, se estableció el diagnostico de AT en base a los criterios diagnósticos y de actividad según el ACR 11 y NIH 15, y se inició tratamiento con corticoideoterapia y posterior resolución invasiva con angioplastia con stent. Ante la franca mejoría sintomática inicial se desestimó la necesidad de inmunosupresión severa.
La EULAR (Liga Europea contra el Reumatismo) estableció recomendaciones sobre el uso de modalidades de imágenes (ultrasonido, resonancia, TC y PET-TC) al hacer un diagnóstico clínico de arteritis de grandes vasos y cuándo utilizarlas para controlar la actividad y el daño de la enfermedad, disminuyendo el tiempo de latencia para arribar al diagnóstico, que en algunos casos puede ser de varios meses 13.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Soto ME, Espinola N, Flores-Suárez LF, Reyes PA. Takayasu arteritis: clinical features in 110 Mexican Mestizo patients and cardiovascular impact on survival and prognosis. Clin Exp Rheumatol 2008; 26: S9-S15.
2. Yang S, Dong K, Zheng S. Abdominal pain as the presenting symptom of Takayasu arteritis in an adolescent male. A case report. Medicine (Baltimore) 2018; 97: 26 (e11326).
3. Mali P, Muduganti SR, Goldberg J. Rare case of vasculitis of the hepatic artery. Clini Med Res 2015; 13: 169-72.
4. Kasiañuk ML, Medina S, Arias Calafiore F, Córdoba Lanus M, Ahualli J, Luciardi H. Arteritis de Takayasu en varón caucásico. Medicina (B Aires) 2016; 76: 252.
5. Cosacov R, Spadaro E, Villareal G. Accidente cerebrovascular como manifestación inicial de arteritis de Takayasu y revisión de casos en Argentina. Neurol Arg 2011; 3: 237-9.
6. Hata A, Nada M, Moriwaki R, Numano F. Angiographic findings of Takayasu arteritis: new classification. Int J Cardiol 1996; 54 (Suppl.): S155-63.
7. Ziakas PD, Poulou LS, Tokas GI, Bartzoudis D, Voulgarelis M. Thrombosis in paroxysmal nocturnal hemoglobinuria: sites, risks, outcome. An overview. J Thromb Haemost 2007; 5: 642-5.
8. Tombetti E, Mason JC. Takayasu arteritis: advanced understanding is leading to new horizons. Rheumatology (Oxford) 2019; 58: 206-19.
9. Fiessinger JN, Tawfik-Taher S, Capron L, et al. Takayasu’s disease. Diagnostic criteria. Nouv Presse Med 1982; 11: 583-6.
10. Duftner C, Dejaco C, Sepriano A, Falzon L, Schmidt WA, Ramiro S. Imaging in diagnosis, outcome prediction and monitoring of large vessel vasculitis: a systematic literature review and meta-analysis informing the EULAR recommendations. RMD Open 2018; 4 (e000612).
11. Kim E, Beckman J. Takayasu arteritis: challenges in diagnosis and management. Heart 2018; 104: 558-65.
12. Jung JH, Lee YH, Song GG, Jeong HS, Kim JH, Choi SJ. Endovascular versus open surgical intervention in patients with Takayasu’s arteritis: A meta-analysis. Eur J Vasc Endovasc Surg 2018; 55: 888-99.
13. Prieto-González S, García-Martínez A, Tavera-Bahillo I, et al. Effect of glucocorticoid treatment on computed tomography angiography detected large-vessel inflammation in giant-cell arteritis. A prospective, longitudinal study. Medicine (Baltimore) 2015; 94: 5 (e486).
14. Dejaco C, Ramiro S, Duftner C, et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis 2018; 77: 636-43.
15. Aydin SZ, Yilmaz N, Akar S, et al. Assessment of disease activity and progression in Takayasu’s arteritis with Disease Extent Index-Takayasu. Rheumatology (Oxford) 2010; 49:1889-93.
– – – –
Reúnese ésta [la junta*], nómbrase un orador, una especie de miembro informante, que expone y defiende, contra uno, contra dos, o contra más, ciertas y determinadas posiciones. El que quiere lo ayuda.
El miembro informante suele ser el cacique. El discurso se lleva estudiado, el tono y las formas son semejantes al tono y las formas de la conversación en parlamento, con la diferencia de que en la junta se admiten las interrupciones, los silbidos, los gritos, las burlas de todo género. Hay juntas muy ruidosas pero todas, excepto algunas que terminaron a capazos, tienen el mismo desenlace. Después de mucho hablar, triunfa la mayoría aunque no tenga razón. Y aquí es de hacer notar que el resultado de la junta se sabe siempre de antemano, porque el cacique principal tiene buen cuidado en catequizar con tiempo a los indios y capitanejos más influyentes de la tribu.
Lucio V. Mansilla (1831-1913)
Una excursión a los indios ranqueles (1870). Buenos Aires; Eudeba, 1966. Vol. I, p 177
*La junta, dice Mansilla: “Es un acto muy grave y muy solemne. Es una cosa muy parecida a un parlamento de un pueblo libre, a nuestro congreso, por ejemplo”.
