FRANCISCO R SPIVACOW, MARTÍN PAILLER, PABLO MARTÍNEZ
Instituto de Investigaciones Metabólicas (IDIM), Universidad del Salvador (USAL), Buenos Aires, Argentina
Resumen La hipercalciuria idiopática se define como la excreción de calcio superior a 220 y 300 mg/día en mujeres y hombres respectivamente o bien mayor a 4 mg/kg peso. En mujeres con osteoporosis se observa en el 19% de los casos, mientras que en litiasis renal varía entre el 50 y 70%. Seleccionamos 206 pacientes hipercalciúricos, de nuestra base de datos, con y sin litiasis renal, a los que se les había indicado una dieta restringida. Luego los dividimos, de acuerdo a la respuesta, en dieta dependiente y dieta independiente. De estos solo consideramos 122 pacientes con diagnósticos de hipercalciuria dieta-dependiente (105 mujeres y 17 hombres), que fueron seguidos con control dietario (800 mg de calcio, alrededor de 1 g de proteínas animales y < 100 mEq de sodio diarios). No se consideró la aparición de cálculos, o la recurrencia de los mismos, como tampoco el compromiso óseo. Luego de una media de 17 meses todos tenían controlada la calciuria e incluso hubo 16 (13%) que luego de 42 meses de seguimiento persistían normocalciúricos solo con dieta. Concluimos que es fundamental la división de las hipercalciurias, según su respuesta a una dieta restringida, con el fin de evitar o postergar el uso de diuréticos y sus efectos adversos, con una administración adecuada de la dieta.
Palabras clave: hipercalciuria idiopática, uso de diuréticos, dieta
Abstract Idiopathic hypercalciuria is defined as calcium excretion greater than 220 and 300 mg / day in women and men respectively, or greater than 4 mg / kg body weight. In women with osteoporosis it is observed in 19% of cases, while in kidney stones cases varies between 50 and 70%. We selected 206 hypercalciuric patients from our database, with and without renal lithiasis, to whom a restricted diet had been indicated. We divided them, according to the response, into a dependent diet and an independent diet. We considered 122 patients with diagnosis of hypercalciuria diet dependent (105 women and 17 men), which were followed with dietary control (800 mg of calcium, around 1 g of animal proteins and < 100 mEq sodium a day). The appearance of stones, or the recurrence of stones, was not considered, nor was bone involvement. After an average of 17 months, everyone had their calciuria controlled and there were even 16 (13%) who, after 42 months of follow-up, continued to be normocalciuric only on a diet. We conclude that the division of the hypercalciurias is fundamental, according to their response to a restricted diet, in order to avoid or postpone the use of diuretics and its adverse effects, with an adequate management of the diet.
Key words: idiopathic hypercalciuria, use of diuretics, diet
Dirección postal: Dr. Francisco R. Spivacow, Instituto de Investigaciones Metabólicas, Libertad 836 1° piso, 1012 Buenos Aires, Argentina
e-mail: spiva@idim.com.ar
La hipercalciuria idiopática (HI) es la excreción de calcio en orina que excede la observada en la mayoría de los individuos sanos que consumen una dieta habitual. En la práctica es usualmente definida como la excreción de calcio superior a 250 y 300 mg/día en mujeres y hombres respectivamente o bien mayor a 4 mg/kg peso 1. Nuestro grupo considera hipercalciuria, en mujeres, una excreción mayor a 220 mg/día (media + 2 DS) 2. Dos son las complicaciones conocidas de la HI; una es la formación de cálculos renales 3 y la otra es la disminución de la masa ósea en individuos con o sin litiasis renal, aumentando el riesgo de osteopenia, osteoporosis y fracturas 4, 5. En población general la prevalencia de HI oscila entre 5 y 10% 6; en mujeres con osteoporosis postmenopáusicas Giannini y col. 7 informaron un 19%; mientras que en pacientes con litiasis renal la HI se presenta entre el 50% y 70% de los casos 2,8. La homeostasis del calcio refleja el equilibrio entre la absorción intestinal, la excreción renal y el intercambio de “entrada y salida de calcio” del hueso.
Existen varias clasificaciones de HI, la primera que luego fue corregida, es la sugerida por Pak y col. 13, 14, quienes dividen las hipercalciurias en: 1. absortiva, 2. renal y 3. resortiva, característica del hiperparatiroidismo primario. Por otro lado, Bataille y col. 15 las clasifica en HI verdadera, independiente de factores nutricionales, e HI dependiente de la dieta, ligada a la excesiva ingesta de sodio, proteínas y/o calcio dietario.
El objetivo de nuestro trabajo es seleccionar las hipercalciurias dieta dependientes y determinar cuántas pueden ser seguidas solo con dieta, evitando el uso de diuréticos.
Materiales y métodos
Entre los años 2010 y 2015, se seleccionaron, de nuestra base de estudio, 206 pacientes con hipercalciuria idiopática, que concurrieron a nuestra unidad metabólica para evaluación de su litiasis renal o su estado óseo. El diagnóstico de HI fue confirmado en 2 muestras de orina de 24 h siguiendo la dieta y el consumo de líquidos habituales. Los pacientes con litiasis renal fueron confirmados por radiografía del árbol urinario, ecografía renal o tomografía computarizada, o bien por eliminación espontánea o procedimientos urológicos de extracción. Aquellos con clearance de creatinina menor a 60 ml/min, (corregidos por 1.73 m2 de superficie corporal), fueron excluidos, así como aquellos con inmovilización prolongada, o recibiendo drogas que afecten el metabolismo óseo, como corticoides, diuréticos y anticonvulsivantes. Hipercalciuria idiopática fue definida como la excreción de calcio > 220 y 300 mg/24 h (5.5 y 7.5 mmol/24 h) en mujeres y hombres respectivamente, o más de 4 mg/kg de peso para ambos sexos. Una vez confirmado el diagnóstico de HI, los pacientes con litiasis renal o sin ella, siguieron durante 4 días una dieta restringida en calcio (200-400 mg/día), en proteínas animales (< 1g/kg/d) y en sodio (< 100 mEq/d). Al cuarto día (bajo esta dieta) se recolectó orina de 24 h y se extrajo una muestra de sangre. También se corrigió, de ser necesario, el déficit de vitamina D con dosis semanales de ergo o colecalciferol.
Las determinaciones bioquímicas que se midieron, en sangre y orina, fueron realizadas siguiendo las siguientes técnicas: creatinina sérica (VN: 0.6-1.2 mg/dl), reacción de Jaffé, el calcio sérico fue medido con electrodo ión especifico, (ISE), con un analizador automatizado Synchron 6, CX3 (Beckman, Beckman Instruments, Inc. Brea, California, USA), (VN: 8.8-10.5 mg/dl). El mismo método fue utilizado para el calcio urinario usando alícuotas acidificadas, (VN: 220 y 300 mg/24 h mujeres y hombres respectivamente), calcio iónico (VN: 4.5-5.2 mg%), método ISE con no corrección de pH, (AVL diagnóstico, Roche), fósforo (UV) fue medido usando un ana – lizador automatizado Spectrum CCX (Abbot Labs, USA), (VN: 2.7-4.5 mg/dl. El sodio sérico (VN: 136-145 mEq/l), potasio sérico (VN: 3.9-4.5 mEq/L). La parathormona intacta sérica (PTHi) fue medida por IRMA, (VN: 10-65 pg/ml), 25- hidroxivitamina D (VN: mayor a 30 ng/dl, RIA), la fosfatasa alcalina total y su isoenzima ósea (método kinético (VN: 90-280 UI/l y 20-48% respectivamente). Osteocalcina (BGP), electro- quimioluminiscencia, (VN: mujeres: 11-43 ng/ml; hombres 14-42 ng/ml), β crosslaps sérico (CTX), electro-quimioluminiscencia (VN: mujeres: 556 ± 226 pg/ml; hombres 304 ± 200 pg/ml).
Luego de la prueba de 4 días con restricción de lácteos, proteínas animales y sal, se clasificaron los casos en: hipercalciuria dieta-dependiente cuando la calciuria fue menor a 200 mg/24 h o < 3 mg/kg/peso, e hipercalciuria dieta-independiente cuando fue mayor a los valores mencionados. Para los objetivos del trabajo solo se consideraron 122 pacientes (105 mujeres y 17 hombres) que corrigieron la calciuria luego de la dieta restringida de 4 días (hipercalciuria dieta-dependiente).
No fueron objetivos de este trabajo, dada la extensión del tema, la respuesta a las tiazidas (droga utilizada en las HI dieta independiente), la aparición de cálculos renales (en individuos no litiásicos) o la recurrencia de los mismos, ni la evaluación del contenido mineral óseo. Todos estos aspectos serán tema de otro trabajo. Del total de pacientes, 122 considerados como hipercalciuria dieta-dependiente, fueron seguidos en forma prospectiva, siguiendo una dieta de 800 mg de calcio por día, menos de 1 g de proteínas animales/d y 100-140 mEq de sodio. Aquellos que no pudieron controlar la hipercalciuria con la dieta, fueron medicados con diferentes diuréticos (indapamia, hidroclorotiazida o clortalidona, en dosis variables).
Todos los procedimientos de estudio fueron aprobados por nuestra junta de revisión institucional (CODEI) y cada paciente del estudio firmó un consentimiento informado para permitir el análisis de sus datos.
Los resultados se expresaron como media ± 1 DS. El análisis estadístico para variables continuas fue realizado utilizando el test de Student y la prueba de suma de rangos de Wilkinson para aquellas variables que no se distribuyeron normalmente. Las variables categóricas fueron analizadas con el test proporcional de dos muestras o el test exacto de Fisher. La significancia estadística se consideró a una p < 0.05. Los análisis estadísticos se realizaron con el programa Statistic 7.0.
Resultados
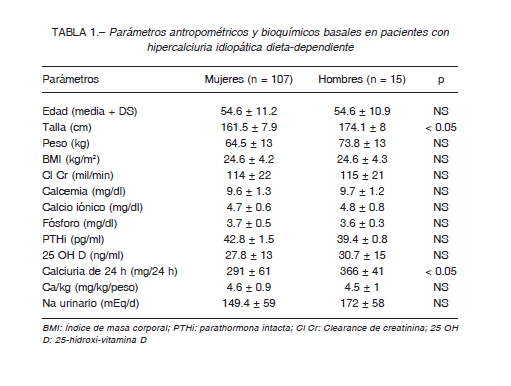
En la Tabla 1 se muestran las características antropométricas y bioquímicas basales de los 122 pacientes con hipercalciuria dieta-dependiente. Existe un claro predominio de mujeres, relación 7.1:1, que tiene que ver con las características de nuestro centro, orientado al estudio de la mujer. Entre las 107 mujeres, 59 consultaron para evaluación ósea y 48 por litiasis renal, mientras que los 15 varones del estudio consultaron todos por litiasis renal. La presencia de osteoporosis fue observada en 56 mujeres (edad: 61 ± 4 años) y 3 varones (edad: 62.7 ± 3 años), osteopenia en 9 mujeres (edad: 55 ± 6 años) y ningún varón, y hueso normal en 24 mujeres (edad: 45 ± 5 años) y el resto de los varones (edad: 45 ± 2 años).
Es de destacar que entre los que presentaron hueso normal y osteoporosis, hubo diferencias significativas en las edades; mujeres (43.8 ± 2.3 vs. 61± 4 años, p < 0.01) y en los hombres con hueso normal (40.6 ± 4 años vs. 62.7 ± 3 años, p < 0.05).
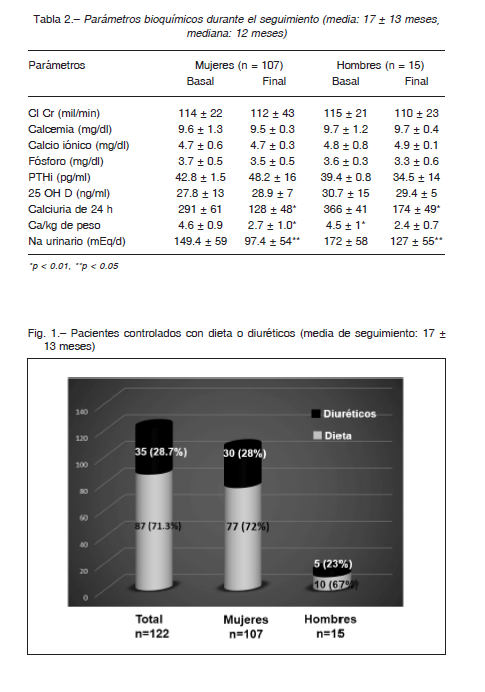
En la Tabla 2 se presentan los diferentes parámetros bioquímicos durante el seguimiento. Como se observa, hubo una caída significativa en la calciuria de 24 h y en la relación Ca/kg/peso, sin variantes significativas en el sodio urinario ni en el resto de los parámetros plasmáticos. En el total de la población analizada (n=122), durante 17 ± 13 meses (mediana: 12 meses), se mantuvo una calciuria en valores normales, luego de lo cual hubo pacientes que requirieron el uso de diuréticos y otros no (Fig. 1). Una amplia mayoría de los pacientes con hipercalciuria dietadependiente fueron controlados con dieta sin necesidad del uso de diuréticos. Incluso 16 (13%) se mantuvieron controlados, solo con dieta, durante una media de 42.5 ± 14 meses. El uso temprano de diuréticos se inició en los primeros 4 meses, al no poder controlar la calciuria y tan alejado como a los 54 meses. Es de destacar que los que solo se mantienen con dieta están todavía en seguimiento bioquímico.
Discusión
La fisiopatología de la HI es altamente compleja. Ha sido atribuida a numerosos factores que afectan el metabolismo fosfo-cálcico 16. Presenta un rasgo poligénico y multifactorial en su etiología. En el pasado, varios genes fueron identificados y asociados con la HI 17, 18. Se coincide que en la HI están involucrados tres mecanismos: por un lado un aumento en la absorción intestinal de calcio 19, en ocasiones vinculado a un elevado nivel de 1,25 (OH)2 D 20, 21 o con valores normales de calcitriol, como sucede en dos tercios de los pacientes con hipercalciuria absortiva 19, 22, un aumento en la salida de calcio del hueso1, 23 y finalmente una alteración en la reabsorción tubular con o sin aumento compensatorio de PTH 22,24. Para muchos investigadores, los tres mecanismos juegan un rol importante, con predominio, en ocasiones de alguno de ellos. El tratamiento de la HI se basa en principio en conseguir un volumen urinario de 2 a 2 ½ litros por día, reducir el aporte de sal y el exceso de proteínas animales evaluando la respuesta. En caso de no lograrse el control necesario, se indica el uso de diuréticos tiazídicos o análogos 25, 26 con el objetivo de controlar la excreción de calcio, reduciendo en más del 50% el riesgo de litiasis renal en estudios controlados durante 3 años vs. placebo 27, 28 y evitando la pérdida de masa ósea 27, 28.
Los diuréticos tiazídicos que inhiben el co-transportador sodio-cloro (NCC) en el túbulo contorneado distal (TCD), son considerados el tratamiento de elección de la HI debido a su efecto hipocalciúrico. La reducción de la calciuria ha sido atribuida a una mayor reabsorción de calcio en el TCD y a una depleción de sodio, pudiendo este último efecto ser anulado por el consumo excesivo de sal 29. Hye Ryoun y col. han sugerido que el TRPV5 (Transient receptor potential vanilloid member 5) es un determinante crítico del efecto hipocalciúrico en el tratamiento crónico con hidroclorotiazida 30. De seis estudios aleatorizados con uso de tiazidas, en cuatro de ellos con 408 pacientes, seguidos durante 26-36 meses, se observó una significativa reducción en la recurrencia de litiasis renal utilizando hidroclorotiazida y/o indapamida 31.
Si bien coincidimos que los diuréticos tiazídicos son esenciales en el control de la HI, previniendo sus dos principales complicaciones (formación de cálculos renales y/o pérdida de masa ósea), la clasificación en hipercalciuria dieta dependiente o no, permite a un grupo de pacientes, controlar la hipercalciuria, solo con dieta y líquidos, sin necesidad de recurrir inicialmente a diuréticos tiazídicos, evitando los efectos adversos que estos pueden provocar 32, 33. De hecho, nuestros datos muestran como la mayoría de los pacientes mantuvieron valores de normocalciuria hasta una media de seguimiento de 17 meses, con un 13% que luego de más de tres años y medio siguen en control solo con dieta.
En conclusión, sugerimos que todos los pacientes con HI sean clasificados según su respuesta a una dieta restringida, en respondedores o no, permitiendo a un número importante de ellos ser tratados solo con dieta, sin necesidad de tratamientos farmacológicos, aun con seguimiento a largo plazo.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Worcester EM, Coe FL. New insights into the pathogenesis of ddiopathic hypercalciuria. Semin Nephrol 2008; 28; 120-32.
2. del Valle EE, Spivacow FR, Zanchetta JR. Alteraciones metabólicas en 2612 pacientes con litiasis renal. Medicina (B Aires) 1999; 59: 417- 22.
3. Coe FL, Evan A, Worcester E. Kidney stone disease. J Clin Invest 2005; 115: 2598-608.
4. Lauderdale DS, Thisted RA, Wen M, Favus MJ. Bone mineral density and fracture among prevalent kidney
stone cases in the Third National Health and Nutrition Examination Survey. J Bone Miner Res 200; 16:1893-8.
5. Melton LJ 3rd, Crowson CS, Khosla S, Wilson DM, O’Fallon WM. Fracture risk among patients with urolithiasis: a population-based cohort study. Kidney Int 1998; 53: 459-64.
6. Vezzoli G, Soldati L, Gambaro G. Hypercalciuria revisited: one or many conditions? Pediatr Nephrol 2008; 23:503-6.
7. Giannini S, Nobile M, Dalle Carbonare L, et al. Hypercal – ciuria is a common and important finding in postmenopausal women with osteoporosis. Eur J Endocrinol 2003; 149: 209-13.
8. Coe FL, Parks JH, Asplin JR. The pathogenesis and treatment and kidney stone. Medical progress. New Engl J Med 1992; 327: 1141-52.
9. Manz F, Kehrt R, Lausen B, Merkel A. Urinary calcium excretion in healthy children and adolescents. Pediatr Nephrol 1999; 13: 894-9.
10. Hodgkinson A, Pyrah LN. The urinary excretion of calcium and inorganic phosphate in 344 patients with calcium stone of renal origin. Br J Surg 1958; 46:10-8.
11. Worcester EM, Coe FL. Evidence for altered renal tubule function in idiopathic calcium stone formers. Urol Res 2010; 38: 263-9.
12. Coe FL, Parks JH. Nephrolithiasis: Pathogenesis and treatment, 2nd ed. Chicago: Year Book Medical Publishers, 1998, pp 109-10.
13. Pak CY, Kaplan R, Bone H, Townsend J, Waters O. A simple test for the diagnosis of absorptive, resorptive and renal hypercalciurias. N Engl J Med 1975; 292: 497-00.
14. Pak CYC. Medical Stone Management: 35 Years of Advances J Urology 2008; 180: 813-9.
15. Bataille P, Fardellone P, Ghazali A, et al. Pathophysiology and treatment of idiopathic hypercalciuria. Curr Opin Rheumatol 1998; 10: 373-88.
16. Escribano J, Balaguer A, Pagone F, Feliu A, Roqué I Figuls M. Pharmacological interventions for preventing complications in idiopathic hypercalciuria . Cochrane Database Syst Rev 2009; CD004754.
17. Moe OW, Bonny O. Genetic hypercalciuria. J Am Soc Nephrol 2005; 16: 729-45.
18. Hebert SC, Brown EM, Harris HW. Role of the Ca2+- sensing receptor in divalent mineral ion homeostasis. J Exp Biol 1997; 200: 295-302.
19. Pak CYC, Oata M, Lawrence EC, Snyder W. The hypercalciuria. Causes, parathyroid functions, and diagnostic criteria. J Clin Invest 1974; 54: 387–400.
20. Insogna KL, Broadus AE, Dreyer BE, Ellison AF, Gertner JM. Elevated production rate of 1,25-Hydroxyvitamin D in patients with absorptive hypercalciuria. J Clin Endocrinol Metab 1985; 61: 490-5.
21. Shen FH, Baylink DJ, Nielsen RL, Sherrard DJ, Ivey JL, Haussler MR. Increased serum 1,25-Hydroxyvitamin D in idiopathic hypercalciuria. J Lab Clin Med 1977; 90: 955-62.
22. Zerwekh JE, Pak CY: Selective effects of thiazide therapy on serum 1 alpha, 25-D-Hydroxyvitamin D and intestinal calcium absorption in renal and absorptive hypercalciurias. Metabolism 1980; 29: 13-7.
23. Sakhaee K, Maalouf NM, Sinnott B: Clinical review. Kidney stones 2012: pathogenesis, diagnosis, and management. J Clin Endocrinol Metab 2012; 97: 1847-60.
24. Peacock M, Nordin BEC. Tubular reabsorption of calcium in normal and hypercalciuric subjects. J Clin Pathol 1968; 21: 353-8.
25. Moe OW, Pearle MS, Sakhaee K: Pharmacotherapy of urolithiasis: evidence from clinical trials. Kidney Int 2011; 79: 385-92.
26. Borghi L, Meschi T, Guerra A, Novarini A. Randomized prospective study of a nonthiazide diuretic, indapamide, in preventing calcium stone recurrences. J Cardiovasc Pharmacol 1993; 22 Suppl 6: S78-86.
27. Lemann J, Jr. Pathogenesis of idiopathic hypercalciuria and nephrolithiasis. In Coe FL, Favus MJ, editor: Disorders of bone metabolism, New York: Raven Press, 1992, pp 685-706.
28. Zanchetta JR, Rodriguez G, Negri AL, del Valle E, Spivacow FR. Bone mineral density in patients with hypercalciuric nephrolithiasis. Nephron 1996; 73: 557-60.
29. Costanzo LS. Weiner IM. On the hypocalciuric action of chlorothiazide. J Clin Invest 1974; 54: 628-30.
30. Jang HR, Kim S, Heo NJ, et al. Effects of thiazide on the expression of TRPV5, calbindin-D28K, and sodium transporters in hypercalciuric rats. J Korean Med Sci 2009; 24 Suppl: S161-9.
31. Skorecki K, Chertow GM, Marsden PA, Taal MW, Alan SL, Yu MD. Urolithiasis, in Brenner & Rector’s the kidney. Philadelphia, PA: Elsevier Press, 2016, pp 1322-67.
32. Spivacow FR, Negri AL, del Valle EE. Efecto a largo plazo de las tiazidas en la masa ósea de mujeres con nefrolitiasis por hipercalciuria. Rev Nefrol Dial Transpl 2013; 33: 180-7.
33. Ellison DH, Loffing J. Thiazide effects and side effects: insights from molecular genetics. Hypertension 2009; 54: 196-202.
