JAVIER FARINA 1*, **, ÁNGEL M. COLQUE 2**, MARCELO DEL CASTILLO 3**, ALBERTO CREMONA 1*, WANDA CORNISTEIN 4*, **, MARÍA INÉS STANELONI 5**
1 Hospital Italiano de la Plata, 2 Complejo Médico Churruca Visca, 3 Instituto FLENI, 4 Hospital Austral, 5 Hospital Italiano de Buenos Aires, Argentina
* Sociedad Argentina de Terapia Intensiva (SATI)
** Sociedad Argentina de Infectología (SADI)
Resumen Las infecciones asociadas a procedimientos neuroquirúrgicos son complicaciones graves que contribuyen a la morbimortalidad de los pacientes neurocríticos, así como también a la prolongación de la estancia en la UTI y/o en el hospital. El diagnóstico es complejo ya que no se dispone de gold standard y se apoya en la sospecha clínica, las alteraciones físico-químicas del líquido cefalorraquídeo y el aislamiento microbiano. El tratamiento debe ser precoz y guiado por la epidemiología local. La duración dependerá del microorganismo causal, su sensibilidad y la disponibilidad de tratamientos antibióticos efectivos en el sitio de la infección. La implementación de medidas de prevención con evidencia demostrada minimiza el riesgo de infección. Esta puesta al día intersociedades SADI-SATI presenta datos epidemiológicos (internacionales y locales), métodos diagnósticos, tratamiento, y pautas de prevención, considerando las publicaciones más relevantes de los últimos años sobre el tema.
Palabras clave: meningitis, ventriculitis, procedimientos neuroquirúrgicos, infección hospitalaria
Abstract Infections associated with neurosurgical procedures are serious complications that contribute to the morbidity and mortality of neurocritical patients, as well as to the prolongation of the stay in the ICU and the hospital. The diagnosis is complex since there is no gold standard, so it is based on clinical suspicion, CSF physical-chemical examination, and microbial isolation. Treatment should be initiated early, guided by local epidemiology. The duration will depend on the causative microorganism, its sensitivity and the availability of antibiotic treatments that are effective at the site of infection. The implementation of preventive measures with proven efficacy minimizes the risk of infection. This SADI-SATI intersociety update reviews relevant data recently published on this area at the national at international level regarding epidemiology, diagnostic methodologies, therapeutic approaches, and prevention guidelines.
Key words: meningitis, ventriculitis, neurosurgical procedures, hospital infection
Dirección postal: Javier Farina, Hospital Italiano de La Plata, Calle 51 N° 1725, 1900 La Plata, Provincia de Buenos Aires, Argentina
e-mail: dr.javierfarina@gmail.com
Este documento es el resultado del trabajo realizado por los miembros del Comité de Infecciones asociadas al Cuidado de la Salud y Seguridad del Paciente (IACSSP) de la Sociedad Argentina de Infectología (SADI) y el Comité de Infectología Crítica (CIC) de la Sociedad Argentina de Terapia Intensiva (SATI) sobre el diagnóstico, el tratamiento y la prevención de las infecciones en Unidades de Terapia Intensiva (UTI).
Se realizó una búsqueda sistemática en Medline, Pubmed, Embase, Lilacs, Ovid, y Cochrane. Se utilizaron palabras clave, términos MESH, en idioma español-inglés en el período de búsqueda 2006-2019 en población de adultos y también se incluyó bibliografía relevante de años anteriores. Los tipos de estudios fueron guías, revisiones sistemáticas, ensayos clínicos aleatorizados y estudios observacionales. Se estableció como bibliografía principal las guías internacionales actuales más reconocidas, y se las adaptó a nuestro escenario acorde a las características y la epidemiología de nuestras unidades críticas.
El objetivo principal de este documento es establecer recomendaciones basadas en bibliografía y opinión de expertos locales sobre el diagnóstico, tratamiento y prevención de las infecciones post-neuroquirúrgicas.
Epidemiología
Las infecciones post-neuroquirúrgicas, según las últimas definiciones del CDC (Centers for Disease Control and Prevention, de EE.UU.), son aquellas que se desarrollan hasta los 90 días posteriores a la intervención, y es en ese período que corresponde hacer la vigilancia epidemiológica de las mismas 1. Incluyen meningitis (MN) y ventriculitis post-neuroquirúrgicas, tanto las asociadas a craneotomías como las originadas post-colocación de derivaciones ventriculares. Por su parte, el programa de vigilancia de infecciones hospitalarias de Argentina (VIHDA) las considera hasta un año post-procedimiento 2.
La ausencia de gold standard para el diagnóstico de MN o ventriculitis post-neuroquirúrgica hace que las tasas de incidencia informadas sean difíciles de interpretar y homologar 3.
En un estudio prospectivo de 18 meses realizado en Francia se evaluó la incidencia y los factores de riesgo de infecciones asociadas al sitio quirúrgico en neurocirugía.
Se diagnosticaron 35 infecciones del sitio quirúrgico entre los 844 pacientes estudiados (incidencia 4.1%) 4. En la MN post-craneotomía la incidencia es 0.8-1.5% y ocurre generalmente entre la primera y la segunda semana post-cirugía 5. Los factores de riesgo son: fístula del líquido cefalorraquídeo (LCR), sexo masculino, experiencia del neurocirujano, reoperación, duración de la cirugía y ausencia de profilaxis prequirúrgica 6-8. En el informe del programa de vigilancia de infecciones hospitalarias de Argentina (VIHDA) de 2017 se registraron 23 MN postquirúrgicas en 554 craneotomías, con una tasa de infección de 3.1-4.2% (según índice de riesgo) 9.
La MN post-traumática posee una incidencia del 1-2%, y su mayor incidencia (20-25%) ocurre en fracturas de base de cráneo 5, 10, 11. El trauma es la causa más común de MN recurrente y su principal factor de riesgo es la fístula de LCR 11, 12.
La colocación de distintos tipos de dispositivos en el sistema nervioso central es cada vez más frecuente. Los shunts, en su mayoría derivaciones ventriculares internas (DVI), comprenden diversas localizaciones: ventrículo-peritoneal, ventrículo-atrial, ventrículo-pleural, lumbo-peritoneal. De todas estas, la primera es utilizada en más del 85% de los casos13-15. Según la literatura mundial, la incidencia de la MN o ventriculitis asociada a DVI tiene un amplio rango (0-32%), pero en la mayoría de los estudios informan 5-10% y se presenta principalmente en el primer mes post-procedimiento 5, 13. Es más alta en neonatos (48%) y en pacientes añosos (16.7%) 13, 14. Las variables asociadas con mayor riesgo de infección son la presencia de fístula de LCR, múltiples revisiones, hemorragia intraventricular, experiencia quirúrgica, disciplina quirúrgica en el quirófano, duración de la cirugía y número de veces que el catéter fue inadvertidamente expuesto a guantes quirúrgicos dañados 5, 13-15.
En un extenso metaanálisis de 35 estudios sobre infecciones asociadas a derivaciones ventriculares externas (DVE), se evidenció una incidencia de 11.4/1000 días catéter (IC 95% 9.3-13.5); para estudios de alta calidad, la incidencia fue 10.6 por 1000 días de catéter (IC 95% 8.3-13) 15. Los principales factores de riesgo descriptos son: días de permanencia del catéter (principalmente después del quinto día), muestreo rutinario de LCR, fístulas del LCR, bloqueo del catéter y hemorragia intraventricular 3.
En el informe del VIHDA de 2017 se registraron 69 colocaciones de DVE con una tasa de infección de 2.3-8.0% (según índice de riesgo) 9.
La incidencia de infección con catéteres lumbares externos es inferior al 4.2% y mucho menor si se sigue un protocolo de colocación y mantenimiento con énfasis en su retiro antes del quinto día 16, 17. Los factores de riesgo principales son la duración del catéter, las desconexiones inadvertidas y las infecciones en otros sitios 17.
La MN post-punción lumbar es muy infrecuente (1/20 000 casos) 16. Los factores de riesgo incluyen inadecuada higiene de manos, no utilización de guantes estériles durante la punción lumbar y la falta de métodos de barrera durante la anestesia espinal o la mielografía 18.
La colocación de neuroestimuladores es otra práctica que ha incrementado notoriamente su frecuencia. Esto incluye los estimuladores espinales para el tratamiento de los dolores refractarios, los estimuladores cerebrales para tratamiento de la enfermedad de Parkinson, otras distonías, movimientos anormales y formas de epilepsia refractaria 19-22. El retiro de estos dispositivos por infección conlleva a un deterioro significativo en la calidad de vida del paciente, además de la pérdida económica 19, 21. Estos equipos son similares a los marcapasos, con un generador y cables electrodos que se implantan en el espacio epidural de la médula espinal, o próximos a los ganglios de la base cerebrales. La infección se asemeja en mucho a la infección de los marcapasos cardíacos 21. Puede afectar el bolsillo del generador, el trayecto de los cables y mucho menos frecuentemente se observa meningitis o encefalitis 21.
La tasa de infección es 0.6% a 14.3%. La tasa de infección asociada a neuroestimuladores medulares varía entre 3.4% y 3.6%. Los dispositivos para tratamiento de epilepsia refractaria tienen una tasa de infección del 2.0% al 7.8% 19-22. La mayoría (60%) de las infecciones ocurre en el bolsillo del generador 21. La aparición de la infección principalmente se manifiesta, al igual que en los shunt, entre los 30 y los 60 días del procedimiento 19, 22.
En la Tabla 1 se resumen las diferentes infecciones y sus principales factores de riesgo.
Las meninges –que actúan como barreras naturales para los patógenos– se rompen durante las intervenciones neuroquirúrgicas, lo que permite a los microorganismos que colonizan el cuero cabelludo y la piel, o aquellos que viven en el entorno sanitario, ingresar en el espacio subaracnoideo o en los ventrículos cerebrales y causar infección 5. En un interesante estudio en 101 pacientes con DVE se realizaron muestreos sistemáticos de LCR, hisopados de la piel peri-catéter y del sitio de conexión con el sistema de drenaje. Se identificó un origen cutáneo en el 69% de los casos, y el hisopado de la piel peri-catéter positivo con un germen patógeno, en lugar de un comensal habitual, se asoció con infección 23. En pacientes con derivaciones ventrículo-peritoneales, una ruta menos común por la cual los organismos entran en los ventrículos es por extensión a lo largo del catéter después de una peritonitis 5. En la superficie de los catéteres estos microorganismos suelen formar biofilms, lo que dificulta su erradicación con tratamiento antibiótico (ATB) y hace primordial el retiro del dispositivo 3, 5, 24.

Los principales microorganismos involucrados, según la literatura, son Staphylococcus aureus, enterobacterias (actualmente en gran proporción con betalactamasas de espectro extendido -BLEE), Pseudomonas aeruginosa (PAE), Acinetobacter spp (ABA), Staphylococcus epidermidis (el más frecuentemente aislado – 47% al 64% – y el que genera mayor dificultad en diferenciar colonización de infección), Streptococcus sp, Enterococcus sp, Propionibacterium acnes 5, 15, 24. Como en cualquier infección nosocomial, es de vital importancia conocer la prevalencia de los gérmenes de cada institución para determinar el esquema antimicrobiano empírico. En el informe del VIHDA 2017, los principales gérmenes involucrados en infecciones MN post- craneotomía fueron S. aureus, P. aeruginosa, Acinetobacter sp., Klebsiella pneumoniae y Providencia stuartii 9.
Diagnóstico
El primer paso en el diagnóstico es diferenciar entre MN química o aséptica y MN infecciosa. La presentación de esta última puede ser aguda y grave, si es causada por microorganismos virulentos (S. aureus o bacilos gram negativos), o bien de presentación sutil, en las originadas por gérmenes menos virulentos (S. epidermidis o Propionibacterium acnes) 17.
La triada clásica de la MN (fiebre, cefalea y rigidez de nuca) son signos y síntomas frecuentes en pacientes post-neuroquirúrgicos, no siempre indican infección, y son muy difíciles de evaluar en los pacientes ventilados y sedados. Los signos de irritación meníngea se observan en < 50% de las MN postneuroquirúrgicas5. Además, las manifestaciones clínicas de una ventriculitis con frecuencia pueden ser las mismas que las de la enfermedad que ameritó la cirugía 24.
La presencia de fiebre sin otra causa aparente, una recuperación inusualmente lenta de los síntomas y signos propios del post-operatorio y una alteración o empeoramiento del sensorio o de los signos de foco neurológico, no explicable por otra causa, son datos que orientan hacia la existencia de infección meníngea 5, 17, 24, 25.
En los pacientes con infección asociada al shunt se puede observar fiebre (52%), deterioro del sensorio (29%), cefalea (31%) e hipertensión endocraneana cuando la válvula no funciona. También pueden presentar hidrocefalia, eritema en el trayecto de la válvula o abdomen agudo con peritonitis. Rara vez aparece meningismo (4%) y esto habitualmente se debe a que se desarrolla una ventriculitis y no una MN. En las válvulas ventrículoatriales habitualmente se observa bacteriemia asociada que puede ser persistente 17.
En todo paciente post-neuroquirúrgico febril debe considerarse y evaluarse el foco del sistema nervioso central, además de otros focos probables de un paciente internado (principalmente en los 30 días siguientes al procedimiento) 26.
El diagnóstico se realiza mediante la clínica, el estudio físico-químico y el cultivo del LCR. Es importante destacar que el pronóstico depende del temprano reconocimiento de los síntomas de MN y del comienzo del tratamiento ATB aplicado en forma precoz. Los estudios de neuroimagen (principalmente tomografía -TAC- con contraste endovenoso o resonancia magnética -RMN- con gadolinio) son importantes para descartar otros diagnósticos y para evaluar la presencia de hipertensión endocraneana, colecciones o fístula de LCR. A pesar de su utilidad, su realización nunca debe retrasar el inicio de tratamiento antimicrobiano 5, 26.
Varios estudios evaluaron marcadores sanguíneos o séricos como procalcitonina, proteína C-reactiva y recuento de glóbulos blancos periféricos en pacientes con ventriculitis asociada a la asistencia sanitaria. Martínez y col. 27 demostraron que un valor de corte de procalcitonina sérica ≥ 1.0 ng/ml presenta una especificidad de 77% y una sensibilidad de solo 68% para la ventriculitis, aunque con mayor precisión diagnóstica en la meningitis bacteriana adquirida en la comunidad. Aún falta evidencia para su uso sistemático 17, 27.
El LCR puede ser obtenido por punción lumbar, a través de una ventriculostomía o por punción del reservorio valvular. La parte proximal de los catéteres de LCR están en los ventrículos cerebrales por lo cual la infección resultante es una ventriculitis sin meningitis. Eso tiene implicancia en la presentación clínica y para el sitio de toma de muestras de LCR. La infección carece de signos meníngeos y el sitio de elección para los estudios de LCR sería de origen ventricular y no subaracnoideo 17.
En ausencia de síntomas, la extracción diaria de rutina de LCR por la ventriculostomía no ha demostrado utilidad para identificar precozmente una infección, además es un factor de riesgo para MN, por lo que no se recomienda su realización 3, 17, 28.
El recuento celular y la hiperproteinorraquia presentan baja sensibilidad y especificidad en el postoperatorio neuroquirúrgico 5, 17, 26, 29. En un estudio prospectivo con 172 pacientes con catéteres ventriculares externos, los recuentos celulares en LCR fueron normales en 4 de 18 pacientes en los que la meningitis se confirmó por cultivo (22%), pero una proporción similar de pacientes con cultivo negativo tenía pleocitosis30. Además, cuando existe hemorragia ventricular, la interpretación del recuento celular en LCR resulta difícil a pesar de la utilización de fórmulas 5, 17, 31.
La relación glucorraquia/glucemia < 0.4 es un parámetro más útil que la pleocitosis, pero no alcanza los valores de especificidad descriptos en la MN de la comunidad 5.
El valor diagnóstico del ácido láctico en LCR es superior a otros parámetros bioquímicos (proteinorraquia, glucorraquia o celularidad). Su valor de corte es ≥ 4 mmol/l 5, 17, 32-34. Un metaanálisis de 2016 sobre valor del lactato en LCR en la MN post-neurocirugía –que incluyó cinco estudios con un total de 404 pacientes– mostró sensibilidad de 92% y especificidad de 88% 35. Es considerado un parámetro fundamental en la evaluación de estos pacientes.
La procalcitonina en LCR no ha sido suficientemente estudiada. En un estudio retrospectivo, los pacientes con MN presentaron niveles elevados de procalcitonina y ácido láctico comparado con el grupo sin meningitis (p < 0.001). Cuando el valor de corte es 0.075 ng/ml, la sensibilidad es 68% y la especificidad 85% 36; aunque la superioridad de su determinación en LCR en comparación con la determinación en suero no ha sido demostrada 27.
La presepsina en LCR podría ser útil para diagnosticar infecciones postneuroquirúrgicas, pero con la evidencia disponible hasta ahora es solo un marcador adicional 37.
El cultivo de LCR es el estudio más importante para el diagnóstico de MN o ventriculitis postquirúrgica 5, 26.
La tinción de gram tiene baja sensibilidad y no permite descartar el diagnóstico5. Siempre que se realice previo al inicio del tratamiento ATB, la sensibilidad del cultivo de LCR es elevada (> 90%) cuando la muestra es tomada a través de drenaje ventricular externo (DVE), pero es sustancialmente menor cuando se toma por punción lumbar 17.
Se pueden realizar hemocultivos para incrementar las posibilidades de diagnóstico microbiológico, aunque su sensibilidad es baja (< 20%, excepto en derivaciones ventrículo-atriales, donde es elevada) 26.
No se recomienda realizar cultivo de la punta del catéter ventricular debido a que no existe una estandarización del método y no hay literatura que demuestre su utilidad. La última guía de la Infectious Diseases Society of America recomienda realizarlo ante la sospecha de infección, pero sin ninguna cita que lo avale ni describa la metodología 26.
La reacción en cadena de la polimerasa (PCR) en LCR puede ser útil para detectar organismos fastidiosos o de lento crecimiento en cultivo. Un estudio mostró que no hubo resultados de cultivo positivos en pacientes con PCR de LCR negativa, lo que sugiere que un resultado de PCR negativo es predictivo de la ausencia de infección 38.
También se publicaron resultados positivos de PCR con cultivos negativos lo que deja librada al criterio del médico la interpretación de su relevancia diagnóstica 5, 26, 38.
Se recomienda toma de muestra de LCR de control a través de la DVE a las 48-72 horas de iniciado el tratamiento, con el fin de corroborar la esterilidad del LCR 25, 26. Si el paciente no tiene DVE colocada se recomienda toma de muestra de LCR mediante punción lumbar solo si manifiesta mala evolución 25, 26.
Lozier y col. 39 propusieron una clasificación basada en los síntomas, alteraciones del LCR y los cultivos para el diagnóstico de las infecciones asociadas a DVE, la que fue modificada en 2018 por García-Moncó y col. 16 (Tabla 2). Llamativamente, ninguna de las dos clasificaciones incluye el lactato como parámetro.
El cultivo o los resultados microbiológicos por PCR son los únicos que hacen una diferencia fehaciente entre MN postquirúrgica infecciosa y química (aséptica). La procalcitonina es un biomarcador prometedor al respecto, con evidencia no concluyente aún 26.
En la Figura 1 se resumen las consideraciones diagnósticas de las MN post-quirúrgicas.
Retiro y reinserción de los dispositivos
Ante el diagnóstico de infección asociada a derivación ventricular, tanto externa (DVE) como interna (DVI), todos sus componentes deben ser retirados 5, 17, 27. Solo un estudio prospectivo ha evaluado estrategias de retención o remoción de las DVI, que mostró solo un 30% de curación con el catéter retenido comparado con 90% con retiro y recolocación en un tiempo y 100% con retiro y colocación en un segundo tiempo 40. Por lo tanto, ante una infección asociada a DVI que requiera continuar con una derivación, se sugiere: inicialmente retirar el dispositivo con todos sus componentes, colocar una DVE para aplicar el tratamiento, en estas condiciones con 7-10 días de esterilidad del LCR puede colocarse una nueva DVI 5, 17, 26.

En el caso de los neuroestimuladores, con excepción de las infecciones superficiales que en algunos casos pueden ser controladas con adecuada limpieza de la herida y ATB, las infecciones requieren la extracción de la totalidad de los dispositivos implantados 22. El reimplante de un dispositivo debe realizarse luego de tratada la infección (la duración del tratamiento no ha sido investigada, y dependerá de la evolución del paciente y el tipo de infección) 22.
Tratamiento empírico inicial
Las infecciones del sistema nervioso central son urgencias infectológicas, por lo que, ante la sospecha, debe iniciarse tratamiento ATB en forma precoz sin esperar el resultado de los cultivos.
La elección del ATB depende de: (i) la epidemiología de cada institución, la cual es fundamental conocer y actualizar periódicamente para el diseño de los esquemas empíricos; (ii) la actividad frente al agente causal demostrada in vitro-in vivo; y (iii) que dicho ATB y su régimen de dosis tengan los mejores resultados clínicos, con mínimos efectos adversos, así como el menor efecto en el desarrollo de resistencia. La eficacia del tratamiento en las infecciones del sistema nervioso central está relacionada con la obtención de concentraciones bactericidas en el sitio de infección 41.
Si aún no se conoce la epidemiología institucional, basados en datos nacionales, se recomienda iniciar el tratamiento empírico endovenoso con un agente activo ante S. aureus OXA resistente y otro que sea activo frente a bacilos gram negativos resistentes a cefalosporinas de tercera generación (enterobacterias BLEE+ y P. aeruginosa). En los centros con alta prevalencia de Acinetobacter sp. o de enterobacterias productoras de carbapenemasas se puede asociar colistin o aminoglucósidos (ambos con escasa penetración al sistema nervioso central) 9, 41-43 al tratamiento antimicrobiano empírico inicial (Tabla 3).
Si se utiliza uno de los carbapenemes, el meropenem es el agente de elección por tener menor riesgo de convulsiones; varios estudios clínicos han demostrado su utilidad en la terapéutica empírica de meningitis 26.
Las concentraciones de vancomicina en LCR están directamente relacionadas con las concentraciones en suero lo que permite sugerir altas dosis de mantenimiento, a continuación de la dosis de carga, para alcanzar concentraciones adecuadas en el LCR 43, 44. La dosis utilizada de vancomicina debe ser la necesaria para lograr una concentración sérica mínima en valle de 20 mcg/ml. Se sugiere comenzar con dosis de carga de 25-30 mg/kg y dosis de mantenimiento de 45 mg/kg/día en infusión intermitente (c/8-12 h) o continua 45.
En determinadas circunstancias, una alternativa a la vancomicina es linezolid, ya que alcanza buenas concentraciones en LCR y ha mostrado eficacia en algunos casos de MN estafilocócica y por enterococos resistentes 46, 47.
Tratamiento antibiótico intratecal
La utilización de ATB por vía intratecal no ha sido aprobada por la FDA y las recomendaciones tampoco están bien definidas debido a que la bibliografía es escasa y no de excelencia, y a las secuelas que puede producir (sinequias, hipoacusia, etc.) 26, 48 Cabe destacar que sin duda el principal riesgo es consecuencia de la manipulación incorrecta y repetida de los catéteres. A pesar de esto, el uso de la vía intratecal está difundido tanto en el ámbito local como en el internacional y distintas publicaciones y recomendaciones lo mencionan, protocolizan y definen las situaciones en las que sería beneficioso. El tratamiento intratecal es necesario para tratar MN por infecciones en las que ha fracasado el tratamiento sistémico, en MN a gérmenes multirresistentes, MN a gérmenes solo sensibles a fármacos cuya penetración en el LCR es pobre, o cuando existe dificultad o imposibilidad de retirar material extraño del SNC (abscesos, válvulas, catéteres) 17, 25, 26, 48.

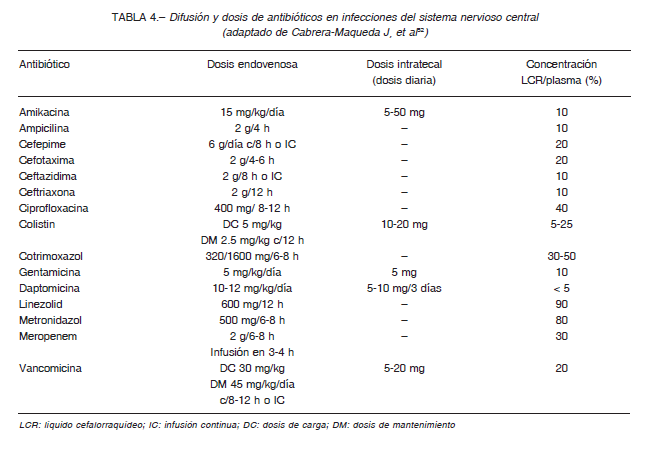
La penicilina y las cefalosporinas no deben ser administradas por vía intratecal por su neurotoxicidad 48. La administración de amikacina, colistin o polimixina es una alternativa válida para bacilos gran negativos multirresistentes 17, 26, 49, 50. La utilización de vancomicina a dosis de 5-20 mg/día vía intratecal es segura y efectiva, con una duración heterogénea de 7 a 21 días, según respuesta clínica. No requiere monitoreo 51. Las dosis recomendadas diarias para vía intratecal se presentan en la Tabla 4 52.
Tratamiento antibiótico según resultados de cultivos
Sobre la base de estudios prospectivos y recomendaciones de la British Society for Antimicrobial Chemotherapy se considera que, ante la sospecha de MN postquirúrgica, es segura la suspensión de los ATB luego de 72 h de lectura de cultivos de LCR negativos, considerando el cuadro como MN química (siempre asegurarse que la muestra se tomó previo al inicio del tratamiento antimicrobiano)53, 54.
Ante un cultivo microbiano positivo de LCR, debe ajustarse el esquema ATB al menor espectro posible, con el fin de preservar a futuro la sensibilidad a antimicrobianos de los gérmenes existentes en el centro de internación, y en eventuales nuevas infecciones en el paciente. Se debe contemplar para el tratamiento definitivo que el/los ATB a utilizar, además de ser activos in vitro frente al microorganismo aislado, tengan buena penetración en el LCR 41-43.
En la Tabla 4 se describe la dosis (endovenosa e intratecal) y la difusión a LCR de los principales ATB usados en infecciones del SNC.
La duración total del tratamiento ATB para estos casos no ha sido evaluada rigurosamente 27. Depende del germen causal, presencia y retiro del dispositivo, presencia de abscesos, compromiso óseo y respuesta clínica 5, 26. Según la última actualización de la Infectious Diseases Society of America, puede recomendarse que, si el germen causal de la MN o ventriculitis es S. aureus o un bacilo gram negativo el tratamiento tenga una duración de 10-14 días y si es por estafilococo coagulasa negativo 7 días 26, aunque la evidencia de estas recomendaciones es baja.
Si el paciente requiere una DVE durante el tratamiento de la ventriculitis o la MN postquirúrgica, puede utilizarse ésta para tomar la muestra de LCR y verificar su esterilidad como resultado del tratamiento ATB. De esta manera se monitorea la respuesta terapéutica 26. No existe una recomendación formal sobre la duración del tratamiento a partir del momento en que se constate la esterilidad del LCR. Esto debería ser objeto de evaluación en estudios futuros.
Prevención
Como en otros procedimientos quirúrgicos, el uso de listas de verificación y paquete de medidas contribuye a la prevención de infecciones 55, 56. La técnica estéril, las precauciones asépticas, los procedimientos efectuados en un quirófano adecuado y el uso de profilaxis antimicrobiana sistémica pre-procedimiento han demostrado contribuir a la disminución de las tasas de infección 55-57.
Los ATB recomendados para la profilaxis prequirúrgica en craneotomías y en la colocación de derivaciones ventriculares son las cefalosporinas de primera generación. Prolongar la profilaxis en el postoperatorio no mostró reducir la tasa de infección y se asocia a mayores efectos adversos 3, 58.
En las fracturas con hundimiento de cráneo la profilaxis ATB puede prevenir las infecciones de la herida, pero no está demostrado que prevenga las infecciones del SNC 6.
Igualmente, la mejor forma de prevenir las infecciones de las heridas es una adecuada y precoz toilette quirúrgica: limpieza, extracción de todos los cuerpos extraños y profundo desbridamiento de todos los tejidos desvitalizados 6.
Se recomienda la búsqueda de colonización por S. aureus y eventual descolonización con mupirocina y baños con clorhexidina ante cirugías programadas, principalmente en las que se va a colocar un implante 54. El baño del paciente previo al procedimiento y el mismo día del mismo se asocia a reducción de las tasas de infección 55.
Para la remoción del cabello se debe utilizar máquina de corte al ras (eléctrica / batería con cabezal descartable), inmediatamente antes de la intervención y fuera de la sala de operaciones 55.
Se recomienda la antisepsia de la piel con soluciones de base alcohólica (clorhexidina o iodopovidona alcohólica) 55. En las neurocirugías en las que se utilice electrobisturí deben considerarse los riesgos por quemadura al utilizar una fuente de combustión, antiséptico con alcohol y la presencia de cabello (retraso de evaporación). El área quirúrgica y el cabello deberían estar secos, sin acumulación del antiséptico de base alcohólica, o se debería utilizar un antiséptico de base acuosa. Debería además considerarse el posible riesgo de neurotoxicidad, evitando el contacto de la clorhexidina con las meninges 55.
En un paciente con DVE, el recambio sistemático del mismo cada 5 días no demostró disminución de la tasa de infección. Solo se debe realizar cuando se sospeche o confirme una infección 3, 59.
Los catéteres de drenajes de LCR impregnados de antimicrobianos disponibles actualmente contienen minociclina o clindamicina, asociadas a rifampicina. En un metaanálisis de 12 estudios que comparaban DVI con catéteres impregnados con ATB vs. no impregnados, la frecuencia de infección fue significativamente menor en los que usaron catéteres impregnados (RR 0.37; p < 0.0001) 60. Una reducción similar en las tasas de infección también fue demostrada en DVE, en un metaanálisis de cinco estudios que mostró una reducción significativa de las infecciones usando catéteres impregnados en antimicrobianos (RR 0.31; p = 0.009)62. Aún faltan estudios de mayor calidad de diseño para confirmar la eficacia de los catéteres impregnados, que deberían ser adoptados luego de cumplir con las medidas básicas mencionadas previamente.
Conclusiones
Las infecciones postneuroquirúrgicas son entidades con elevada morbi-mortalidad que requieren un abordaje diagnóstico y terapéutico estandarizado. El diagnóstico es complejo ya que no se dispone de gold standard, por lo que se apoya en la sospecha clínica, las alteraciones físico-químicas del LCR y el aislamiento microbiano. El tratamiento debe ser precoz y guiado por la epidemiología local. La duración dependerá del microorganismo causal, su sensibilidad y la disponibilidad de tratamientos ATB efectivos en el sitio de la infección. La implementación de medidas de prevención con eficiencia demostrada minimiza el riesgo de infección.
Conflicto de intereses: El Dr. Javier Farina ha recibido honorarios como orador de Pfizer y Biomerieux. La Dra. Wanda Cornistein ha recibido honorarios como oradora y miembro del advisory board de Pfizer, Biomerieux y MSD.
La Dra. María Inés Staneloni ha recibido honorarios como oradora de Pfizer. El resto de los autores no tienen conflicto de intereses para declarar.
Bibliografía
1. CDC – Healthcare-Associated Infections. En: https://www.cdc.gov/winnablebattles/report/HAIs.html; consultado julio 2019.
2. Manual de vigilancia de infecciones hospitalarias, Programa VIHDA. En: http://www.vihda.gov.ar/sitio%20vihdaii/archivospublicaciones/Manual%20de%20VIGILANCIA%20VIHDA%202019%20-%20Vigilancia.pdf; consultado julio 2019.
3. Fried H, Nathan BR, Rowe AS, et al. The insertion and management of external ventricular drains: An evidencebased consensus statement. Neurocrit Care 2016; 24: 61-81.
4. Lietard C, Thebaud, Besson G, Lejeune B. Risk factors for neurosurgical site infections: An 18-month prospective survey. J Neurosurg 2008;109: 729-34.
5. Van de Beek D, Drake JM, Tunkel AR. Nosocomial bacterial meningitis. N Engl J Med 2010; 362: 146-54.
6. Reina R, Ramos G, Balasini C, et al. Profilaxis antibiótica en el paciente politraumatizado. Guías 2011 elaboradas por los Comités de Infectología Crítica y de Trauma de la Sociedad Argentina de Terapia Intensiva (SATI) (Resumen 0169). Med Intensiva 2011; 28: 47.
7. Korinek AM, Baugnon T, Goldmard JL, van Effenterre R, Coriat P, Puybasset L. Risk factors for adults of nosocomial meningitis after craniotomy. Neurosurgery 2006; 59: 126-33.
8. Korinek AM. Risk factors for neurosurgical site infections after craniotomy. A prospective multicenter study of 2944 patients. The French Study Group of Neurosurgical Infections, and the C-CLIN Paris-Nord. Service Epidemiologie Hygiene et prevention. Neurosurgery 1997; 41:1073-81.
9. Programa de vigilancia de infecciones hospitalarias VIHDA – Reporte 2017. En: http://www.vihda.gov.ar/sitio%20vihdaii/archivospublicaciones/Reporte%20Anual%20Enero-Diciembre%202017.pdf; consultado julio2019.
10. Baltas I, Tsoulfa S, Sakellariou P, Vogas V, Fylaktakis M, Kondodimou A. Posttraumatic meningitis: bacteriology, hydrocephalus, and outcome. Neurosurgery 1994; 35: 422-6.
11. Kallel H, Chelly H, Ghorbel M, et al. Posttraumatic meningitis: incidence, bacteriology, and outcomes. Neurochirurgie 2006; 52: 397-406.
12. Israni AV, Mandal A. Recurrent bacterial meningitis-devil is in the details. Childs Nerv Sist 2018; 34: 385-6.
13. McGirt MJ, Zaas A, Fuchs HE, George TM, Kaye K, Sexton DJ. Risk factors for pediatric ventriculoperitoneal shunt infection and predictors of infectious pathogens. Clin Infect Dis 2003; 36: 858-62.
14. Dawod J, Tager A, Darouiche RO, Al Mohajer M. Prevention and management of internal cerebrospinal fluid shunt infections. J Hosp Infect 2016; 93: 323-8.
15. Ramanan M, Lipman J, Shorr A, Shankar A. A metaanalysis of ventriculostomy-associated cerebrospinal fluid infections. BMC Infect Dis 2015; 15: 3.
16. García-Moncó J. (Ed.) CNS Infections. A clinical approach. Ed Springer e-books. En: https://doi.org/10.1007/978-3-319-70296-4.
17. Governale LS, Fein N, Logsdon J, Black PM. Techniques and complications of external lumbar drainage for normal pressure hydrocephalus. Neurosurgery 2008; 63 (Suppl 2): 379-84.
18. Baer E. Post-dural puncture bacterial meningitis. Anesthesiology 2006; 105: 381-93.
19. Conen A, Fux CA, Vajkoczy P, Trampuz AJ. Management of infections associated with neurosurgical implanted devices. Expert Rev Anti-infect Ther 2017; 15: 241-55.
20. Bjerknes S, Skogseid IM, Saehle T, Dietrichs E, Toft M. Surgical site infections after deep brain stimulation surgery: frequency, characteristics and management in a 10-year period. PLoS One 2014; e105288.
21. Deer TR, Provenzano DA, Hanes M, et al. The Neurostimulation Appropriateness Consensus Commitee (NACC) Recommendations for Infection and Management. Neuromodulation 2017; 20: 31-50.
22. Sillay KA, Larson PS, Starr PA. Deep brain stimulator hardware-related infections: incidence and management in a large series. Neurosurgery 2008; 62: 360-6.
23. Mounier R, Lobo D, Cook F, et al. From the skin to the brain: Pathophysiology of colonization and infection of external ventricular drain. A prospective observational study. PLoS ONE 2015; 10: e0142320.
24. Ulloque-Caamaño L, Mo-Carrascal J, Maraby J, et al. Ventriculitis asociada a drenaje extraventricular: etiología, diagnóstico y tratamiento enfocado a unidades de cuidados neurocríticos. Cir Cir 2019; 87: 230-40.
25. Guía de práctica clínica, diagnóstico y tratamiento de la meningitis posquirúrgica y ventriculitis en pacientes adultos internados. Hospital Provincial Neuquén Dr. Eduardo Castro Rendón; 2010. En: http://www.hospitalneuquen.org.ar/download/diagnostico-meningitis-posquirurgica/; consultado julio 2019.
26. Tunkel AR, Hasbun R, Bhimraj A, et al. 2017 Infectious Diseases Society of America’s Clinical Practice Guidelines for Healthcare-Associated Ventriculitis and Meningitis. Clin Inf Dis 2017; 64: e34-e65.
27. Martinez R, Gaul C, Buchfelder M, Erbguth F,Tschaikowsky K. Serum procalcitonin monitoring for differential diagnosis of ventriculitis in adult intensive care patients. Intensive Care Med 2002; 28: 208-10.
28. Kotilainen H R,Gantz NM, Davidson R, Kellogg P, Stone B. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am J Med 1986; 80: 369-76.
29. Pfisterer W, Muhlbauer M, Czech T, Reinprecht A. Early diagnosis of external ventricular drainage infection: results of a prospective study. J Neurol Neurosurg Psychiatry 2003; 74: 929-32.
30. Mayhall CG, Archer NH, Lamb VA, et al. Ventriculostomyrelated infections: a prospective epidemiologic study. N Engl J Med 1984; 310: 553-9.
31. Pfausler B, Beer R, Engelhardt K, Kemmler G, Mohsenipour I, Schmutzhard E. Cell index–a new parameter for the early diagnosis of ventriculostomy (external ventricular drainage)-related ventriculitis in patients with intraventricular hemorrhage? Acta Neurochir (Wien) 2004; 146: 477-81.
32. Leib SL, Boscacci R, Gratzl O, Zimmerli W. Predictive value of cerebrospinal fluid (CSF) lactate level versus CSF/blood glucose ratio for the diagnosis of bacterial meningitis following neurosurgery. Clin Infect Dis 1999; 29: 69-74.
33. Fernández FJ, Coperías JL, Cava F, et al. Determinación de la concentración de lactato en líquido cefalorraquídeo: valor diagnóstico y pronóstico en meningitis bacteriana. Química Clínica 2005; 24: 448-53.
34. Maskin LP, Capparelli F, Mora A, et al. Cerebrospinal fluid lactate in post-neurosurgical bacterial meningitis diagnosis. Clin Neurol Neurosurg 2013; 115: 1820-5.
35. Xiao X, Zhang Y, Zhang L, Kang P, Ji N. The diagnostic value of cerebrospinal fluid lactate for post neurosurgical bacterial meningitis: A meta-analysis. BMC Infect Dis 2016; 16: 483.
36. Li Y, Zhang G, Ma R, et al. The diagnostic value of cerebrospinal fluids procalcitonin and lactate for the differential diagnosis of post-neurosurgical bacterial meningitis and aseptic meningitis. Clin Biochem 2015; 48: 50-4.
37. Abudeev SA, Kiselev KV, Kruglyakov NM, et al. Cerebrospinal fluid presepsin as a marker of nosocomial infections of the central nervous system: A prospective observational study. Front Neurol 2018; 9: 58.
38. Banks JT, Bharara S, Tubbs RS, et al. Polymerase chain reaction for the rapid detection of cerebrospinal fluid shunt or ventriculostomy infections. Neurosurgery 2005; 57:1237-43.
39. Lozier AP, Sciacca RR, Romagnoli MF, Connolly ES Jr. Ventriculostomy-related infections: A critical review of the literature. Neurosurgery 2002; 51: 170-81. Discussion 181-82.
40. James HE, Walsh JW, Wilson HD, Connor JD, Bean JR, Tibbs PA. Prospective randomized study of therapy in cerebrospinal fluid shunt infection. Neurosurgery 1980; 7: 459-63.
41. Villegas RA, Camputaro LA. Infección relacionada con el drenaje ventricular externo: Tratamiento intravenoso versus intratecal. Revisión de la literatura. Rev Argent Neuroc 2006, 20: 133-6.
42. Lutsar I, McCracken GH Jr, Friedland IR. Antibiotic pharmacodynamic in cerebrospinal fluid. Clin Inf Dis 1998; 27: 1117-27.
43. Nau R, Sörgel F, Eiffert H. Penetration of drugs through the blood-cerebrospinal fluid/ blood-brain barrier for treatment of central nervous system infections. Clin Micr Rev 2010; 23: 858-83.
44. Ricard JD, Wolff M, Lacherade JC, et al. Levels of vancomycin in cerebrospinal fluid of adult patients receiving adjunctive corticosteroids to treat pneumococcal meningitis: a prospective multicenter observational study. Clin Infect Dis 2007; 44: 250-5.
45. Rybak M, Lomaestro B, Rotscahfer J, et al. Vancomycin Therapeutic Guidelines: A summary of consensus recommendations from the Infectious Diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Inf Dis 2009; 49: 325-7.
46. Mensa J, Soriano A, Llinares P, et al. Guía de tratamiento antimicrobiano de la infección por Staphylococcus aureus. Rev Esp Quimioter 2013; 26 (suppl 1): 1-84.
47. Liu C, Bayer A, Cosgrove SE, et al. Clinical Practice Guidelines by the Infectious Diseases Society of America for the Treatment of Methicillin-Resistant Staphylococcus aureus Infections in Adults and Children. Clin Inf Dis 2011; 52: e18-55.
48. Ziaia WC, Lewin JJ 3rd. Improving the role of intraventricular antimicrobial agents in the management of meningitis. Curr Op Neurol 2009, 22: 277-82.
49. Nation R, Velkov T, Li J. Colistin and polymyxin B: Peas in a pod, or chalk and cheese? Clin Inf Dis 2014; 59: 88-94.
50. Karaiskos I, Galani L, Baziaka F, Giamarellou H. Intraventricular and intrathecal colistin as the last therapeutic resort for the treatment of multidrug-resistant and extensively drugresistant Acinetobacter baumanii ventriculitis and meningitis. A literature review. Int J Antimicrob Agents 2013; 41: 499-508
51. Ng K, Mabasa V, Chow I, Ensom MH. Systematic review of efficacy, pharmacokinetics, and administration of intraventricular vancomycin in adults. Neurocrit Care 2014; 20: 158-71.
52. Cabrera-Maqueda J, Fuente Rumí L, Valero López G, et al. Difusión de los antibióticos en el sistema nervioso central. Rev Esp Quimioter 2018; 31: 1-12.
53. Anónimo. The management of neurosurgical patients with postoperative bacterial or aseptic meningitis or external ventricular drain-associated ventriculitis. Infection in Neurosurgery Working Party of the British Society for Antimicrobial Chemotherapy. Br J Neurosurg 2000; 14: 7-12.
54. Zarrouk V, Vassor I, Bert F, et al. Evaluation of the management of postoperative aseptic meningitis. Clin Inf Dis 2007; 44: 1555-9.
55. Ministerio de Salud R. Argentina. Actualización sobre medidas de prevención de infecciones del sitio quirúrgico INE-SADI 2015. En: https://www.sadi.org.ar/guiasrecomendaciones-y-consensos/item/300-consenso-sadi-ine-prevencion-de-infeccion-de-sitio-quirurgico-2015; consultado julio 2019.
56. Enchev Y. Checklist in neurosurgery to decrease preventable medical errors: A review. Balkan Med J 2015; 32: 337-46.
57. Barker FG 2nd. Efficacy of prophylactic antibiotics against meningitis after craniotomy: a meta-analysis. Neurosurgery 2007; 60: 887-94. Discussion 887-94.
58. Sociedad Argentina de Infectología. Guía de profilaxis antibiótico quirúrgica 2017. En: https://www.sadi.org.ar/guias-recomendaciones-y-consensos/item/532-guia-deprofilaxis-antibiotica-quirurgica; consultado julio 2019.
59. Wong E, Poon WS, Wai S, Yu LM, Lyon D, Lam JM. Failure of regular external ventricular drain exchange to reduce cerebrospinal fluid infection: result of a randomized controlled trial. J Neurol Neurosurg Psychiatry 2002; 73: 759-61.
60. Thomas R, Lee S, Patole S, Rao S. Antibiotic-impregnated catheters for the prevention of CSF shunt infections: a systematic review and meta-analysis. Br J Neurosurg 2012; 26: 175-84.
