DIEGO A. HERNÁNDEZ 1, 2, JUAN M. ZALOFF DAKOFF 2, CYNTHIA AUAD 2, 3, VÍCTOR E. DERECHINSKY 2, ROBERTO ROSLER 2, SEBASTIÁN PICCIRILO 2, 3, ANA M. MARTÍNEZ 3, MARÍA LUISA FILOMÍA 3, LUISA RAFAILOVICI 3
1División Neurocirugía, Hospital Naval Pedro Mallo, 2 Equipo de Radiocirugía, Hospital Naval Pedro Mallo, 3 Vidt Centro Médico, Buenos Aires, Argentina
Resumen La radiocirugía estereotáctica ha demostrado efectividad en el tratamiento multimodal de los tumores de base de cráneo, de todas maneras se sugiere que en áreas radiobiológicamente sensibles (ej. nervios ópticos y tronco cerebral) la dosis radiante debería reducirse por los efectos radiotóxicos. Para evitar la ineficacia terapéutica, una alternativa recientemente implementada es la radiocirugía multisesión (RCH). Se analizó en forma retrospectiva una serie de tumores de base de cráneo, con el fin de evaluar el tratamiento con RCH a través del control tumoral en las imágenes post-tratamiento. Se evaluó también edad, sexo, histología tumoral, volumen tumoral, protocolo radiante, Karnofsky performance status (KPS) pre-tratamiento y neurocirugía y tratamiento radiante previos. Fueron tratados 84 pacientes entre enero 2009 y enero 2017. La mediana de edad fue 51.5 años; sexo femenino: 53.6%. Hubo un 92.7% de no-progresión luego del tratamiento, con una mediana de tiempo de seguimiento de 36 meses. Los tumores tratados fueron principalmente adenomas hipofisarios, neurinomas del acústico, y meningiomas de base de cráneo. La mayoría de los pacientes recibió un esquema de tratamiento fraccionado de 5 días, con una dosis total de 25 Gy. No se observó radiotoxicidad tardía clínicamente manifiesta. En el análisis multivariado, un KPS alto pre-tratamiento fue significativamente asociado a la no-progresión tumoral. En esta serie, la alta incidencia de no-progresión tumoral indicaría que el tratamiento con RCH podría ser una opción terapéutica en algunos casos de tumores de base de cráneo, principalmente recurrencias o remanencias tumorales de adenomas hipofisarios, neurinomas y meningiomas.
Palabras clave: radiocirugía estereotáctica, tumores de base de cráneo, acelerador lineal, hipofraccionamiento
Abstract Stereotactic radiosurgery has shown effectiveness in the multimodal treatment of skull base tumors, however it is suggested that in radiobiologically sensitive areas (eg. optic nerves and brainstem) the radiation dose should be reduced due to radiotoxic effects. To avoid the consequent therapeutic ineffectiveness, a recently implemented alternative is multisession radiosurgery (RCH). We retrospectively analyzed a series of patients with skull base tumors, in order to evaluate the treatment with RCH through tumor control in the post-treatment images. Age, sex, tumor histology, tumor volume, radiation protocol, pre-treatment Karnofsky performance status (KPS) previous neurosurgery and radiant treatment were also evaluated. Eighty-four patients were treated between January 2009 and January 2017. The median age was 51.5 years; females: 53.6%. There was a 92.7% non-progression after treatment, with a median follow-up time of 36 months. Treated tumors were mainly pituitary adenomas, acoustic schwannomas, and skull base meningiomas. Most of the patients received a 5-day fractionated treatment scheme, with a total dose of 25 Gy. No clinically manifest late radiotoxicity was observed. In the multivariate analysis, a high pre-treatment KPS was significantly associated with tumor non-progression. In our series, the high incidence of tumor non-progression would indicate that treatment with RCH could be a therapeutic option in some cases of skull-base tumors, mainly recurrences or tumor residuals of pituitary adenomas, neurinomas and meningiomas.
Key words: stereotactic radiosurgery, skull base tumors, lineal acelerator, hypofractionation
Dirección postal: Dr. Diego A. Hernández, Hospital Naval Pedro Mallo, Av. Patricias Argentinas 351, 1405 Buenos Aires, Argentina
e-mail: hernandez.da@gmail.com
El tratamiento de los tumores de base de cráneo es complejo y requiere un enfoque multidisciplinario.
El tratamiento con radioterapia es una de las opciones implementadas 1-7, siendo las principales indicaciones de tratamiento radiante las lesiones profundas no resecables, las recurrencias o remanencias tumorales, así como casos seleccionados en los que la radioterapia confiere una reducción significativa del riesgo neurológico, al evitar la intervención quirúrgica (p. ej., glomus yugularis infiltrativos). Sin embargo, aún no ha sido posible definir claramente la modalidad de radiación que proporcione los mejores resultados terapéuticos con el menor riesgo de radiotoxicidad 1-7.
En las últimas tres décadas, se ha logrado demostrar la efectividad de la radiocirugía estereotáctica unisesión (RC) para el control tumoral en lesiones de base del cráneo 2, 8, 12, 14-18. Sin embargo, esta modalidad de radioterapia debe restringirse a lesiones intracraneales que estén al menos a 3 mm de distancia de las estructuras radiosensibles, como los nervios ópticos y el tronco cerebral. Por otra parte, las dosis en estos casos están limitadas a la tolerancia tisular radiobiológica de estas estructuras, que generalmente está en el orden de 6 a 12 Gy 12, 18-20. En el caso de lesiones de la base del cráneo, como los adenomas de hipófisis, se ha establecido que la dosis necesaria para detener el crecimiento del tumor (efecto antiproliferativo) y/o la estabilidad endocrinológica es de 18 Gy para tumores no funcionantes y 25 Gy para adenomas hormono-secretores 1.
Sin embargo, estas dosis suelen ser perjudiciales para las estructuras adyacentes si se administran en una sola fracción.
Bajo estas premisas, algunos autores proponen desde hace algunos años que el fraccionamiento, con eficacia probada en radioterapia, proporcionaría una solución a este respecto en el campo de la radiocirugía estereotáctica.
El fraccionamiento de la dosis permite preservar los tejidos normales a través de los mecanismos intactos de reparación de ADN, mientras produce lesión de las células tumorales 2, 21-29. De este modo, la radiocirugía multisesión o hipofraccionada (RCH) brinda los beneficios de la RC de fracción única para el control tumoral al tiempo que preserva las estructuras adyacentes, lo que es particularmente deseable en el tratamiento de las lesiones de la base del cráneo 21-25.
En el presente artículo, presentamos nuestra experiencia en el tratamiento de pacientes con diversos tumores de la base del cráneo que se sometieron al tratamiento de radiocirugía estereotáctica multisesión.
Materiales y métodos
Se analizó en forma observacional y retrospectiva una cohorte de pacientes con tumores de base de cráneo con el objetivo de evaluar el tratamiento de radiocirugía hipofraccionada (multisesión). Los datos fueron obtenidos de archivos individuales e historia clínicas. Se analizaron las siguientes variables: edad, sexo, histología tumoral, volumen tumoral, esquema radiante, Karnofsky performance status pre-tratamiento, neurocirugía y radioterapia previas. Todos fueron sometidos a diferentes esquemas de dosis a través de equipos de acelerador lineal (ALE) Varian Clinac (Varian Medical Systems, Palo Alto, CA) empleando un haz de fotones con una energía de 6 mega-volt (MV).
Todos los pacientes fueron tratados con un dispositivo de inmovilización recolocable no invasivo, compuesto por una malla termoplástica con una parte inferior y una parte superior ajustadas con precisión a la anatomía craneofacial de cada uno. Ambos lados están unidos al borde horizontal del marco estereotáctico y se fijan a la mesa de tratamiento, por lo que la cabeza permanece inmovilizada durante cada sesión de irradiación, cumpliendo el objetivo de la plena coincidencia de la posición de la cabeza (Fig. 1).
La reproducibilidad del reposicionamiento se verificó diariamente comparando las imágenes radioscópicas realizadas con un sistema de visión portal conectado al equipo con la reconstrucción radiográfica digital (DRR) obtenida de la planificación de la tomografía axial computarizada (TAC), en el plano del isocentro de la lesión.
La planificación se realizó con una TAC como estudio de referencia, obtenida en condiciones estereotácticas, y luego se fusionó la misma con imágenes de resonancia magnética (RM) cuando fuera necesario. Para el plan de tratamiento, utilizamos el software Radioplanner® para RCH, el cual permitió delimitar el blanco volumétrico, realizar el cálculo de coordenadas, conformar la constricción del haz mediante el uso de colimadores cónicos adicionales, establecer los haces de radiación y la dosimetría.
Las coordenadas fueron establecidas por un localizador basado en láser, que permitió definir con absoluta precisión la entrega de los haces. El volumen tumoral global (GTV) se definió como el volumen lesional que realzaba luego de la administración de contraste y se definió como equivalente al volumen clínico (CTV).
El volumen de planificación (PTV) se definió como el GTV más un margen de hasta 2 mm según el tipo de tumor, para integrar el sesgo de precisión del sistema de fijación.

En cada plan de tratamiento, la dosis recibida en el órgano en riesgo (OAR) delimitada por histogramas de dosis-volumen (DVH), se evaluó obteniendo valores de dosis máxima y mínima de acuerdo con el volumen de cada órgano y el PTV. La dosis se prescribió a un punto de referencia (centro de GTV), que era el isocentro. De acuerdo con publicaciones previas sobre dosimetría de este tipo de lesiones, establecimos la dosis máxima diaria de 5 Gy para tratar las lesiones adyacentes a OAR de forma segura. En este caso, la tolerancia radiológica a la dosis es de 8 Gy para el cristalino y los nervios ópticos, y 12 Gy para el tronco cerebral. Los haces de radiación surgidos del ALE de acuerdo con el plan computarizado final, convergen en el blanco a través de arcos de apertura angular de 100° y 120°, en número de 2 a 6.
Todos fueron tratados de forma ambulatoria, y después del tratamiento se realizó un seguimiento con una RM o TAC (cuando la RM estaba contraindicada) a los 30, 90 y 180 días, y luego cada 6 meses después del tratamiento. Toda la información de los estudios por imágenes se obtuvo de los registros de cada paciente. La información de las imágenes postoperatorias se obtuvo de los informes específicos emitidos por el especialista en diagnóstico por imágenes, con la información sobre cualquier cambio de tamaño en comparación con estudios anteriores.
El Comité de Docencia e Investigación Institucional aprobó la ejecución del estudio. Durante el procesamiento de los datos en el momento del análisis, la identidad del paciente permaneció anónima. Todos los procedimientos realizados en estudios con participantes humanos se ajustaron a las normas éticas del comité de investigación institucional y/o nacional y a la declaración de Helsinki de 1964 y sus modificaciones posteriores o normas éticas comparables.
El resultado primario fue la apariencia radiológica de la lesión tratada durante el seguimiento. Esta variable se clasificó en 3 categorías con respecto a la morfología de la lesión en imágenes: 1) reducción, 2) estabilidad y 3) progresión.
Tenemos que considerar que, para este tipo de lesiones, la efectividad del tratamiento se logra cuando no hay progresión tumoral a lo largo del tiempo. Luego, para simplificar la evaluación, la variable se reclasificó en: A) cualquier reducción o estabilidad de tamaño en las imágenes posteriores al procedimiento, y B) progresión de la lesión en las imágenes.
Las otras variables continuas y discretas con múltiples categorías se reestructuraron de la siguiente manera: la edad se dividió en dos categorías dependiendo de si el valor era igual o superior a 60 años, o inferior. El volumen se dividió en dos grupos, dependiendo de si el valor era inferior o superior a 9 cm3 (tumores pequeños frente a tumores más grandes).
La histología se dividió en cuatro categorías: tumores hipofisarios, meningiomas, schwannomas y varios (tumores menos frecuentes). Se excluyeron los adenomas hipofisarios secretores de hormonas dado que el resultado adecuado en este caso no es la no progresión tumoral, sino la normalización bioquímica de la secreción de hormonas. El KPS previo al tratamiento: los pacientes se clasificaron de acuerdo a si tenían un KPS previo ≥ 90 (buen performance status) o < 90 (bajo performance status).
La ausencia de progresión se estimó utilizando el método de Kaplan-Meier. Se realizó un análisis univariado con logrank test y modelos simples de regresión de Cox para analizar la relación entre las variables independientes y el resultado.
Para evaluar la existencia de variables predictivas de mejor resultado, se realizó un modelo múltiple de riesgos proporcionales de Cox. Se construyó incorporando gradualmente las variables con un valor de p < 0.2 en el análisis univariado, y luego las variables con p > 0.2 buscando detectar la interacción. Un valor de p ≤ 0.05 fue establecido como significativo. El análisis estadístico se realizó utilizando el software STATA®.
Resultados
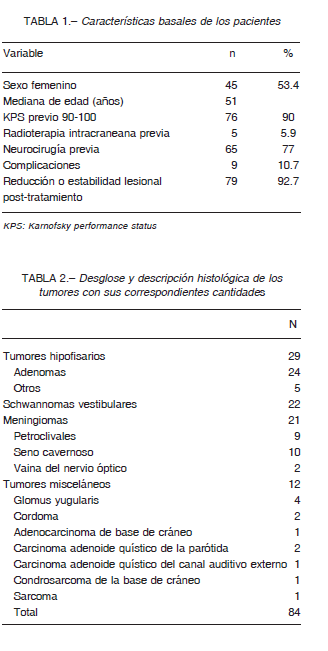
Se analizaron un total de 84 adultos tratados consecutivamente entre enero de 2009 y enero de 2017. El tiempo medio de seguimiento fue de 36 meses (rango 16-96 meses), y el seguimiento finalizó en enero de 2018. Las características basales de la población se presentan en la Tabla 1. La distribución del tipo de tumor se describe en la Tabla 2.
Punto final primario: se observó estabilidad tumoral en el 80.5% de los pacientes durante el seguimiento. El 12.2% mostró reducción tumoral y el 7.3% tuvo una progresión en el tamaño del tumor después del tratamiento.
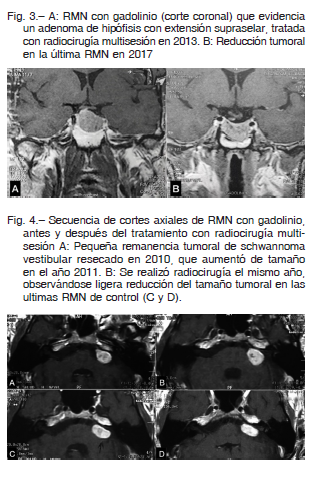
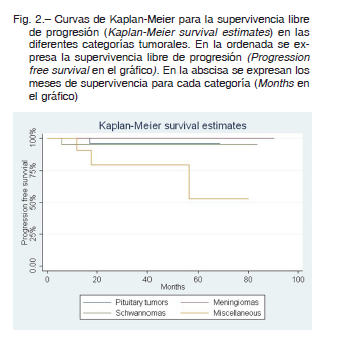
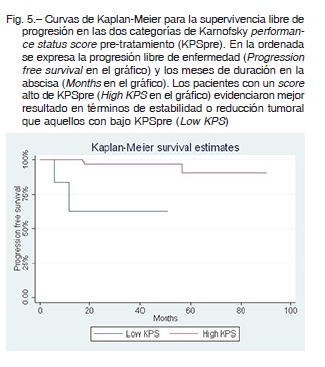
La supervivencia libre de progresión a los cinco años para los tumores hipofisarios fue del 96.3%, para los meningiomas 95.4%, para los schwannomas vestibulares 95% y para el grupo misceláneo 55% (Fig. 2). Ejemplos de casos tratados se muestran en las Figuras 3 y 4.
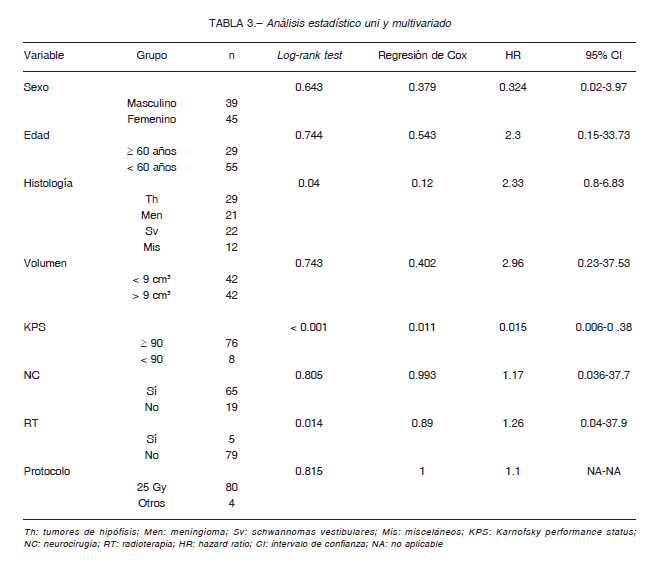
Factores predictivos de mejor resultado: en el análisis de log-rank test no hubo diferencias estadísticamente significativas en las variables sexo, edad, neurocirugía previa, volumen y tipo de protocolo de tratamiento, asociadas con el resultado. Se observaron diferencias estadísticamente significativas en el análisis univariado en el tipo histológico, KPS y radioterapia previa. En el modelo multivariado, no se observó interacción ni efecto de confusión; solo se encontró significación estadística con la variable KPS. Las diferencias en las proporciones de resultados en cada categoría de KPS fueron estadísticamente significativas tanto en el log-rank test (p < 0.001) como en el modelo de riesgos proporcionales de Cox (p = 0.011). Con estos resultados, podríamos decir que los pacientes con un alto score de KPS pre-tratamiento tuvieron un mejor resultado que aquellos con un KPS bajo (HR: 0.015; 95% IC: 0.0006-0.38) (Tabla 3) (Fig. 5).
Volumen: la mediana de volumen tumoral para los tumores hipofisarios fue de 9.8 cm3 (rango: 1.4-25.7 cm3); meningiomas: 11 cm3 (rango: 1.6-49.7 cm3); schwannomas vestibulares: 5.5 cm3 (rango: 1.2-61.9 cm3) y varios: 23.4 cm3 (rango: 4.9-71.3 cm3).
Neurocirugía: de todos los pacientes derivados para tratamiento con RCH, el 77% había sido tratado previamente con resección tumoral. La incidencia más alta de cirugía previa se observó en el grupo con tumores hipofisarios (100%). La proporción más baja de resección previa se observó en el grupo con meningiomas (63%).
Esquemas de tratamiento: la dosis media entregada en el isocentro fue de 25 Gy (rango 15- 25 Gy). El fraccionamiento osciló entre 3 y 5 días como máximo. El protocolo más utilizado (96% de los casos) fue el de 25 Gy con un fraccionamiento de 5 Gy por día.
Toxicidad: durante el seguimiento clínico con el equipo de radiocirugía, se observó un 10.2% de efectos adversos agudos relacionados con el procedimiento, como náuseas, vómitos, cefalea, fatiga y alopecia transitoria.
Hasta el final del estudio, no se informaron complicaciones relacionadas con radiotoxicidad tardía sintomática.
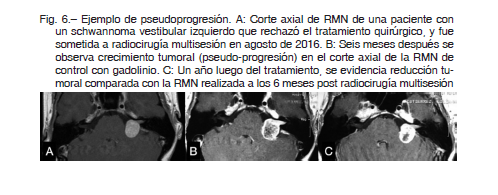
No hubo mortalidad asociada con el procedimiento en ningún caso. Se observó pseudoprogresión en un solo
caso de schwannoma vestibular donde el tumor tenía un volumen mayor que la mediana de su grupo. El paciente no presentó ningún síntoma relacionado y el fenómeno se evidenció solo en la RM en el seguimiento. El caso se describe en la Figura 6.
Discusión
La resección quirúrgica de los tumores de base del cráneo es el tratamiento de primera elección, pero cuando el control tumoral no es posible, o la cirugía está contraindicada debido a los altos riesgos neurológicos, la progresión precoz o la recurrencia del tumor pueden dar lugar a síntomas debilitantes. Es en esta instancia en que el tratamiento radiante entra en consideración 29.
El tratamiento con radioterapia estereotáctica fraccionada (FSRT, por sus siglas en inglés) se ha utilizado ampliamente desde la década de los 90 con buenos resultados en términos de control tumoral; tiene las desventajas del número prolongado de sesiones y dosis totales bastante altas (hasta 60 Gy) como se ha comunicado.
Esta modalidad también ha mostrado una incidencia alta de neuropatías y progresión tumoral 26-31. Las técnicas de radioterapia de alta conformalidad, como la guiada por imágenes, la de intensidad modulada, la terapia de partículas y la RC, han demostrado tener éxito en el tratamiento radiante de la base del cráneo 1,4,8,12-15,17, 29, 32-35.
Logran una caída abrupta de la dosis en los límites del volumen blanco, disminuyendo la dosis en las estructuras circundantes reduciendo la posible radiotoxicidad. Las opciones de radiocirugía actualmente admitidas son la RC de dosis única estándar y la radiocirugía multisesión cuando se administra una dosis total mayor en fracciones (2 a 5) 25,34,36. En el caso de la anatomía de la base del cráneo, la RCH parece ser prometedora con menor toxicidad y mayor conveniencia 12,22,25,34,37.
En el análisis descriptivo de nuestra serie, observamos una distribución equilibrada de sexo y una edad media que refleja una serie con predominio de adultos. En cuanto a la distribución etiológica, se observa una mayor incidencia de tumores hipofisarios, seguidos de meningiomas y schwannomas vestibulares.
En nuestra serie observamos un alto grado de control tumoral local luego del tratamiento, predominantemente en el grupo con tumores benignos. Estos resultados están de acuerdo con los informados en la literatura, con prevalencias que oscilan entre 34 y 100% 8, 15, 29, 30, 33, 34. En algunos casos, como en los meningiomas y los schwannomas, el control tumoral puede llegar al 100% 25, 29, 30, 32, 33, 37, 38. Se espera que algunos tumores (p. ej., meningiomas) crezcan lentamente y, por lo tanto, la estabilidad no sea una respuesta de tratamiento después de todo, sino el curso natural de la enfermedad. Un fenómeno que se asociafrecuentemente con la RCH es la pseudo- progresión (por ejemplo, schwannomas vestibulares). Puede ocurrir hasta en un 30% de los casos durante los primeros seis meses y hasta el primer año posterior a la RCH. Esta pseudo progresión puede remitir a los dos años posteriores al tratamiento. En algunos casos puede ser sintomático, y requerir tratamiento con corticosteroides 25, 39.
La mayoría de nuestros pacientes presentaron buen performance status en el momento de ser sometidos a RCH, como demuestra el alto KPS informado. Creemos que esto puede estar asociado con el sesgo de selección ya que, en la modalidad de tratamiento ambulatorio establecido como requisito de la RCH, el paciente debe estar en buen estado general para someterse a los estudios de neuroimágenes, planificación y tolerancia del dispositivo de inmovilización. En muchos casos, con un bajo perfomance (KPS < 80) la condición fue secundaria a un déficit neurológico que el tratamiento de radiación buscó mejorar. Se demostró que un KPS alto podría asociarse con mejores resultados medidos en la respuesta al tratamiento. Sin embargo, estos resultados deben considerarse cuidadosamente, dado que el número de pacientes en la categoría de “KPS bajo” fue reducido. Un estudio comparativo sería necesario para confirmar estos resultados en el futuro.
En cuanto a los tipos de tumores tratados en nuestra serie, aunque no hubo asociación estadísticamente significativa, observamos una tendencia hacia una mayor progresión en el grupo de tumores misceláneos, comparado con los tumores benignos (tumores hipofisarios, meningiomas y schwannomas).
La proporción de pacientes que previamente habían recibido radioterapia fue baja. Esto se explica en que los tumores analizados en esta cohorte son histológicamente benignos en su mayoría, y rara vez requieren radioterapia como tratamiento inicial. En el grupo de patologías misceláneas, la mayoría de los tumores fueron malignos o de naturaleza agresiva, con una mayor proporción de radioterapia previa. En este grupo la radiocirugía generalmente se indicó como terapia de rescate después de que los tratamientos estándar no lograron controlar los tumores 24, 40, 41. Un mayor grado de progresión tumoral se asoció con este grupo, pero esto no fue estadísticamente demostrable en el análisis multivariado.
La incidencia más alta de cirugía previa se observó en los tumores hipofisarios. Esto coincide con los estándares actuales de aplicación para esta enfermedad, en los cuales la radiación no es la primera opción terapéutica 21.
En los otros grupos la proporción fue menor, y esto se explica en que, en algunos casos, como los pequeños schwannomas vestibulares, está establecido según datos recientes, que se puede recomendar la radiocirugía como opción de tratamiento inicial 12,15. En otros casos, como los pequeños meningiomas del seno cavernoso, actualmente se desaconseja la cirugía o incluso la biopsia, ya que se ha demostrado el alto riesgo neurológico inherente 33, 42.
Esto explica por qué algunos pacientes fueron sometidos a radiocirugía sin cirugía previa. En ausencia de un diagnóstico patológico específico los elementos que apoyan la indicación de radiocirugía inicial se basaron en las características de los estudios por imágenes de las lesiones (espectroscopía por RM o tensor de difusión) y también en la localización, la cual fue considerada suficientemente confiable como para justificar el tratamiento si se cumplían las indicaciones 42.
Se observaron volúmenes tumorales de medianos a grandes en meningiomas y tumores misceláneos. En el primer caso porque las lesiones son heterogéneas; desde pequeños tumores del seno cavernoso hasta voluminosos meningiomas petroclivales residuales. En la mayoría de tumores del grupo misceláneo, como se mencionó anteriormente, son lesiones malignas o de naturaleza agresiva, que eventualmente recayeron con un rápido crecimiento luego del fracaso de la terapia convencional 24, 40. No es el caso de los schwannomas vestibulares, donde se observó la mediana de volumen tumoral más baja. Se explica porque la mayoría de ellas son lesiones pequeñas en las que la radiocirugía se sostiene actualmente como tratamiento de primera elección según sus mejores resultados en términos de preservación de la audición y la función del nervio facial 12, 43.
Nuestro régimen de dosimetría está acorde con los esquemas de tratamiento descriptos actualmente para RCH. Aunque existe cierta variabilidad entre los autores y los tipos de tumores, muchos informan un espectro de dosis total que va de 24 a 30 Gy, en un máximo de 5 fracciones para tumores de base de cráneo 21, 23, 25, 34, 37, 44. Esos protocolos cumplen con el concepto actual de radiocirugía e intentan garantizar el principio de máxima eficacia terapéutica con una menor incidencia de efectos adversos. En nuestros resultados, el alto predominio del plan de 25 Gy excluye cualquier conclusión acerca de la efectividad de los otros protocolos implementados en esta serie. Sin embargo, los esquemas de dosis óptima en RCH requieren más investigación desde el punto de vista biofísico para determinar la dosimetría en esta modalidad, dado que no está regido exactamente por los principios de radiocirugía, ni por los de la radioterapia convencional fraccionada 1, 25.
La proporción de complicaciones agudas en nuestra serie fue baja y no está tan lejos de lo que se describe en publicaciones recientes de RCH, principalmente en comparación con las complicaciones en la serie de RC 1, 15, 45. Una de las principales ventajas observadas sobre los esquemas de fraccionamiento en la radiocirugía de base de cráneo es la reducción de la neurotoxicidad tardía 23, 25.
Las limitaciones del presente estudio son su naturaleza retrospectiva, con una selección sesgada de pacientes, la falta de información que quizás podría comprender un ensayo prospectivo y una cohorte mixta con diferentes tumores. Sin embargo, todavía no hay un volumen considerable de evidencia sobre la implementación de la radiocirugía estereotáctica hipofraccionada en las lesiones de base de cráneo. La mayoría de las publicaciones sobre esta nueva modalidad son pequeñas cohortes.
Muchos de ellos se basan en un subtipo de tumor particular; otros son series generales de tumores de base de cráneo; casi todos tienen información diferente con respecto a la dosimetría, las modalidades de radiación y las tecnologías implementadas. Además, la mayoría de los datos provienen de estudios retrospectivos de centros individuales; pocos son prospectivos, y ninguno de ellos son ensayos controlados aleatorizados. En este contexto, creemos que nuestra serie, aunque general, proporciona información clínica y técnica sustancial sobre el resultado del tratamiento de esta nueva modalidad específica de tratamiento radiante en los tumores más comunes de base de cráneo. Por otro lado, reconocemos que el tiempo medio de seguimiento quizás no sea tan extenso para tumores predominantemente benignos, y que sería deseable un seguimiento más prolongado, pero creemos que esto solo se puede lograr adecuadamente mediante un ensayo prospectivo. De todas formas, vale destacar, que la mayoría de las series de RCH publicadas en la literatura son recientes y no incluyen un seguimiento significativamente mayor del que hemos comunicado 21-25, 32-34, 37, 38, 44. Independientemente de la ausencia de ensayos clínicos aleatorizados prospectivos sobre este tema que determinen la tecnología apropiada, la dosimetría y la modalidad de radiación específica, creemos que la información proporcionada por el presente estudio podría contribuir al conocimiento del tratamiento radiante en los tumores de base de cráneo.
En esta serie de pacientes la alta incidencia de no progresión tumoral indica que el tratamiento con radiocirugía estereotáctica hipofraccionada podría ser una opción válida en el arsenal terapéutico de algunas lesiones de base de cráneo, principalmente remanencias o recidivas tumorales de adenomas hipofisarios, schwannomas y meningiomas.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Amichetti M, Amelio D, Minniti G. Radiosurgery with photons or protons for benign and malignant tumours of the skull base: a review. Radiat Oncol 2012; 7:210.
2. Anker CJ, Shrieve DC. Basic principles of radiobiology applied to radiosurgery and radiotherapy of benign skull base tumors. Otolaryngol Clin North Am 2009; 42: 601-21.
3. De Witte O, Hassid S, Massager N. Tumors involving the base of the skull: diagnostic and therapeutic approaches. Curr Opin Oncol 2009; 21: 238-41.
4. Ding D, Yen CP, Starke RM, Lee CC, Sheehan JP. Unyielding progress: recent advances in the treatment of central nervous system neoplasms with radiosurgery and radiation therapy. J Neurooncol 2014; 119: 513-29.
5. Fernandez-Miranda JC, Gardner PA, Snyderman CH, et al. Clival chordomas: A pathological, surgical, and radiotherapeutic review. Head Neck 2014; 36: 892-906.
6. Prabhu SS, Demonte F. Treatment of skull base tumors. Curr Opin Oncol 2003; 15: 209-12.
7. Suh JH, Saxton JP. Conventional radiation therapy for skull base tumors: an overview. Neurosurg Clin N Am 2000; 11:575-86.
8. Abdelaziz OS, Kandil A, El-Assaal S, Abdelaziz A, Rostom Y, Rashed Y. Linear accelerator-based stereotactic radiosurgery of intracranial meningiomas: results of the first 5 years of clinical practice. Neurosurg Rev 2011; 34: 87-99.
9. Betti O, Derechinsky V. Multiple-beam stereotactic irradiation. Neurochirurgie 1983; 29: 295-8.
10. Betti OO, Derechinsky VE. Hyperselective encephalic irradiation with linear accelerator. Acta Neurochirurgica 1984; 33 (Suppl): 385-90.
11. Betti OO, Galmarini D, Derechinsky V. Radiosurgery with a linear accelerator. Methodological aspects. Stereotact Funct Neurosurg 1991; 57: 87-98.
12. Conley GS, Hirsch BE. Stereotactic radiation treatment of vestibular schwannoma: indications, limitations, and outcomes. Curr Opin Otolaryngol Head Neck Surg 2010; 18: 351-6.
13. De Salles AA, Gorgulho AA, Pereira JL, McLaughlin N. Intracranial stereotactic radiosurgery: concepts and techniques. Neurosurg Clin N Am 2013; 24: 491-8.
14. Deinsberger R, Tidstrand J. Linac radiosurgery as a tool in neurosurgery. Neurosurg Rev 2005; 28: 79-88.
15. Friedman WA, Foote KD. Linear accelerator-based radiosurgery for vestibular schwannoma. Neurosurg Focus
2003; 14(5): e2.
16. Kondziolka D, Flickinger JC, Lunsford LD. The principles of skull base radiosurgery. Neurosurg Focus 2008; 24: e11.
17. McCutcheon IE. Stereotactic radiosurgery for malignant extracerebral intracranial tumors: patient selection, efficacy, and technical nuances. Acta Neurochir Suppl 2013; 116: 71-83.
18. Pollock BE, Foote RL. The evolving role of stereotactic radiosurgery for patients with skull base tumors. J Neurooncol 2004; 69: 199-207.
19. Emami B. Tolerance of Normal Tissue to Therapeutic Radiation. Reports of Radiother Oncol 2013; 1: 35-48.
20. Leavitt JA, Stafford SL, Link MJ, Pollock BE. Long-term evaluation of radiation-induced optic neuropathy after single-fraction stereotactic radiosurgery. Int J Radiat Oncol Biol Phys 2013; 87: 524-7.
21. Killory BD, Kresl JJ, Wait SD, Ponce FA, Porter R, White WL. Hypofractionated CyberKnife radiosurgery for perichiasmatic pituitary adenomas: early results. Neurosurgery 2009; 64(2 Suppl): A19-25.
22. Astradsson A, Wiencke AK, Munck AF, et al. Visual outcome after fractionated stereotactic radiation therapy of benign anterior skull base tumors. J Neurooncol 2014; 118:101-8.
23. Chun SG, Nedzi LA, Choe KS, et al. A retrospective analysis of tumor volumetric responses to five fraction stereotactic radiotherapy for paragangliomas of the head and neck (glomus tumors). Stereotact Funct Neurosurg 2014; 92:153-9.
24. Coppa ND, Raper DM, Zhang Y, et al. Treatment of malignant tumors of the skull base with multi-session radiosurgery. Hematol Oncol 2009; 2: 16.
25. Tuniz F, Soltys SG, Choi CY, et al. Multisession cyberknife stereotactic radiosurgery of large, benign cranial base tumors: preliminary study. Neurosurgery 2009; 65: 898-907.
26. Combs SE, Adeberg S, Dittmar JO, et al. Skull base meningiomas: Long-term results and patient self-reported outcome in 507 patients treated with fractionated stereotactic radiotherapy (FSRT) or intensity modulated radiotherapy (IMRT). Radiother Oncol 2013; 106: 186-91.
27. Litré CF, Colin P, Noudel R, et al. Fractionated stereotactic radiotherapy treatment of cavernous sinus meningiomas: a study of 100 cases. Int J Radiat Oncol Biol Phys 2009; 74: 1012-7.
28. McGregor JM, Sarkar A. Stereotactic radiosurgery and stereotactic radiotherapy in the treatment of skull base meningiomas. Otolaryngol Clin North Am 2009; 42: 677-88.
29. Minniti G, Amichetti M, Enrici RM. Radiotherapy and radiosurgery for benign skull base meningiomas. Radiat Oncol 2009; 4: 42.
30. Minniti G, Clarke E, Cavallo L, et al. Fractionated stereotactic conformal radiotherapy for large benign skull base meningiomas. Radiat Oncol 2011; 6: 36.
31. Solberg TD, Selch MT, Smathers JB, DeSalles AA. Fractionated stereotactic radiotherapy: rationale and methods. Med Dosim 1998; 23: 209-19.
32. Benghiat H, Heyes G, Nightingale P, et al. Linear accelerator stereotactic radiosurgery for vestibular schwannomas: a UK series. Clin Oncol (R Coll Radiol) 2014; 26: 309-15.
33. Combs SE, Ganswindt U, Foote RL, Kondziolka D, Tonn JC. State-of-the-art treatment alternatives for base of skull meningiomas: complementing and controversial indications for neurosurgery, stereotactic and robotic based radiosurgery or modern fractionated radiation techniques. Radiat Oncol 2012; 7: 226.
34. Han J, Girvigian MR, Chen JC, et al. A comparative study of stereotactic radiosurgery, hypofractionated, and fractionated stereotactic radiotherapy in the treatment of skull base meningioma. Am J Clin Oncol 2014; 37: 255-60.
35. Ho JC, Phan J. Reirradiation of skull base tumors with advanced highly conformal techniques. Curr Oncol Rep 2017; 19: 82.
36. Barnett GH, Linskey ME, Adler JR, et al. Stereotactic radiosurgery-an organized neurosurgery sanctioned definition. J Neurosurg 2007; 106: 1-5.
37. Navarria P, Pessina F, Cozzi L, et al. Hypofractionated stereotactic radiation therapy in skull base meningiomas. J Neurooncol 2015; 124: 283-9.
38. Patibandla MR, Lee CC, Sheehan J. Stereotactic radiosurgery of central skull base meningioma’s-volumetric evaluation and long-term outcomes. World Neurosurg 2017; 108: 176-84.
39. Meijer OW, Weijmans EJ, Knol DL, et al. Tumor-volume changes after radiosurgery for vestibular schwannoma: implications for follow-up MR imaging protocol. AJNR Am J Neuroradiol 2008; 29: 906-10.
40. Hauptman JS, Barkhoudarian G, Safaee M, et al. Challenges in linear accelerator radiotherapy for chordomas and chondrosarcomas of the skull base: focus on complications. Int J Radiat Oncol Biol Phys 2012; 83: 542-51.
41. Kano H, Lunsford LD. Stereotactic radiosurgery of intracranial chordomas, chondrosarcomas, and glomus tumors. Neurosurg Clin N Am 2013; 24: 553-60.
42. Klinger DR, Flores BC, Lewis JJ, Barnett SL. The treatment of cavernous sinus meningiomas: evolution of a modern approach. Neurosurg Focus 2013; 35: E8.
43. Somers T, Van Havenbergh T. Multidisciplinary management of vestibular schwannomas: state of the art. B-ENT 2012; 8: 235-40.
44. Collen C, Ampe B, Gevaert T, et al. Single fraction versus fractionated linac-based stereotactic radiotherapy for vestibular schwannoma: a single institution experience. Int J Radiat Oncol Biol Phys 2011; 81: e503-9.
45. Stelzer KJ. Acute and long-term complications of therapeutic radiation for skull base tumors. Neurosurg Clin N Am 2000; 11: 597-604.
