ALFREDO CERISOLA, FEDERICO BALTAR, CEILA FERRÁN, EMILIO TURCATTI
Cátedra de Neuropediatría, Facultad de Medicina, UDELAR, Montevideo, Uruguay
Resumen Los nacimientos prematuros son uno de los principales indicadores de salud de un país. Están asociados a una alta mortalidad e importante morbilidad en niños con parálisis cerebral y otros
trastornos del neurodesarrollo, incluyendo problemas cognitivos y del aprendizaje. Los principales tipos de lesión encefálica en los recién nacidos prematuros son: a) las lesiones de la sustancia blanca, generalmente asociadas a alteraciones neuronales y axonales en la corteza cerebral y otras zonas de sustancia gris; b) hemorragias intracraneanas que incluyen las de la matriz germinal, intraventriculares e intraparenquimatosas y c) del cerebelo. Las lesiones de sustancia blanca incluyen la leucomalacia periventricular quística, no quística (con focos de necrosis microscópicos) y lesiones difusas de sustancia blanca, no necróticas. Estas lesiones tienen múltiples factores etiológicos. Las características anatómicas y fisiológicas de las estructuras vasculares periventriculares predisponen a la sustancia blanca a ser muy vulnerable a las situaciones de isquemia cerebral y, en interacción con factores infecciosos/inflamatorios, activan a las microglías generando estrés oxidativo (por liberación de radicales libres del oxígeno y del nitrógeno), liberación de citoquinas proinflamatorias, liberación de glutamato, fallo energético y alteración de la integridad vascular. Todo lo anteriormente mencionado genera una particular vulnerabilidad de los pre-oligodendrocitos que termina alterando la mielinización. La hipoxia-isquemia también puede producir necrosis neuronal selectiva en diferentes regiones encefálicas. La matriz germinal es un área
altamente vascularizada en la región subependimaria periventricular con una estructura capilar muy frágil que la predispone a las hemorragias.
Palabras clave: recién nacido prematuro, lesión cerebral, leucomalacia periventricular, hemorragia de la matriz germinal, hemorragia intraventricular, parálisis cerebral
Abstract Mechanisms of brain injury of the premature baby. Preterm birth is one of the main country health indicators. It is associated with high mortality and significant morbidity in preterm newborns with cerebral palsy and potential long-term neurodevelopmental disabilities like cognitive and learning problems. The main lesions could be: a) white matter injuries, generally associated with cortical and other regions of grey matter neuronal-axonal disturbances; b) intracranial hemorrhage that includes germinal matrix, intraventricular and parenchymal, c) cerebellum injuries. The white matter lesions include cystic and non-cystic (with microscopic focal necrosis) periventricular leukomalacia and non-necrotic diffuse white matter injury. Multiple etiologic factors are associated with these injuries. Anatomical and physiological characteristics of periventricular vascular structures predispose white matter to cerebral ischemia and, interacting with infection/inflammation factors, activate microglia, generating oxidative stress (mediated by free oxygen and nitrogen radicals), pro-inflammatory cytokine and glutamate toxicity, energetic failure and vascular integrity disturbances. All these factors lead to a particular vulnerability of pre-oligodendrocytes that will affect myelination. Hypoxia-ischemia also may produce selective neuronal necrosis in different cerebral regions. Germinal matrix is a highly vascularized zone beneath ependymal or periventricular region that constitutes a capillary bed with a particular structural fragility that predispose it to hemorrhage.
Key words: preterm infant, brain injury, periventricular leukomalacia, germinal matrix hemorrhage, intraventricular hemorrhage, cerebral palsy
e-mail: alfredocerisola@gmail.com
Los nacimientos prematuros son uno de los principales indicadores de salud de un país. Están asociados con
una alta mortalidad, morbilidad y muy altos costos, la mayoría de los cuales están relacionados con los niños que sufren parálisis cerebral (PC) y otros trastornos del neurodesarrollo, incluyendo problemas cognitivos y del aprendizaje 1.
Principales tipos de lesiones encefálicas en los prematuros
Los principales son: a) lesiones de la sustancia blanca (SB), generalmente asociadas a alteraciones neuronales y axonales en la corteza cerebral y otras zonas de sustancia gris, b) hemorragias intracraneanas (HIC) que incluyen las hemorragias de la matriz germinal, las intraventriculares, y las intraparenquimatosas y c) lesiones del cerebelo 2-5.
Las lesiones de SB incluyen la leucomalacia periventricular (LPV) quística, LPV no quística (con focos de necrosis microscópicos) y lesiones de SB difusas no necróticas 2, 4, 5.
Las HIC se dividen en: Grado I, limitada a la matriz germinal subependimaria (surco caudo-talámico); Grado II, intraventricular sin dilatación ventricular; Grado III intraventricular con dilatación ventricular; Grado IV, hemorragia parenquimatosa que, estrictamente, corresponde a infartos venosos periventriculares con evolución hemorrágica.
Clínicamente, lo más frecuente es que las HIC sean asintomáticas, pero pueden presentarse como un síndrome neurológico intermitente subagudo o, con menor frecuencia, cuando la HIC es más importante, como un síndrome de deterioro neurológico agudo catastrófico 4.
Métodos de diagnóstico: valor de las diferentes pruebas, alcances y limitaciones
La ecografía encefálica y la resonancia magnética (RM) son las principales técnicas utilizadas para el diagnóstico de las lesiones encefálicas perinatales. La ecografía es un método no invasivo y de bajo costo que no requiere trasladar al paciente fuera de las unidades de cuidados intensivos neonatales, por lo cual es la primera opción para evaluar a los pacientes en estas áreas. La ecografía detecta imágenes quísticas en la SB y la HIC. Sin embargo, la ecografía no es efectiva en descubrir lesiones sutiles y/o difusas de SB ni alteraciones de la sustancia gris. Por lo tanto, la RM es más sensible en detectar alteraciones sutiles o difusas, pero requiere el traslado del recién nacido 5, 6.
Dificultades en el análisis de los factores etiológicos de las diferentes lesiones encefálicas en los prematuros
• En la mayoría de los casos existen patrones mixtos donde están presentes dos o más tipos de lesión en
diferentes grados. De hecho, el riesgo de LPV aumenta alrededor de 9 veces para la HIC Grados I-II, y 29 veces para las HIC Grado III-IV 5.
• Dado que las lesiones de SB son clínicamente asintomáticas en la etapa aguda neonatal, es muy difícil
determinar en qué momento, qué factores y con cuánta intensidad actuaron para provocarlas. La mayoría de
las veces múltiples factores se presentan concomitantemente. Por ejemplo, el cerebro perinatal puede ser deprivado del oxígeno por dos mecanismos patogénicos principales: a) hipoxemia, que se refiere a la deficiencia de oxígeno a nivel de la circulación sanguínea tisular y celular, b) isquemia, que se refiere a una perfusión insuficiente (flujo sanguíneo cerebral insuficiente). La isquemia generalmente se asocia con hipoxia celular. Sin embargo, ningún estudio en humanos ha logrado medir la falta de oxígeno tisular en un sitio determinado del parénquima encefálico. El balance de datos experimentales y clínicos apunta a que la isquemia es la más importante de estas dos formas de deprivación de oxígeno. La deprivación de glucosa, en conjunto con la hipoxemia, serían cruciales para producir una lesión. Sin embargo, también se ha propuesto que el momento en el cual ocurrirían muchas de las consecuencias de la isquemia sería en la reperfusión cerebral 7-9.
• Estos factores, cuando son muy graves, pueden producir efectos inmediatos como la necrosis celular,
caracterizada por inflamación celular, desintegración de las membranas, ruptura celular, liberación de los contenidos y, como consecuencia, inflamación circundante y fagocitosis. Sin embargo, los mismos factores, cuando actúan en una forma menos intensa pero más prolongada, pueden activar otra forma de muerte celular como es la apoptosis patológica. En la apoptosis se produce fragmentación del ADN en sitios específicos, condensación y marginación de la cromatina y encogimiento celular con relativa preservación de las membranas celulares. Es más difícil detectar la apoptosis por la falta de reacción inflamatoria y porque tiende a ocurrir muchas horas o días después de la injuria 7.
• Asimismo, sumado a estas dificultades metodológicas en determinar el peso específico de la hipoxia-isquemia como factor etiológico en la encefalopatía del prematuro, el valor de la misma ha sido controvertido y se han propuesto otros mecanismos que incluyen factores relacionados con el desarrollo, el sistema inmune, la respuesta inflamatoria o con la barrera hemato-encefálica 10.
• En la mayoría de los casos, la posibilidad de realizar una RM en la etapa neonatal precoz es limitada en los recién nacidos prematuros graves, cuando existe el mayor riesgo de lesiones de SB (Fig. 1). Asimismo, no existen estudios suficientes que permitan realizar una clara correlación entre el espectro de lesiones neuropatológicas y estudios neurológicos por imágenes. Incluso la RM no permite diferenciar las formas sutiles de LPV no quísticas de las lesiones neuro-axonales y de las gliosis difusas de la SB 5, 6, 11.
• Por último, los modelos animales no siempre permiten una adecuada extrapolación de los resultados obtenidos a la realidad del recién nacido humano pretérmino 10.
Principales teorías que procuran explicar las lesiones encefálicas en los prematuros
Aún con estas limitaciones, se reconocen múltiples factores que predisponen a los prematuros a presentar lesiones en la SB. En primer lugar, las características anatómicas y fisiológicas de las estructuras vasculares periventriculares, con zonas de irrigación arterial terminal y zonas limítrofes con un flujo sanguíneo muy bajo en condiciones basales, lo cual predispone a la SB a ser muy vulnerable a situaciones de isquemia cerebral. En segundo lugar, diferentes factores (hipoxemia, hipo- o hipercarbia, etc.) pueden producir además una pérdida de la auto- regulación cerebrovascular y agravar aún más las condiciones de isquemia cerebral. En tercer lugar, factores infecciosos/inflamatorios maternos y/o del feto interactúan con la isquemia para provocar una mayor alteración de la perfusión cerebral y, en conjunto o aisladamente, activar a las microglías. Esto produce estrés oxidativo (por liberación de radicales libres del oxígeno y del nitrógeno), liberación de citoquinas proinflamatorias, liberación de glutamato, fallo energético y alteración de la integridad vascular. Todo lo anteriormente mencionado genera una particular vulnerabilidad de los pre-oligodendrocitos (pre-OL) que en estas edades gestacionales se encuentran en la SB periventricular y son particularmente susceptibles a la hipoxia-isquemia, al estrés oxidativo y a la excitotoxicidad por el glutamato. La eventual presencia de hierro en exceso como consecuencia de una hemorragia de la matriz germinal, aumenta la vulnerabilidad de los pre-OL al ataque de los radicales libres. La excitotoxicidad por glutamato está mediada por la estimulación de los receptores NMDA y AMPA, que provocan el ingreso masivo de calcio a los pre-OL y a las neuronas, con activación de los mecanismos de muerte celular por apoptosis 1, 8, 9, 12, 13.
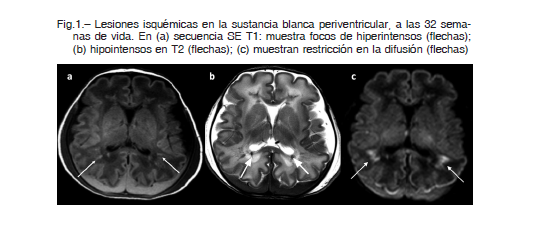
Si los mecanismos lesionales son intensos, se produce necrosis celular con disminución permanente del número de oligodendrocitos y axones, lo cual conduce a la formación de quistes en la SB y a la consiguiente alteración de la mielinización. Si estos mecanismos lesionales son menos intensos, la SB puede afectarse en forma difusa provocando la activación de los programas de muerte celular de los pre-OL (apoptosis) y una respuesta proliferativa que intenta regenerar dichos tipos celulares. En estas condiciones, se produce una astrogliosis reactiva difusa y crónica que genera una disrupción de la matriz extracelular con un exceso de producción de ácido hialurónico que altera la maduración de los pre-OL y, al no diferenciarse normalmente, provocan la alteración de la mielinización 12, 13.
La hipoxia-isquemia en el recién nacido prematuro también puede producir necrosis neuronal selectiva que
afecta, particularmente, a la protuberancia, los núcleos grises de la base y los hipocampos 4.
Por otro lado, puede producirse una hemorragia en la matriz germinal que –en el pretérmino grave– es una
estructura altamente vascularizada en la región subependimaria periventricular donde se encuentran los precursores neurogliales que migrarán durante el desarrollo encefálico y constituirán oligodendrocitos y astrocitos de la SB y neuronas GABAérgicas destinadas a los tálamos y a la corteza cerebral. Existen múltiples factores que explican la fragilidad estructural de la matriz germinal que la predispone a la hemorragia: a) la vascularización arterial irriga una red capilar compuesta por vasos relativamente grandes y con paredes endoteliales débiles, b) la lámina basal es frágil debido a la deficiencia en fibronectina y colágeno y a una barrera hematoencefálica con prolongaciones de astrocitos discontinua, c) la menor expresión de la proteína ácida fibrilar de la glía disminuye la fuerza de la estructura del citoesqueleto que sostiene a los vasos sanguíneos, d) esta vasculatura carece de mecanismos de auto-regulación para modular la luz sanguínea en condiciones hemodinámicas fluctuantes. La hemorragia de la matriz germinal provoca pérdida de progenitores celulares y mayor lesión de SB por vía de la presión y del estrés oxidativo, contribuyendo a la patogénesis de la LPV. Las hemorragias intraventriculares pueden, además, complicarse con hidrocefalia o con alteración en el desarrollo del cerebelo. Esto último ocurriría debido a que la hemosiderina liberada en el líquido céfalorraquídeo provocaría la pérdida de la capa granular externa del cerebelo generando una disminución de las células de Purkinje y de las fibras cerebelo-pontinas 3-5.
Repercusión a largo plazo de las lesiones encefálicas en los prematuros
Las tasas de supervivencia de los prematuros difieren dependiendo de la calidad en medicina neonatal y el status socio-económico del país 14. En los países desarrollados, entre un 64-75% de la mortalidad infantil está vinculada a la prematuridad, así como un 42-47% de los casos de PC, 27% de los casos de trastornos cognitivos y de 37% y 23% de los trastornos visuales y auditivos graves, respectivamente 15. Cerca de un 10% de los pacientes prematuros graves desarrollarán PC, más frecuentemente una diplejía espástica 16.
En una serie retrospectiva de 408 pacientes con LPV, 61% eran prematuros. La LPV fue la principal causa de PC, sobre todo en prematuros. En esta serie, 52.2% desarrolló una PC de tipo diplejía espástica, 28% cuadriparesia espástica, 15.4% PC espástica unilateral, hipotonía en 3.9% y PC disquinética en 0.5%. Sin embargo, es importante consignar que la LPV también se puede observar en los recién nacidos de término 17.
Las hemorragias intraventriculares pueden producir una hidrocefalia aguda o subaguda-crónica. La secuela
más frecuente del infarto hemorrágico periventricular (HIC Grado IV) es un gran quiste porencefálico que prácticamente en la totalidad de los casos se asocia con PC 4.
Medidas terapéuticas para la prevención y el tratamiento de las lesiones encefálicas en la prematuridad
Las medidas terapéuticas que en el período perinatal pueden influir en el pronóstico incluyen la prevención del parto prematuro, la administración de corticoides y de sulfato de magnesio prenatales, el control de los niveles de oxígeno y de CO2, de la tensión arterial, los niveles de glucosa, las crisis epilépticas y el ductus arterioso permeable. Se están investigando fuertemente medidas neuroprotectoras como la administración en el período neonatal de eritropoyetina, de factor de crecimiento epidérmico, factor de crecimiento de tipo insulina y de células madre. Finalmente, deben considerarse factores como la exposición auditiva y visual y el contacto humano cuando los recién nacidos prematuros se encuentran en unidades de cuidados intensivos 9, 18.
Aunque la hipotermia terapéutica para los recién nacidos de 35 semanas o mayores con encefalopatía
hipóxico-isquémica moderada a grave es la primera opción terapéutica dado el aumento de la supervivencia a largo plazo sin discapacidad, la aplicación de esta técnica a los menores de 35 semanas solo debe ser realizada con protocolos de investigación y con el consentimiento informado de los padres 19.
La integración de dos herramientas, como son la Evaluación de los Movimientos Generales de Prechtl y el
Examen Neurológico Infantil de Hammersmith, pueden contribuir en la detección precoz de PC y otras alteraciones del neurodesarrollo en prematuros y permitir instrumentar un tratamiento de rehabilitación de forma más oportuna 20.
Conclusiones
La importancia de conocer los diferentes mecanismos de lesión encefálica de los prematuros radica en el alto riesgo que presentan de desarrollar PC y otros trastornos del neurodesarrollo. Asimismo, conocer estos mecanismos permite pensar en estrategias de diagnóstico y prevención específicas, más allá de la prevención primaria del parto prematuro. Sin embargo, lo habitual es que múltiples factores se presenten concomitante o sucesivamente para generar más de un tipo de lesión, muchas veces con manifestaciones clínicas sutiles o ausentes en el período perinatal, lo cual dificulta determinar en qué momento, qué factores y con cuánta intensidad actuaron para provocar las lesiones y, por lo tanto, es difícil poder alcanzar un diagnóstico y tratamiento precoz en cada caso particular.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Galinsky R, Lear CA, Dean JM, et al. Complex interactions between hypoxia-ischemia and inflammation in preterm brain injury. Dev Med Child Neurol 2018; 60: 126-33.
2. Kinney HC, Volpe JJ. Encephaolpathy of prematurity: Neuropathology. In: Volpe JJ, Inder TE, Darras BT, et al (eds.). Volpe´s Neurology of the Newborn, 6th ed. Philadelphia: Elsevier Inc., 2018, p 389-404.
3. Luo J, Luo Y, Zeng H, Reis C, Chen S. Research advances of germinal matrix hemorrhage: an update review. Cell Mol Neurobiol 2019; 39: 1-10.
4. Inder TE, Perlman JM, Volpe JJ. Preterm Intraventricular Hemorrhage/ Posthemorragic Hydrocephalus. In: Volpe JJ, Inder TE, Darras BT, et al (eds.). Volpe´s Neurology of the Newborn, 6th ed. Philadelphia: Elsevier Inc., 2018, p 637-98.
5. Hinojosa-Rodríguez M, Harmony T, Carrillo-Prado C et al. Clinical neuroimaging in the preterm infant: Diagnosis and prognosis. Neuroimage Clin 2017; 16: 355-68.
6. Sewell EK, Andescavage NN. Neuroimaging for neurodevelopmental prognostication in high-risk neonates. Clin Perinatol 2018; 45: 421-37.
7. Inder TE, Volpe JJ. Hypoxic-ischemic and related disorders. Pathopsysiology: General principles. In: Volpe JJ, Inder TE, Darras BT et al (eds.). Volpe´s Neurology of the Newborn, 6th ed. Philadelphia: Elsevier Inc., 2018, p 325-88.
8. Paneth N. Hypoxia-ischemia and brain injury in infants born preterm. Dev Med Child Neurol 2018; 60: 115.
9. Neil JJ, Volpe JJ. Encephaolpathy of prematurity: Clinical-Neurogical Features, Diagnosis, Imaging, Prognosis, Therapy. In: Volpe JJ, Inder TE, Darras BT, et al (eds.). Volpe´s Neurology of the Newborn, 6th ed. Philadelphia: Elsevier Inc., 2018, p 425-57.
10. Gilles F, Gressens P, Dammann O, Leviton A. Hypoxiaischemia is not an antecedent of most preterm brain damage: the illusion of validity. Dev Med Child Neurol 2018; 60: 120-5.
11. Volpe JJ. Confusions in nomenclature: “periventricular leukomalacia” and “white matter injury”-identical, distinct, or overlapping? Pediatr Neurol 2017; 73: 3-6.
12. Back SA, Volpe JJ. Encephaolpathy of prematurity: Pathophysiology. In: Volpe JJ, Inder TE, Darras BT, et al (eds.). Volpe´s Neurology of the Newborn, 6th ed. Philadelphia: Elsevier Inc., 2018, p 405-24.
13. Pregnolato S, Chakkarapani E, Isles AR, Luyt K. Glutamate transport and preterm brain injury. Front Physiol 2019; 10: 417.
14. Benavente-Fernández I, Synnes A, Grunau RE, et al. Association of socioeconomic status and brain injury with neurodevelopmental outcomes of very preterm children. JAMA Netw Open 2019; 2: e192914.
15. Allen MC. Neurodevelopmental outcomes of preterm infants. Curr Opin Neurol 2008; 21: 123-8.
16. Larroque B, Ancel PY, Marret S, et al. Neurodevelopmental disabilities and special care of 5-year-old children born before 33 weeks of gestation (the EPIPAGE study): a longitudinal cohort study. Lancet 2008; 371: 813-20.
17. Shang Q, Ma CY, Lv N, et al. Clinical study of cerebral palsy in 408 children with periventricular leukomalacia. Exp Ther Med 2015; 9: 1336-44.
18. Novak CM, Ozen M, Burd I. Perinatal brain injury: mechanisms, prevention, and outcomes. Clin Perinatol 2018; 45: 357-75.
19. Committee on Fetus and Newborn, Papile LA, Baley JE, Benitz W, et al. Hypothermia and neonatal encephalopathy. Pediatrics 2014; 133: 1146-50.
20. Romeo DM, Guzzetta A, Scoto M, et al. Early neurologic assessment in preterm-infants: Integration of traditional neurologic examination and observation of general movements. Eur J Paediatr Neurol 2008; 12: 183-9.
