CEILA FERRÁN, VIRGINIA PEDEMONTE, EMILIO TURCATTI, GABRIEL GONZÁLEZ
Centro Hospitalario Pereira Rossell, Facultad de Medicina, Universidad de la República, Montevideo, Uruguay
Resumen La neuromielitis óptica (NMO) es un trastorno autoinmune, inflamatorio y desmielinizante del sistema nervioso central con predilección por los nervios ópticos y médula espinal. En el año 2004 se publicó la asociación de NMO con un anticuerpo contra el canal de agua acuaporina 4 (anti-AQP4), como una enfermedad diferente de la esclerosis múltiple (EM). Actualmente se propone el término trastornos del espectro NMO (NMOSD), debido a que las manifestaciones de la enfermedad pueden ser más extensas, afectando además del nervio óptico y médula espinal, al área postrema del bulbo raquídeo, tronco encefálico, diencéfalo y áreas cerebrales típicas (periependimarias, cuerpo calloso, cápsula interna y sustancia blanca subcortical). NMOSD se aplica también a pacientes que cumplen los criterios de NMO y son negativos para anti-AQP4. Dentro de este último grupo se ha detectado en un 20% la presencia de otro anticuerpo, anti-MOG (Glicoproteína oligodendrocítica de mielina) con un mecanismo fisiopatológico diferente pero con una clínica, en algunos casos, similar, y en general con mejor pronóstico. El tratamiento inmunosupresor en la crisis, así como el tratamiento a largo plazo en los casos que esté indicado, es fundamental para evitar secuelas y recidivas. El diagnóstico correcto de esta entidad es fundamental ya que puede ser agravado con el uso de fármacos útiles en el tratamiento de EM. En esta publicación haremos una revisión de la fisiopatología, clínica y criterios diagnósticos de NMOSD, y discutiremos las distintas opciones terapéuticas.
Palabras clave: neuromielitis óptica, espectro neuromielitis óptica, acuaporina 4, inmunoglobulina G, glicoproteína oligodendrocítica de mielina
Abstract Neuromyelitis optica. Neuromyelitis optica (NMO) is an autoimmune, inflammatory and de myelinat ing disorder of the central nervous system with a predilection for the optic nerves and spinal cord. In 2004 the association of NMO with an antibody against the water channel aquaporin 4 (anti-AQP4) was published as a different pathology from multiple sclerosis (MS). Currently the term NMO spectrum disorders (NMOSD) is proposed, because the manifestations of the disease can be more extensive, affecting in addition to the optic nerve and spinal cord, the area postrema of the dorsal medulla, brainstem, diencephalon and typical brain areas (periependymal, corpus callosum, internal capsule and subcortical white matter). NMOSD is also applied to patients who meet the NMO criteria and are negative for AQP4-IgG. Within the latter group, the presence of another antibody, anti-MOG, has been detected in 20%, with a different physiopathological mechanism, but with a similar clinic and a better prognosis. The immunosuppressive treatment in the attack, as well as the long-term treatment in the cases that are indicated, is fundamental to avoid sequelaes and recurrences. The correct diagnosis of this entity is essential since it can be aggravated with the use of drugs useful in the treatment of MS. In this publication we will review the pathophysiology, clinical and diagnostic criteria of NMOSD, and discuss the
different therapeutic options.
Key words: neuromyelitis optica, neuromyelitis optica spectrum disorders, aquaporin-4, immunoglobulin G, myelin oligodendrocyte glycoprotein
e-mail: viciogon@hotmail.com
Desde la primera descripción de neuromielitis óptica (NMO) en el año 1894, se ha ampliado el conocimiento
clínico, fisiopatológico, neuroinmunológico y neuroimagenológico hasta establecer en el 2015 el concepto de «trastornos del espectro neuromielitis óptica» (NMOSD).
Este es un grupo de trastornos inflamatorios del sistema nervioso central (SNC) que se caracterizan por episodios de desmielinización y daño axonal mediada por el sistema inmunitario que involucran principalmente los nervios ópticos y la médula espinal.
Considerada inicialmente como un subtipo de esclerosis múltiple (EM), el descubrimiento en los últimos años de un auto anticuerpo específico dirigido contra acuaporina 4 (AQP4), principal canal de agua en el SNC, ha identificado claramente a la NMO como una enfermedad diferente, que clásicamente se define como la asociación de neuritis óptica y mielitis. El término NMOSD incluye la NMO más otras formas restringidas del trastorno, como neuritis óptica (NO) recurrente, mielitis transversa (MT) recidivante y algunas presentaciones encefálicas y del tronco cerebral comunes en niños. En formas seronegativas para anti-AQP4 pueden identificarse anticuerpos contra la glicoproteína oligodendrocítica de mielina (MOG) como una entidad particular, frecuente en pediatría, que puede presentarse clínicamente con un espectro de síndromes desmielinizantes que incluye los NMOSD, con diferencias fisiopatológicas y pronósticas que actualmente generan controversias terapéuticas.
Epidemiología
El NMOSD es generalmente esporádico, con alrededor de 3% de casos familiares, relacionados al alelo HLADRB11-3. Es una enfermedad rara que afecta a todas las etnias, predominando en afrodescendientes y asiáticos, con una prevalencia estimada entre 1-4/100 000 1, 2, 4. Predomina en mujeres jóvenes (68 a 88%) y en un 25% asocian otra enfermedad autoinmune, especialmente los casos seropositivos para anti-AQP4 1, 5. Un 5% son de inicio en la edad pediátrica, con predominio en niñas 3:1 y una media de presentación de 12 años 2, 4, 6. Aproximadamente entre un 15-20% de eventos desmielinizantes en pediatría cumplen criterios de NMOSD 7.
Fisiopatología
Las causas de NMO y NMODS aún son desconocidas, pero se reconoce ampliamente que estas afecciones son
principalmente desórdenes mediados por anticuerpos, siendo la respuesta inmune humoral que ataca a los
astrocitos quien desempeña el papel principal 1. Se han descrito varias dianas inmunes patógenas en NMOSD, siendo las más reconocidas la AQP4, la MOG y la proteína del ácido fibrilar glial (GFAP) 1, 5.
Las acuaporinas regulan el transporte de agua en muchos órganos, como el sistema nervioso. La AQP4,
objetivo principal en la patogénesis de la NMO, se concentra en los astrocitos de la barrera hematoencefálica (BHE) 1. Cuando el anticuerpo se une selectivamente al antígeno AQP4 en los procesos del pie del astrocito, causa el aumento de la permeabilidad de la BHE. Esta unión activa el complemento, con la subsiguiente infiltración tisular de leucocitos, linfocitos T (CD3+ y CD8+) y células NK. El proceso inflamatorio resultante conduce al daño y muerte de los astrocitos y al compromiso secundario de oligodendrocitos y neuronas 1, 5, 8.
Manifestaciones clínicas
La presentación clínica de los pacientes con NMOSD es muy variable, ya que la sintomatología puede originarse por la afectación de áreas distintas del SNC (nervio óptico, médula espinal, área postrema, tronco encefálico, diencéfalo y cerebro).
La NO se manifiesta por pérdida aguda de visión, discromatopsia, asociada a dolor ocular, uni o más
comúnmente bilateral. Suelen ser lesiones extensas del nervio óptico que involucran el sector quiasmático y prequiasmático 1, 9, 11.
La afectación de la médula espinal se manifiesta como una MT, con síntomas motores, sensitivos y esfinterianos 11.
El síndrome de área postrema se caracteriza por hipo, náuseas y vómitos incoercibles 5,9,10. Los síntomas agudos de tronco encefálico incluyen disfunción sensorial, ocular, motora, o cerebelosa asociados a lesio|nes parenquimatosas o peri-ependimarias contiguas o no al compromiso espinal 11.
Los síndromes diencefálicos incluyen hipersomnia, narcolepsia, anorexia, hipotermia, hiponatremia, hiperprolactinemia, menstruaciones irregulares y cambios conductuales debidas a lesiones a nivel del tálamo, hipotálamo o peri-ependimiarias del tercer ventrículo 5, 11, 12. Los síndromes cerebrales pueden presentarse con hemiparesia, pérdida hemisensorial, encefalopatía, pérdida del campo visual posquiasmática y pérdida de la visión cortical a menudo asociados con lesiones extensas, irregulares, confluyentes, subcorticales o de sustancia blanca profunda 1, 9, 11.
El primer evento en la mayoría de los casos es una NO o MT aislada o combinada y menos del 10% debutan como evento similar a encefalomielitis diseminada aguda (ADEM-like) 7. La mayoría de los casos AQP4 (+) son formas crónicas recurrentes generando discapacidad residual.
Métodos diagnósticos
La resonancia magnética (RM) es el examen de elección para identificar las lesiones. En la etapa aguda son hiperintensas en secuencias T2-Flair e hipointensas en secuencias T1 y pueden presentar realce con gadolinio.
El compromiso uni o bilateral del nervio óptico, en su porción posterior o quiasmática, provocando una NO
retrobulbar extensa es sugestivo de NMOSD. La MT longitudinal extensa (MTLE) se expande ≥ 3 segmentos
vertebrales, involucra la sustancia gris central con realce en fase aguda y atrofia en fase crónica. Dicho hallazgo es característico y se observa evolutivamente en la mayoría de los casos, destacando que en su debut un 14% se presentan como MT 13.
Las lesiones en médula dorsal, área postrema y cerebrales diversas son más frecuentes en niños, predominando en áreas de mayor expresión de AQP4.
El líquido cefalorraquídeo (LCR) puede presentar, en la mitad de los casos, aumento de proteínas y pleocitosis con predominio de polimorfonucleares. Un bajo porcentaje de pacientes presenta bandas oligoclonales (BOC) en LCR al inicio de la enfermedad, las cuales tienden a desaparecer con el tiempo, a diferencia de la EM. Se ha visto también elevación de la proteína astrocítica GFAP (del inglés glial fibrillary acidic protein) en LCR en casos con mayor número de recaídas y se correlaciona con mayor grado de discapacidad 1, 14.
La determinación en suero del anticuerpo anti-AQP4 es fundamental para el diagnóstico de la enfermedad,
siendo positiva en un 60-90% de los casos de NMO 1, 6, 9.
Son altamente específicos para NMO (85-99%) con una sensibilidad del 70-90% 1, 6, 9. Esta sensibilidad y especificidad diagnóstica varía de acuerdo al método de laboratorio utilizado, obteniendo los mejores resultados con ensayos basados en células transfectadas. Un 10-25% de los pacientes diagnosticados con NMOSD son seronegativos para anti-AQP4, y de este grupo, una fracción resulta positivo para anticuerpos anti-MOG 10, 12, 14.
Los estudios para descartar enfermedades autoinmunes asociadas (lupus, miastenia gravis, Sjögren) se
realizan especialmente en casos AQP4 (+).

Criterios diagnósticos
En el año 2015 se publicaron los criterios actuales para el diagnóstico de NMOSD (Tabla 1), diferenciando según el estado serológico un grupo seropositivo para AQP4 que deben cumplir al menos un criterio esencial y otro grupo seronegativos para AQP4 o no conocido, que deben cumplir con dos de los seis criterios clínicos esenciales, siendo al menos uno de ellos NO, MT o síndrome del área postrema con episodios únicos o múltiples 13, 14.
Este consenso ha permitido aumentar las tasas de diagnóstico, con mayor sensibilidad y especificidad, y
disminuir el tiempo medio de diagnóstico 5, 9. Estos criterios fueron definidos para adultos, pero se admite su utilización en niños con algunas precauciones 6, 9.
Trastornos del espectro neuromielitis óptica con anticuerpo MOG o síndrome anti-MOG
Recientemente, varios estudios han identificado una nueva diana antigénica, la MOG. Este anticuerpo se
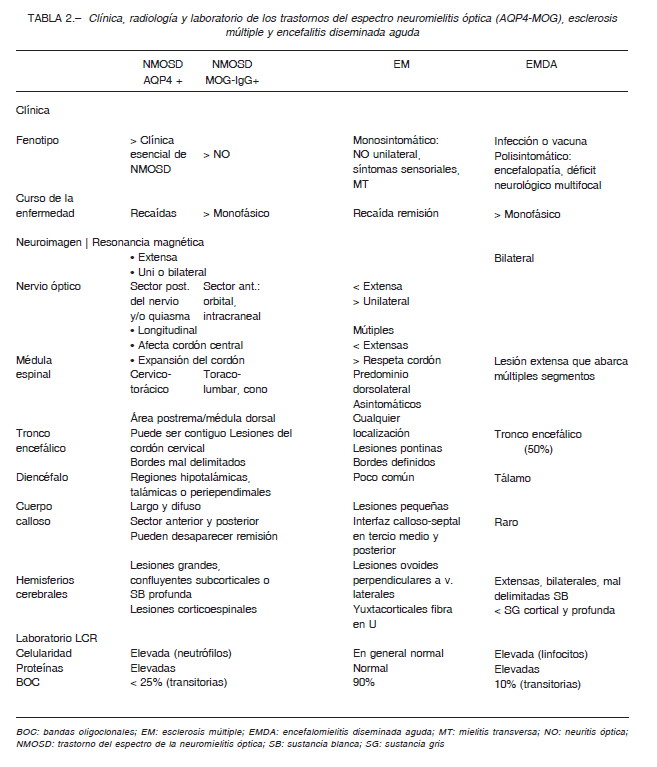
encuentra aproximadamente en un 30% de los eventos desmielinizantes y en un 20% de aquellos con NMOSD seronegativos para AQP4 7, 12, 16, 17. Anti-AQP4 y anti-MOG actualmente son consideradas entidades diferentes, con superposición clínica, diferente fisiopatología, evolución y pronóstico (Tabla 2). Si bien actualmente se discute su categorización nosológica, la mayoría de los autores la consideran una entidad propia 2.
En los casos con anti-MOG positivos, no se observa el alto predominio en mujeres ni la asociación con otros trastornos autoinmunes 5, 14, 17.
En cuanto a la clínica, la NO (88% en pacientes anti-MOG+) es más común que la mielitis (56%) 7, 12, 16, 17. El compromiso del nervio óptico suele ser de su segmento anterior con gran componente inflamatorio expresado por un aumento en su calibre, tortuosidad y realce de la vaina que se visualiza con el contraste en la RM. Las lesiones medulares predominan en sector inferior, dorso lumbar, a diferencia que en los pacientes con anti-AQP4 o seronegativos en los cuales predominan a nivel cervicotorácico 12, 15-17. Los síntomas del tronco encefálico son menos frecuentes12. Las lesiones cerebrales son similares a ADEM y no predominan en áreas periependimarias.
Muchas comunicaciones afirman que el curso de la enfermedad es menos grave, siendo frecuente la
recuperación completa, dado que los anti-MOG causan alteraciones reversibles de la mielina sin activación del complemento o infiltración de células inflamatorias, requiriendo menos terapias inmunosupresoras 6, 12, 14, 17. Se han descrito casos recurrentes con anticuerpos anti-MOG positivos y otros de evolución no tan benigna como en la serie publicada en adultos por Pache y col. 8. Aún es necesario definir mejor esta entidad, especialmente en la población pediátrica donde los anticuerpos MOG se asocian también a otras enfermedades desmielinizantes, como ADEM, evento desmielinizante aislado (NO, MTLE) y excepcionalmente EM, observando un descenso de niveles séricos del anticuerpo en formas monofásicas y su persistencia en las recurrentes 5, 6, 14, 16.
Diagnósticos diferenciales
Las principales diferencias clínicas y radiológicas NMOSD (AQP4+, Anti MOG+), EM, EMDA se muestran en la Tabla 2.
La presentación clínica reversible en pocas horas o progresiva debe hacer sospechar otras etiologías (isquemia, infecciones virales, sarcoidosis o neoplasias).
Tratamiento
En los episodios agudos y recaídas, se recomienda como terapia de primera línea la metilprednisolona (30 mg/k/día por 5 días con máximo de 1000 mg). Si no se produce una mejoría significativa, se debe considerar la plasmaféresis (5-7 intercambios). Si no es accesible la plasmaféresis, se sugiere la inmunoglobulina intravenosa. En caso de respuesta deficiente, puede repetirse metilprednisolona que incrementa la eficacia de la plasmaferésis 2.
El mantenimiento de corticoides o descenso gradual durante 2 a 6 meses dependerá de resultados serológicos y de tratarse de un primer episodio o exacerbaciones 3-6, 14, 17, 18.
Cada vez hay más pruebas que la terapia inmunosupresora es esencial para reducir la actividad de la enfermedad y evitar nuevos ataques, sin embargo, las recomendaciones se basan en trabajos observacionales y opiniones de expertos. Hay controversias sobre si el plan terapéutico de mantenimiento debe ser igual en formas seropositivas y seronegativas. Existe consenso en iniciar tratamiento preventivo en un primer episodio con AQP4 (+) o en formas recurrentes seronegativas o anti MOG (+). En estas formas se mantiene corticoides (1 mg/k/día) asociado a azatioprina o micofenolato de mofetilo, con reducción gradual de la dosis de corticoides luego de los 3-6 meses 4, 6, 15.
La azatioprina a dosis de 2-3 mg/k/día reduce la frecuencia de ataques, sus efectos comienzan luego de los 6 meses por lo que es imprescindible asociar durante estos primeros meses dosis bajas de corticoides 4, 6, 17, 18.
El micofenolato mofetilo se recomienda a dosis divida de 2 a 3 g/día, su efecto terapéutico sobre la supresión de la médula ósea debe controlarse midiendo el recuento absoluto de linfocitos que se evidencia cuando desciende a menos de 1500/μl 4, 6, 15.
El rituximab también ha mostrado eficacia y puede realizarse como tratamiento de primera o segunda línea
cuando no hay respuesta con bajas dosis de corticoides y azatioprina. La dosis recomendada es de 375 mg/m2 semanal durante 4 semanas y uego se repite cada 6 meses.
Este fue bien tolerado y redujo significativamente la tasa de recaída anual del NMOSD pediátrico 4, 6, 15.
Otras opciones menos utilizadas son ciclofosfamida, bajas dosis de prednisolona, mitoxantrona o nuevos
agentes terapéuticos antimonoclonales como eculizumab o tocilizumab 17,18.
Los fármacos utilizados en EM como interferones y esfingolimod no son eficaces en NMOSD y pueden agravar la enfermedad 6,12,15.
Evolución y pronóstico
El 80-90% de las NMOSD seropositiva para anti-AQP4 son formas recurrentes con importante grado de discapacidad en cada evento. Las recaídas pueden ocurrir dentro del primer año (60%) o primeros 3 años (90%), recomendando un período libre de 5 años para establecer si cumple criterios de forma monofásica 1,6,9.
Las formas monofásicas parecen ser más frecuentes en casos de AQP4 (-) o anti MOG (+), con menor grado de discapacidad y mejor pronóstico 2,7,16. En la serie de Lechner y col., sobre 295 niños con primer evento desmielinizante, entre un 15-20% cumplieron criterios NMOSD, predominando las formas seropositivas anti MOG 7.
Conflictos de intereses: Ninguno para declarar
Bibliografía
1. de Sèze J, Kremer L, Collongues N. Neuromyelitis optica spectrum disorder (NMOSD): A new concept. Rev Neurol (Paris) 2016; 172: 256-62.
2. Borisow N, Mori M, Kuwabara S, Scheel M, Paul F. Diagnosis and treatment of NMO spectrum disorder and
MOG-encephalomyelitis. Front Neurol 2018; 9: 888-903.
3. Dutra BG, José da Rocha A, Nunes RH, Martins Maia Júnior AC. Neuromyelitis optica spectrum disorders:
spectrum of MR imaging findings and their differential diagnosis. Radiographics 2018; 38: 662.
4. Whittam D, Wilson M, Hamid S, Keir G, Bhojak M, Jacob A. What’s new in neuromyelitis optica? A short review for the clinical neurologist. J Neurol 2017; 264: 2330-44.
5. Akaishi T, Nakashima I, Sato DK, Takahashi T, Fujihara K. Neuromyelitis optica spectrum disorders. Neuroimaging Clin N Am 2017; 27: 251-65.
6. Kim HJ, Paul F, Lana-Peixoto MA, et al. Guthy-Jackson Charitable Foundation NMO International Clinical Consortium & Biorepository. MRI characteristics of neuromyelitis optica spectrum disorder: an international update. Neurology 2015; 84: 1165-73.
7. Lechner C, Baumann M, Hennes EM, et al. Antibodies to MOG and AQP4 in children with neuromyelitis optica and limited forms of the disease. J Neurol Neurosurg Psychiatry 2016; 87: 897-905.
8. Baghbanian SM, Asgari N, Sahraian MA, Moghadasi AN. A comparison of pediatric and adult neuromyelitis optica spectrum disorders: A review of clinical manifestation, diagnosis, and treatment. J Neurol Sci 2018; 388: 222-31.
9. F. Pache, H. Zimmermann, J. Mikolajczak, MOG-IgG in NMO and related disorders: a multicenter study of 50 patients. Part 4: Afferent visual system damage after optic neuritis in MOG-IgG-seropositive versus AQP4-IgG-seropositive patients. J Neuroinflammation 2016; 13: 282-92.
10. Gombolay GY, Chitnis T. Pediatric neuromyelitis optica spectrum disorders. Curr Treat Options Neurol 2018; 20: 19-36.
11. Weinshenker BG, Wingerchuk DM. Neuromyelitis spectrum disorders. Mayo Clin Proc 2017; 92: 663-79.
12. Bennett JL. Finding NMO: the evolving diagnostic criteria of neuromyelitis optica. J Neuroophthalmol 2016; 36: 238-45.
13. Flanagan EP, Weinshenker BG, Krecke KN, et al. Short myelitis lesions in aquaporin-4-IgG-positive neuromyelitis optica spectrum disorders. JAMA Neurol 2015; 72: 81-7.
14. Tenembaum S, Chitnis T, Nakashima I, et al. Neuromyelitis optica spectrum disorders in children and adolescents. Neurology 2016; 87: 59-66.
15. Wingerchuk DM, Banwell B, Bennett JL, et al. International Panel for NMO Diagnosis. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85: 177-89.
16. Hennes EM, Baumann M, Schanda K, et al. Prognostic relevance of MOG antibodies in children with an acquired demyelinating syndrome. Neurology 2017; 89: 900-8.
17. Collongues N, Ayme-Dietrich E, Monassier L, de Seze J. Pharmacotherapy for neuromyelitis optica spectrum disorders: current management and future options. Drugs 2019; 79: 125-42.
18. Bruscolini A, Sacchetti M, La Cava M, et al. Diagnosis and management of neuromyelitis optica spectrum disorders – An update. Autoimmun Rev 2018; 17: 195-200.
