JUAN J. CIRIO 1, CELINA CIARDI 1, JOSÉ F. VILA 1, MARIANO D. BUEZAS 1, ESTEBAN SCRIVANO 2, JORGE P. CHUDYK-HUBERUK 2, PABLO DILUCA 3, CARLOS INGINO 4, PEDRO LYLYK 2
1 Unidad de ACV, 2 Servicio de Neurorradiología Intervencionista-ENERI, 3 Servicio de Diagnóstico por Imágenes, 4 Servicio de Cardiología, Clínica La Sagrada Familia, Buenos Aires, Argentina
Resumen La terapia endovascular (TEV) es el tratamiento estándar del ataque cerebrovascular isquémico (ACVi) con oclusión de gran vaso (OGVC). Aún no se conoce si esos resultados pueden generalizarse a la práctica diaria. Se describen los resultados de la TEV en pacientes con ACVi por OGVC dentro de las 24 horas, en un análisis retrospectivo entre enero 2013 y diciembre 2017 que incluyó 139 casos consecutivos con ACVi y OGVC en arteria cerebral media (ACM), hasta 24 horas del inicio de los síntomas, que recibieron TEV en nuestra institución. El resultado primario medido fue la escala de Rankin modificada (mRS) ≤ 2 a 90 días. Se evaluaron también: reperfusión exitosa, según la escala modificada de trombólisis en infarto cerebral (mTICI) 2b/3, hemorragia intracraneal sintomática (HIS) y mortalidad a 90 días. La edad media: 67.5 ± 15.0, siendo el 51.8% mujeres. La mediana basal de National Institute of Health Stroke Scale (NIHSS) fue 14 (IIC 8-18); la mediana del tiempo desde inicio de síntomas hasta punción inguinal: 331 min (IIC 212-503). El 45.3%, 63 pacientes, fueron tratados > 6 horas después del inicio de síntomas. La tasa de mRS ≤ 2 fue 47.5%. Se logró una reperfusión exitosa en el 74.8%. La tasa de mortalidad a 90 días fue del 18.7% y la HIS del 7.9%. Nuestro registro de pacientes de la vida real con ACVi por OGVC tratados con TEV dentro de las 24 horas mostró altas tasas de reperfusión, buenos resultados funcionales y pocas complicaciones, acorde con las recomendaciones internacionales.
Palabras clave: accidente cerebrovascular, tratamiento del ACV agudo, tratamiento endovascular, trombectomía mecánica, terapia endovascular, trombectomía
Abstract Endovascular treatment (EVT) has become the standard of care for acute ischemic stroke (AIS) with proximal large vessel occlusions (LVO). However, it is still unknown whether these results can be generalized to clinical practice. We aimed to perform a retrospective review of patients who received EVT up to 24 hours, and to assess safety and efficacy in everyday clinical practice. We performed a retrospective analysis, from January 2013 to December 2017, on 139 consecutive patients with AIS for anterior circulation LVO strokes up to 24 h from symptoms onset, who received EVT in our institution. The primary outcome measured was a modified Rankin scale (mRS) ≤ 2 at 90 days. Secondary outcomes included successful reperfusion, defined as a modified Thrombolysis in Cerebral Infarction (mTICI) scale 2b/3, mortality rate at 90 days and symptomatic intracranial hemorrhage (sICH). The mean age was 67.5 ± 15.0, with 51.8% female patients. Median baseline National Institute of Health Stroke Scale (NIHSS) was 14 (IQR 8-18); median time from symptom onset to groin puncture was 331 min (IQR 212-503). Sixty-three patients (45.3%) were treated beyond 6 hours after symptoms onset. The rate of mRS ≤ 2 was 47.5%. Successful reperfusion was achieved in 74.8 %. Mortality rate at 90 days was 18.7 % and sICH was 7.9 %. Our registry of real-life patients with AIS due to LVO who received EVT within 24 hours showed high reperfusion rates, and good functional results with few complications, according to international recommendations.
Key words: stroke, acute stroke treatment, endovascular treatment, mechanical thrombectomy, endovascular therapy, thrombectomy
Dirección postal: Juan J. Cirio, Clínica La Sagrada Familia, José Hernández 1642, 1426 Buenos Aires, Argentina
e-mail: jjcirio@gmail.com
La trombectomía mecánica (TM) precedida de trombolisis intravenosa con activador tisular del plasminógeno recombinante (rtPA IV), es recomendada para el tratamiento del ataque cerebrovascular isquémico (ACVi) por oclusión del gran vaso (OGVC) 1,2 de la circulación anterior, hasta las 6 h de evolución 3-7.
Los estudios DAWN8 y DEFUSE 39 demostraron que la TM también es factible y efectiva en pacientes con ACVi con más de 6 h y hasta 24 h de evolución, según reúnan criterios de selección clínicos y estudios por imágenes específicos.
En la reperfusión arterial de la OGVC, la TM aplicada en el menor tiempo de evolución se relaciona directamente con mejores resultados, siendo determinante para que esto ocurra, una adecuada organización validada por los tiempos asistenciales. Por este motivo, la organización de la TEV del ACVi es una de las funciones multidisciplinarias más complejas que una institución médica elige realizar.
Nuestro objetivo es presentar los resultados del registro de pacientes con diagnóstico de ACVi por OGVC del territorio anterior, tratados con TEV en un centro integral de ACV de la ciudad de Buenos Aires, fuera del contexto de un ensayo clínico.
Materiales y métodos
Se analizaron en forma retrospectiva datos recolectados prospectivamente (estudio ambispectivo) de nuestra base de datos de pacientes ingresados en forma consecutiva por ACVi, secundario a la OGVC del territorio anterior, ya sea de la arteria carótida interna (ACI) o segmentos M1 o M2 de la arteria cerebral media (ACM), que fueron sometidos a TEV, en un único centro de la ciudad de Buenos Aires, Argentina.
Se analizaron los datos demográficos (edad, sexo, factores de riesgo cardiovascular y ACV previo), junto con las métricas temporales asistenciales y el déficit neurológico agudo, cuantificado con la National Institute of Health Stroke Scale (NIHSS) 10. En la imagen diagnóstica de ingreso, tomografía computarizada (TC) o resonancia magnética (RM), se descartó la presencia de hemorragia, se evaluó la arteria comprometida, la magnitud de la isquemia en TC/RM con la escala del Alberta Stroke Program Early CT score (ASPECTS), y el volumen del núcleo (core) isquémico (Vcore-I) en RM (medido en forma manual en la secuencia de imágenes ponderadas por difusión (DWI, por Diffusion-Weighted Imaging). El grado de reperfusión alcanzado con la TEV fue clasificado con la Modified Thrombolysis in Cerebral Infarction Score (mTICI) 11, y se consideró reperfusión exitosa al grado 2b o 3. Se consideró hemorragia intracraneal sintomática (HIS) de acuerdo con la definición del estudio ECASS III (hemorragias que aumentan al menos 4 puntos del basal en la escala de NIHSS o su valor más bajo, o que generan la muerte durante los primeros 7 días) 12.
La eficacia del tratamiento se valoró a los 90 días por la medición de la capacidad funcional del paciente con la mRS 13 donde el puntaje de 0 significa sin discapacidad, 1-2 significa mínima discapacidad, pero paciente auto válido; entre 3-5 corresponden a una discapacidad moderada a grave, y 6 a muerte. Se consideró buen resultado funcional al score ≤ 2.
Se compararon los resultados a 90 días obtenidos en la mRS ≤ 2, en los pacientes tratados antes y después de las 6 h y en aquellos con tiempo de inicio conocido (InC) vs. incierto (InI).
Las métricas asistenciales, se refieren a la hora de inicio de los síntomas, considerándola como la hora en que el paciente fue visto por última vez asintomático (UHA) y a su llegada a la institución, “tiempo puerta”, registrando los intervalos de interés se conforman las métricas diagnósticas y terapéuticas. El tiempo al trombo se considera el tiempo de primer contacto con el trombo del stent retriever o a la liberación intraarterial superselectiva del activador de plasminógeno de tejido recombinante (rtPA).
Se utilizó estadística descriptiva para presentar los datos mediante media, desvío estándar y mediana con intervalo inter cuartil (IIC), o la distribución de frecuencia, según correspondiera.
El análisis univariado se realizó mediante la prueba t de Student para variables continuas y Chi cuadrado o prueba exacta de Fisher (tamaño de celdas pequeñas) para variables binarias. El nivel de significación estadística se estableció en 0.05 y se utilizaron medidas de asociación con OR e IC de 95%. Se utilizó para el análisis estadístico el software SPSS (23.0.0.0., SPSS Inc., Chicago, IL).
Esta investigación fue aprobada por el Comité de Ética.
Todos los pacientes o sus representantes legales firmaron al ingreso un consentimiento informado autorizando la TEV, la inclusión de la información en una base de datos y su publicación en forma anónima.
Resultados
Entre enero de 2013 y diciembre de 2017 se registraron 699 pacientes con eventos cerebrovasculares isquémicos, de los cuales 173 correspondieron a ataques isquémicos transitorios y 526 a ACVi, de los cuales 139 correspondieron a la población en estudio por presentar ACVi con OGVC del territorio anterior, ya sea ACI, o segmentos M1 o M2 de la ACM, tratados por vía endovascular.
En la Tabla 1 se presentan los datos demográficos así como distintas variables clínicas de interés. La edad media de dicha población fue de 67.5 ± 15.0 años (media y desvío estándar), siendo mujeres el 51.8%. La mediana en la escala de NIHSS de ingreso fue de 14 (IIC 8-18) (Tabla 1) y la mediana del tiempo entre el inicio del ACV hasta el ingreso a la institución fue de 255 minutos (IIC 120-415). Ingresaron con más de 6 h de evolución 45 pacientes (32.4%). La punción inguinal se realizó luego de las 6 h del inicio de los síntomas en 63 (45.3%). La hora de InI se observó en 42 (30.2%) de los cuales 28 (20.1%) correspondieron a un ACVi del despertar. La mediana entre la hora de inicio y la punción arterial de los 97 pacientes con hora de InC fue de 273 minutos (IIC 200-383) y de los 42 con InI fue de 564 minutos (IIC 430-675) (Tabla 2).
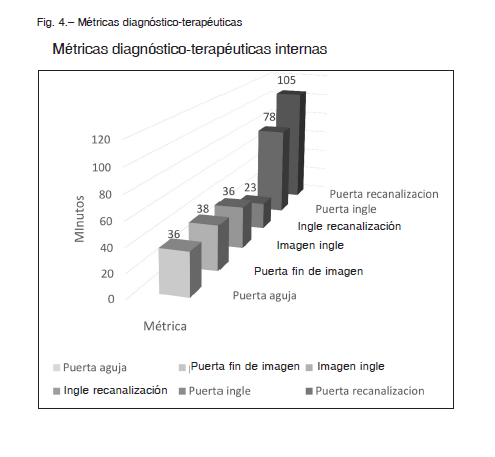
Respecto a las métricas internas, el intervalo de tiempo puerta-aguja intravenosa presentó una mediana de 36 minutos (IIC 23-45); puerta-ingle 78 minutos (IIC 58-116); ingle-trombo 23 minutos (IIC 15-34) y puerta-trombo 105 minutos (IIC 79-156) (Tabla 2).
Con respecto al Vcore-I, en los pacientes estudiados con RM fue de 19 ml (IIC 6-61). El ASPECTS en los 113 casos estudiados con RM presentó una mediana de 7 (IIC 5-8), y en los 26 casos estudiados con TC de 9 (IIC 8-9).
De los evaluados con RM, 34 (30.8%) presentaron un score de ASPECTS ≤ 5 con una mediana de Vcore-I de 83.5 ml (IIC57-133) mientras que 79 tuvieron un ASPECTS ≥ 6 con una mediana de Vcore-I de 10 ml (IIC 4-24).
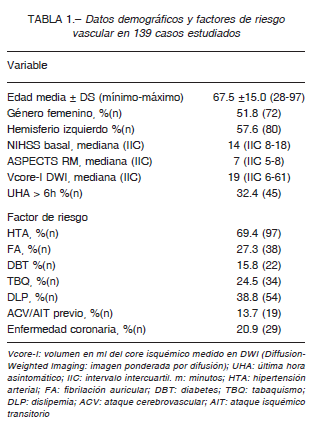
El vaso afectado correspondió en 66 (47.5%) al segmento M1, en 45 (32.4%) a la ACI+M1, y en 28 (20.1%) al
segmento M2 de la ACM (Fig. 1). El grado de reperfusión exitosa fue logrado en 104 (74.8%) pacientes (mTICI 2b-3). En 67 casos (48.2%) se administró rtPA ya sea por vía intravenosa (IV) o intra-arterial (IA), mientras que los 72 pacientes restantes (51.8%) fueron tratados solamente con TM.

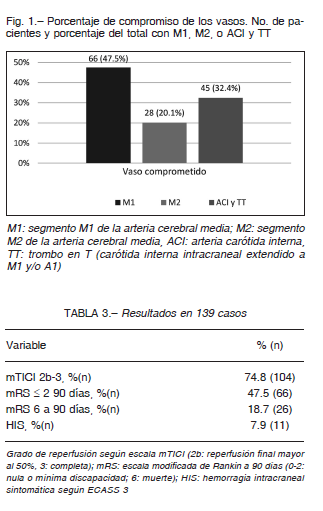
La HIS ocurrió en 11 pacientes (7.9%). A los 90 días 66 (47.5%) presentaron un score de mRS ≤ 2 (Tabla 3) y 26 (18.7%) de 6.
En la Figura 2 se aprecia la mRS a 90 días de la población general, de los cuales el 47.5% (66) obtuvo un score ≤ 2, mientras que en el 18.7% (26) fue de 6.
Los pacientes con InC obtuvieron un mRS ≤ 2 de 51.5% (50/97) y en el grupo InI fue de 40.5% (17/42), no hallándose diferencias significativas [p 0.31, OR 0.63 (IC 0.30-1.33)].
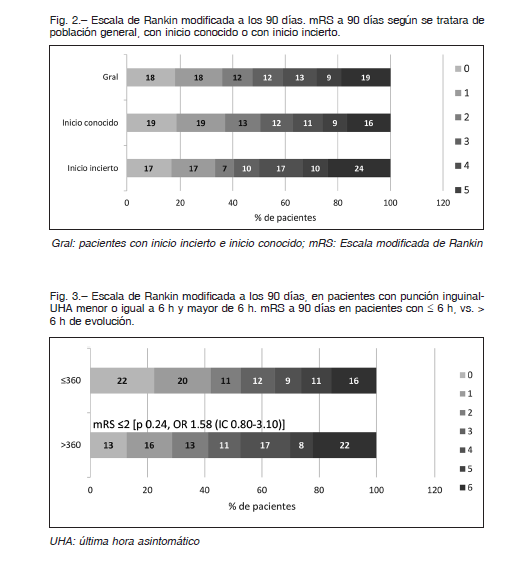
El resultado funcional varió según el tiempo inicio-ingle, en el grupo ≤ a 6 h (n: 76) la mRS ≤ a 2 fue del 53.9% (n: 41) de los casos y mRS 6 fue del 15.8% (n: 12); mientras que en aquellos con un tiempo mayor (n: 63) la mRS ≤ a 2 fue del 41.3% (n: 26) y mRS 6 en el 22.2% (n: 14) (Fig. 3). No se encontraron diferencias significativas entre ambos subgrupos de pacientes [mRS ≤ 2 p 0.24, OR 1.58 (IC 0.80-3.10)], y [mRS 6 p 0.45 OR 0.65 (IC 0.27-1.54)].
Discusión
El valor de presentar estos datos reside en la importancia de conocer si la TEV en nuestro país es viable y eficaz fuera del contexto de los ensayos clínicos.
El estudio RESILIENT recientemente demostró que dicha intervención es costo efectiva en Brasil 14 trabajando en centros primarios e integrales dentro del sistema público de salud que actúan en red y vinculados con telemedicina.
Las guías de recomendación terapéutica en ACVi son claras respecto a las indicaciones con grado de recomendación y evidencia I-A en pacientes mayores de 18 años, OGVC en territorio anterior (ACI o ACM M1), dentro de las 6 h, mRS previo ≤ 2, ASPECTS TC ≥ a 6 y NIHSS ≥ 61, 2.
Posteriormente, la ventana terapéutica se extendió de 6 h a 16 h (grado de recomendación I nivel de evidencia A), y hasta 24 h (grado de recomendación Ib) según los criterios de los estudios DEFUSE 39 y DAWN 8.
Por otro lado, los pacientes con ACVi, OGVC, ASPECTS bajos o Vcore-I elevados, mRS previos ≥ a 2 puntos, oclusiones de territorio posterior o ramas distales de ambos territorios, NIHSS < a 6 puntos, fueron excluidos de los ensayos clínicos, sin embargo, con un grado de recomendación menor (IIb) pueden ser tratados con buenas expectativas en casos cuidadosamente seleccionados 1.
Con respecto al intervalo desde la UHA hasta la punción inguinal la mediana para los 139 pacientes de nuestro registro fue de 331 minutos (IIC 212-503), en el metaanálisis SEER 15, que incluyo los ensayos SWIFT-PRIME, ESCAPE, EXTEND-IA y REVASCAT la mediana de UHA-ingle fue 225 minutos (IIC 157-302) y en el registro STRATIS 16, de 208 minutos (IIC 150-293).
En nuestro registro el tiempo entre la UHA y la punción arterial fue en 63 pacientes (45.3%) > a 6 h, de los cuales en 3 fue > a 24 h. En los registros combinados NASA-TRACK17, 271 pacientes (32.7%) se sometieron a TM después de las 6 h y 3 en más de 24 h.
Una proporción de pacientes que se presentan en la guardia tiene inicio de los síntomas incierto (InI), según registros internacionales la misma se aproxima al 25% 18,19.
Para evaluar la conformación de la población de nuestro registro de acuerdo con el tipo de inicio, ya sea InC o InI, la dividimos en 2 grupos, quedando así un grupo de InC de 97 (69.8%) y otro de InI de 42 (30.2%). La media correspondiente al intervalo inicio-ingle en el grupo InC fue 314 minutos (DE 215) y en el grupo InI de 648 minutos (DE 502). Si comparamos estos resultados con The German Stroke Registry Endovascular Treatment (GSRET) 20 los tiempos fueron 224 minutos (DE 176) para InC y 450 minutos (DE 287) para InI. Esa prolongación entre el comienzo de los síntomas y la punción inguinal se debe a la etapa prehospitalaria y no al tiempo puerta-ingle.
Con respecto a las métricas internas, estas requieren un monitoreo periódico para evaluar desvíos significativos en los tiempos recomendados 21,22. En la Figura 4 vemos la distribución de los tiempos utilizados desde el arribo a la institución hasta la recanalización (tiempo al trombo).
Las métricas de nuestro registro fueron las siguientes (medianas) puerta-aguja 36 minutos (IIC 23-45), puerta fin de imagen 38 minutos (IIC 26-53), puerta-ingle de 78 minutos (IIC 58-116), imagen-ingle 36 minutos (IIC 22-59), ingle-trombo 23 minutos (IIC 15-34), puerta-trombo 105 minutos (IIC 79-156). En los registros TRACK 23 y SEER 15 la mediana de puerta-fin de imagen fue 63 minutos, puerta-aguja 67 minutos, puerta-ingle 118 minutos y en el SEER 15 fueron puerta-aguja de 36 (IIC 24-54), puerta-ingle de 93 (IIC 69-127), imagen-ingle 63 (IIC 48-65). Como se puede observar, nuestros resultados se asemejan a los de otros registros.
El 81.3% (n: 113) de nuestros pacientes fueron inicialmente estudiados con RM, proporción superior al 18.9% (n: 306) del GSR-ET 20, la elección de RM permite disminuir los cuadros simuladores de ACV, sobre todo en pacientes candidatos a tratamiento con rtPA IV, sin perjuicio de demorar los tiempos puerta-aguja y puerta-ingle. El orden de las secuencias de RM exige un protocolo abreviado y específico para el ACVi. No se requiere concluir el estudio para comenzar con rtPA IV, ya que este puede iniciarse luego de las secuencias de GRE y DWI que descartan hemorragia y confirman la isquemia aguda, de tal manera que no aumenta el tiempo puerta-aguja (mediana 36 IIC 23-45); siendo en nuestro registro la mediana puertainterpretación de la imagen de 38 minutos (IIC 26-53).
La disponibilidad y el porcentaje de uso de RM muestran que es un estudio viable en ACVi hiperagudo y la mayoría de nuestros pacientes no requirieron sedación. La TC se utilizó como primer estudio en aquellos con contraindicación para RM.
En cuanto al Vcore-I y la escala de ASPECTS el ensayo MR CLEAN 3 no restringió la inclusión de pacientes según la escala, el estudio ESCAPE5 requería un ASPECTS entre 6-10 puntos, el REVASCAT 7 de 7-10 puntos para TC y 6-10 puntos para RM, el SWIFT-PRIME 6 utilizo un ASPECTS para TC de 6-10 puntos y un Vcore-I máximo de 50 ml y en el EXTEND-IA 4 el Vcore-I debía ser menor a 70 ml; en estos dos últimos estudios el Vcore-I fue medido con el software RAPID 23.
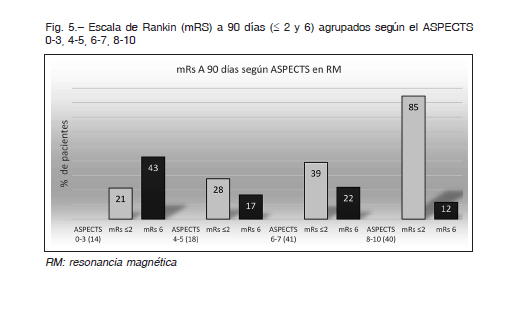
El Vcore-I, en nuestros pacientes, mostró una mediana de 19 ml (IIC de 6-61), siendo mayor que en los estudios de ventana extendida como el DAWN8 7.6 ml (IIC 2-18) y DEFUSE 39 9.4 ml (IIC 2-26), como en los estudios de hasta 6 h SWIFT-PRIME 6 17.2 ml y EXTEND-IA 4 con una mediana de 12 ml (IIC 4-32). El fundamento de tratar con gran Vcore-I o ASPECTS < 6 está sustentado en que este subgrupo de pacientes si no es reperfundido tiene riesgo demostrado de aumento del Vcore-I a las 24 h, lo que significa la existencia de una penumbra viable y por lo tanto una posibilidad de reperfusión en agudo 25,26. En la Figura 5 se puede apreciar la evolución funcional a 90 días de acuerdo con diferentes subgrupos de la escala de ASPECTS en RM, de nuestra población.
El grado de reperfusión mTICI 2b-3 en el metaanálisis del HERMES 27 fue de 71.0% (402/570), en el TRACK23 de 80.3% (505/629), en el análisis de los registros NASATRACK 17 juntos fue de 77.3% (642/830); este alto grado de reperfusión observado tanto en los ensayos como en los registros, superior al obtenido en el IMS III28 39.6% (126/318) o MR RESCUE29 25%, se relaciona con la incorporación de los nuevos stent retrievers para la TM.
En nuestro registro el grado de reperfusión exitosa mTICI 2b-3 fue del 74.8% (104/139).
Con respecto al pronóstico funcional a 90 días (Tabla 3), nuestro registro observó una escala mRS ≤ 2
puntos en el 47.5% (66/139), en el NASA-TRACK 17 fue de 47.8%, en el análisis que realiza Vidale et al 30 sobre un pool de pacientes tratados luego de las 6 h en los ensayos DAWN, DEFUSE 3, ESCAPE y REVASCAT fue de 46.4%, en el estudio DAWN 48.6% (52/107), el DEFUSE 3 fue de 44.6% (41/92) y en el SEER fue del 54%, siendo en este último la gran mayoría tratados antes de las 6 h.
En nuestro registro, si bien se observa un beneficio en la obtención de un mayor porcentaje en el score ≤ a 2 en la mRS entre los tratados antes o después de las 6 h, esta diferencia no fue significativa [p 0.24, OR 1.58 (IC 0.80-3.10)]. Estos hallazgos refuerzan el concepto de que el beneficio clínico si bien se extiende en ventanas al menos de hasta 24 h, el mismo se relaciona directamente con la precocidad de la reperfusión, dado que la probabilidad de presencia de penumbra decae con el tiempo.
La tasa de HIS (Tabla 3) en nuestro registro fue de 7.9% (11/139), en el análisis NASA-TRACK 17 8.8% (72/818), en el DAWN 8 5.6% (6/107), DEFUSE 39 6.5% (7/92), no observando diferencias significativas (p 0.71); este valor si bien está dentro de lo esperado (menor al 10%) es mayor si lo comparamos con los metaanálisis que no incluyeron pacientes con ASPECTS ≤ 5 como el SEER15 (SWIFT PRIME, ESCAPE, EXTEND-IA, REVASCAT) que presenta un 2.5% (10), o el HERMES 27 4.4 %.
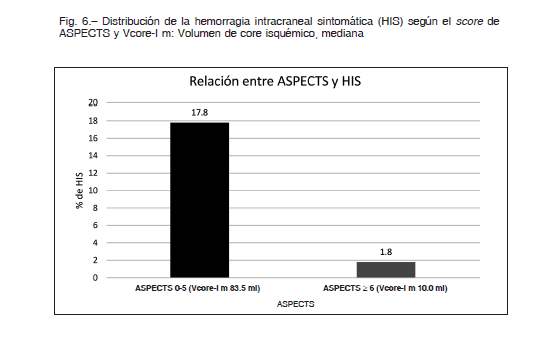
Al analizar los pacientes con ASPECTS menor o mayor a 6 nosotros observamos un descenso de la HIS de 17.8% a 1.8% respectivamente (Fig. 6). El MR CLEAN3 informó un 7.7% de HIS similar al nuestro al no restringir el tratamiento en los pacientes con ASPECTS bajos.
La mortalidad en nuestra población fue de 18.7 %, en el HERMES 27 fue del 15.3%, en el SEER 15 del 12% y en el registro TRACK 23 de 19.8% y en TRACK no AHA/ASA 23 de 22.2%. Cabe mencionar que nuestra mortalidad incluye pacientes tratados sin restricción del Vcore-I ni del ASPECTS (grandes volúmenes de isquemia), con ventanas prolongadas y sin restricción de edad máxima.
Si bien estos resultados pueden no ser comparables, porque tienen diferentes Vcore-I y tiempos de evolución; excepto el HERMES todos provienen de registros de pacientes de la vida diaria y no de ensayos clínicos.
Como limitación de nuestro estudio encontramos principalmente que los mismos corresponden a un registro
unicéntrico, carece de un grupo control y a la naturaleza retrospectiva del análisis. Al ser una población de la vida real y los criterios para la decisión terapéutica han evolucionado durante el período en estudio, no existió una unanimidad a lo largo del mismo para decidir qué pacientes debían incluirse o no al tratamiento. Como fortaleza, es el primer registro de pacientes con ACVi tratados con TEV presentado en nuestro país, lo que puede fomentar la creación de un registro multicéntrico.
A diferencia de los registros publicados recientemente, el nuestro recopila información de ACVi consecutivos no limitados a subgrupos de pacientes tratados con dispositivos específicos. Los datos obtenidos muestran que la evidencia de los ensayos clínicos hasta las 6 h y aun en ventanas extendidas, son viables en la práctica diaria siempre y cuando se trabaje bajo las normas de un centro integral de ACV, respetando las métricas diagnóstico-terapéuticas. La TEV presentó tasas altas de recanalización y buenos resultados funcionales con pocas complicaciones en pacientes con ACVi con OGVC de ACM dentro de las 24 h. No encontramos diferencias significativas en los pacientes tratados ya sea con tiempo inicio-ingle menor vs. mayor a 6 h o en aquellos con tiempo de inicio conocido vs. incierto.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Powers WJ, Rabinstein AA, Ackerson T, et al. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association / American Stroke Association. Stroke 2018; 49: e46-110.
2. Pigretti SG, Alet MJ, Mamamni CE, et al. Consenso sobre accidente cerebrovascular isquémico agudo. Medicina (B Aires) 2019; 79 (Supl. II): 1-46
3. Berkhemer OA, Fransen PS, Beumer D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015; 372: 11-20.
4. Campbell BC, Mitchell PJ, Kleinig TJ, et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Eng J Med 2015; 372: 1009-18.
5. Goyal M, Demchuk AM, Menon BK, et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372: 1019-30. 6. Saver JL, Goyal M, Bonafe A, et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015; 372: 2285-95.
7. Jovin TG, Chamorro A, Cobo E, et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015; 372: 2296-306.
8. Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018; 378: 11-21.
9. Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018; 378: 708-18.
10. Brott T, Adams HP, Olinger CP, et al. Measurements of acute cerebral infarction: a clinical examination scale. Stroke 1989; 20: 864-70.
11. Yoo AJ, Simonsen CZ, Prabhakaran S, et al. Refining angiographic biomarkers of revascularization improving outcome prediction after intra-arterial therapy. Stroke 2013; 44: 2509-12.
12. Hacke W, Kaste M, Bluhmki E, et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359: 1317-29.
13. Bonita R, Beaglehole R. Modification of Rankin Scale: Recovery of motor function after stroke. Stroke1988; 19:1497-500.
14. Martins S, Mont’Alvern F, Pontes-Neto O, et al. Randomization of endovascular treatment with stent-retriever and/or thromboaspiration vs. best medical therapy in acute ischemic stroke due to large vessel occlusion trial (resilient): final results. Eur Stroke J 2019; 4 (1 Suppl): 779-89.
15. Campbell BC, Hill MD, Rubiera M, et al. Safety and efficacy of solitaire stent thrombectomy: individual patient data meta-analysis of randomized trials. Stroke 2016; 47: 798-806.
16. Mueller-Kronast NH, Zaidat OO, Froehler MT, et al. Systematic evaluation of patients treated with neurothrombectomy devices for acute ischemic stroke primary results of the STRATIS registry. Stroke 2017; 48: 2760-8.
17. Mokin M, Abou-Chebl A, Castonguay AC, et al. Real-world stent retriever thrombectomy for acute ischemic stroke beyond 6 hours of onset: analysis of the NASA and TRACK registries. J Neurointerv Surg 2019; 11: 334-7.
18. Mackey J, Kleindorfer D, Sucharew H, et al. Populationbased study of wake-up strokes. Neurology 2011; 76: 1662-7.
19. Serena J, Dávalos A, Segura T, Mostacero E, Castillo J. Stroke on awakening: looking for a more rational management. Cerebrovasc Dis 2003; 16: 128-33.
20. Alegiani AC, Dorn F, Herzberg M, et al. Systematic evaluation of stroke thrombectomy in clinical practice: The German Stroke Registry Endovascular Treatment. Int J Stroke 2019; 14: 372-80.
21. Sacks D, Black CM, Cognard C, et al. Multisociety consensus quality improvement guidelines for intraarterial catheter-directed treatment of acute ischemic stroke, from the American Society of Neuroradiology, Canadian Interventional Radiology Association, Cardiovascular and Interventional Radiological Society of Europe, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of NeuroInterventional Surgery, European Society of Minimally Invasive Neurological Therapy, and Society of Vascular and Interventional Neurology. Catheter Cardiovasc Interv 2013; 8: E52-68.
22. Fiehler J, Cognard C, Gallitelli M, et al. European recommendations on organisation of interventional care in acute stroke (EROICAS). Eur Stroke J 2016; 1: 155-70.
23. Zaidat OO, Castonguay AC, Nogueira RG, et al. TREVO stent-retriever mechanical thrombectomy for acute ischemic stroke secondary to large vessel occlusion registry. J NeuroIntervent Surg 2018; 10:516-24.
24. Lansberg MG, Straka M, Kemp S, et al. MRI profile and response to endovascular reperfusion after stroke (DEFUSE 2): a prospective cohort study. Lancet Neurol 2012; 11: 860-7.
25. Rebello LC, Bouslama M, Haussen DC, et al. Endovascular treatment for patients with acute stroke who have a large ischemic core and large mismatch imaging profile. JAMA Neurol 2017; 74: 34-40.
26. Tisserand M, Turc G, Charron S, et al. Does diffusion lesion volume above 70 mL preclude favorable outcome despite post-thrombolysis recanalization? Stroke 2016; 47: 1005-11.
27. Goyal M, Menon BK, van Zwam WH, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta- analysis of individual patient data from five randomised trials. Lancet 2016; 387: 1723-31.
28. Broderick JP, Palesch YY, Demchuk AM, et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke. N Engl J Med 2013; 368: 893-903.
29. Kidwell CS, Jahan R, Gornbein J, et al. A trial of imaging selection and endovascular treatment for ischemic stroke. N Engl J Med 2013; 368: 914-23.
30. Vidale S, Longoni M, Valvassori L, Agostoni E. Mechanical thrombectomy in strokes with large-vessel occlusion beyond 6 hours: a pooled analysis of randomized trials. J Clin Neurol 2018; 14: 407-12.
