SEBASTIÁN GARCÍA-ZAMORA 1, MARÍA INÉS SOSA LIPRANDI 1, JOSÉ M. PICCO 1, MARÍA GABRIELA MATTA 1, RICARDO VILLARREAL 1, LAURA PULIDO 2, DANIEL STECHER 3, CLAUDIO MORÓS 1, MIRIAM ROZENEK PISTERMAN 3, VALERIA BARONE 1, MARISA PACHECO OTERO 1, PABLO MERLO 1, SEBASTIÁN GHIBAUDO 1, LUDMILA MORCOS 4, MARIEL CALABRÓ 3, JAVIER MARIANI 1, CARLOS M. LUNA 2, FRANCISCO NACINOVICH 3
1 Sociedad Argentina de Cardiología, 2 Asociación Argentina de Medicina Respiratoria, 3 Sociedad Argentina de Infectología, 4 Consejo Argentino de Residentes de Cardiología
Resumen Las enfermedades cardiovasculares ocupan la primera causa de muerte en la mayoría de las regiones del mundo, seguidas habitualmente por las enfermedades infecciosas. Desde hace décadas se conoce que las infecciones en general, y particularmente las que involucran el aparato respiratorio, se vinculan con un incremento en el riesgo de eventos cardiovasculares y cerebrovasculares, y su consecuente morbimortalidad. Si bien las vacunas constituyen una excelente estrategia en la prevención de enfermedades infectocontagiosas, la proporción de adultos inmunizados en nuestro país es francamente deficitaria. Múltiples barreras contribuyen a perpetuar esta problemática, dentro de las cuales la falta de prescripción de las mismas por parte de los profesionales que atienden a poblaciones vulnerables ocupa un lugar central. Los pacientes con enfermedades cardiovasculares representan una subpoblación de particular riesgo. El espectro de enfermedades que pueden originar las infecciones respiratorias es amplio: desarrollo o empeoramiento de insuficiencia cardíaca, arritmias, síndromes coronarios agudos y enfermedades cerebrovasculares, entre los principales. Se aborda aquí el rol de la inmunoprofilaxis con vacuna antigripal, antineumocócica y antitetánica en pacientes con diferentes cardiopatías, valorando la evidencia que respalda su empleo y haciendo especial hincapié en aspectos prácticos de su utilización, como efectos adversos, contraindicaciones y situaciones especiales de atención: cardiopatías congénitas del adulto, trasplante cardíaco, individuos anticoagulados o con alergia al huevo. Así, este documento tiene como objetivo asistir en la toma de decisiones a cualquier médico involucrado en el cuidado de pacientes con enfermedad cardiovascular.
Palabras clave: vacunas, influenza, neumococo, insuficiencia cardíaca, infarto de miocardio, prevención cardiovascular
Abstract Cardiovascular diseases are the leading cause of death in most regions of the world, usually followed by infectious diseases. For decades, infections in general, and particularly those involving the respiratory system, have been known to be associated with an increased risk of cardiovascular and cerebrovascular events, and their consequent morbidity and mortality. Although vaccines are an excellent strategy in the prevention of infectious diseases, the proportion of immunized adults in our country is frankly deficient. Multiple barriers contribute to perpetuating this problem, within which the lack of prescription of the same by professionals who care for vulnerable populations occupies a central place. Patients with cardiovascular disease represent a particularly risky subpopulation. The spectrum of pathologies that can trigger respiratory infections is wide: development or worsening of heart failure, arrhythmias, acute coronary syndromes and cerebrovascular diseases, among the main ones. The role of immunoprophylaxis with influenza, pneumococcal and tetanus vaccine in patients with different heart diseases is addressed here, evaluating the evidence supporting its use, and placing special emphasis on practical aspects of its use, such as adverse effects, contraindications and special care situations, such as congenital heart disease in adults, heart transplantation, anticoagulation or egg allergy. Thus, this document aims to assist in decision-making for any doctor involved in the care of patients with cardiovascular disease.
Key words: vaccines, influenza, pneumococcus, heart failure, myocardial infarction, cardiovascular prevention
Dirección postal: Sebastián García-Zamora, Azcuénaga 980, 1115 Buenos Aires, Argentina
e-mail: sebagz83@gmail.com
• La tasa de vacunación en adultos en Argentina es extremadamente baja, incluso entre sujetos de riesgo. Esto contrasta con otras medidas de prevención cardiovascular, que poseen una tasa de prescripción y adhesión mucho mayor.
• La vacunación contra neumococo e influenza en esta subpoblación de riesgo se traduce en reducción de infecciones por estos agentes, pero también disminuye la tasa de ocurrencia de síndromes coronarios agudos, el desarrollo o empeoramiento de insuficiencia cardíaca, la ocurrencia de arritmias, y podría tener un impacto beneficioso en la reducción de mortalidad cardiovascular. Incrementar su utilización resulta fundamental para alcanzar una prevención cardiovascular global integral.
Si bien las infecciones y los eventos cardiovasculares han sido las principales causas de muerte en adultos de todo el mundo desde hace siglos, recién en los últimos años se observó que existe una vinculación entre ambos 1,2.
Así, las infecciones en general y las respiratorias en particular, son capaces de precipitar la ocurrencia de eventos cardiovasculares mayores 1, 2.
Desde mediados de los años ’80 comenzó a vincularse la ocurrencia de eventos trombóticos agudos, tanto síndromes coronarios agudos (SCA) 3, 4 o accidentes cerebrovasculares (ACV) con el padecimiento de infecciones en general y especialmente aquellas relacionadas al tracto respiratorio. Las vacunas ocupan un lugar central dentro de la estrategia de prevención de infecciones respiratorias, especialmente en población vulnerable, ya que son capaces de interrumpir el ciclo de transmisión de las mismas. A pesar de disponer de uno de los programas de vacunación más completos del mundo, la cobertura vacunal en nuestro país dista de ser la adecuada. Según la 3° Encuesta Nacional de Factores de Riesgo 5 entre adultos con indicación de vacunación, solamente 51.6% habían sido inmunizados contra influenza, 16.2% contra neumococo, 49.8% para tétanos y 21.7% para hepatitis B. Asimismo, el 70.8% de los encuestados manifestó que las fuentes de información sobre vacunación habían sido los medios de comunicación y solo el 27.9% recibió esta información por parte del personal de la salud 6.
Los que padecen enfermedad cardiovascular frecuentemente deben ser sometidos a procedimientos invasivos, lo cual requiere una adecuada inmunización contra el tétanos. En la práctica cotidiana muchas veces esta intervención es subutilizada, sobreutilizada o implementada de forma errónea, con las implicancias que esto supone.
Debido a esto desde la Sociedad Argentina de Cardiología (SAC) se elaboró un Consenso de Inmunizaciones en pacientes con cardiopatías, con el objetivo de ayudar en la toma de decisiones a los médicos que los asisten. A tal fin se seleccionó la vacuna antigripal, antineumocócica y la doble bacteriana (contra el tétanos y difteria).
Metodología del consenso
Se conformó un equipo multidisciplinario con expertos de diferentes áreas temáticas: neumonólogos, infectólogos, clínicos, cardiólogos, equipo de enfermería y especialistas en epidemiología y metodología de la investigación.
Además, se incluyó a residentes de cardiología a través del Consejo Argentino de Residentes de Cardiología (CONAREC) como potenciales usuarios del Consenso.
Se realizó una búsqueda sistemática de estudios publicados en las bases de datos de MEDLINE/Pubmed, Embase/Elsevier, Cochrane library, Scielo y LILACS desde junio de 2001 a junio de 2019 inclusive. Se incluyeron estudios observacionales, serie de casos, casoscontroles, cohortes poblacionales, estudios aleatorizados controlados y no controlados, revisiones sistemáticas y meta-análisis. La graduación del nivel de evidencia utilizado para la formulación de las recomendaciones fue el siguiente:
* CLASE I: Existe evidencia y/o acuerdo general acerca de que un determinado procedimiento o tratamiento es beneficioso, útil y eficaz. “Se recomienda/está indicado”.
* CLASE II: Condiciones para las cuales existe evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del procedimiento o tratamiento.
– CLASE IIa: El peso de la evidencia/opinión está a favor de la utilidad/eficacia. “Se debe considerar”.
– CLASE IIb: La utilidad/eficacia está menos establecida por la evidencia/opinión. “Se puede considerar”.
* CLASE III: Existe evidencia o acuerdo general acerca de que el tratamiento no es útil ni eficaz y en algunos casos puede ser perjudicial. “No se recomienda”.
Los niveles de evidencia utilizados fueron los siguientes:
– A: Evidencia sólida, proveniente de ensayos clínicos múltiples aleatorizados o de metanálisis. Múltiples grupos de poblaciones en riesgo evaluados. Consistencia general en la dirección y magnitud del efecto.
– B: Datos procedentes de un solo ensayo clínico único aleatorizado o de grandes estudios no aleatorizados.
Limitados grupos de poblaciones en riesgo evaluadas.
– C: Consenso u opinión de expertos y/o estudios pequeños, estudios retrospectivos, registros.
El documento fue valorado por un grupo multidisciplinario de cinco expertos independientes, que oficiaron como revisores externos.
Con el título de: Consenso de Inmunizaciones en Pacientes con Cardiopatía – 2019, se encuentra disponible en la página de la Sociedad Argentina de Cardiología una versión detallada del mismo: https://www.sac.org.ar/wp-content/uploads/2019/11/consensovacunas-2019.pdf
Efecto de las infecciones respiratorias en la morbimortalidad cardiovascular
Las infecciones respiratorias y los SCA cumplen con la condición de estacionalidad, ya que se caracterizan por picos durante el período invernal7, 8. Hasta un tercio de los SCA están precedidos por síntomas respiratorios 2, 3, 9, 10.
Estudios retrospectivos bien diseñados hallaron un incremento en el riesgo de SCA de 2 a 3 veces dentro de las dos primeras semanas luego de una infección respiratoria aguda 1, 2, 9. Este riesgo es más elevado durante los primeros tres días luego de la infección y disminuye paulatinamente con el tiempo 1, 2.
Por su parte, las infecciones neumocócicas constituyen la primera causa de muerte a nivel mundial entre las debidas a enfermedades prevenibles por vacunas11. Si bien tiene tratamiento antibiótico específico, su letalidad no ha variado en los últimos 50 años.
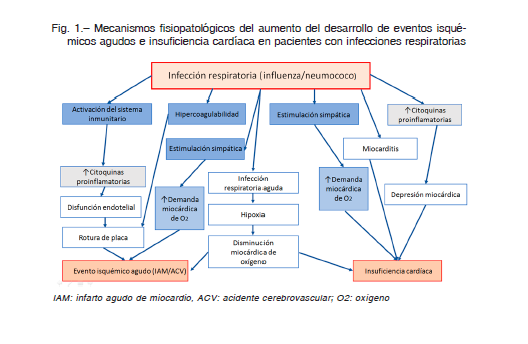
Los mecanismos subyacentes que desencadenan eventos cardiovasculares (CV) en pacientes con infecciones respiratorias son diversos e incluyen un incremento en la actividad inflamatoria sistémica y coronaria que genera condiciones protrombóticas, aumento del estrés biomecánico en las arterias coronarias, variaciones en el tono arterial, alteración de la homeostasis y del balance metabólico miocárdico 12 (Fig. 1).
Durante los meses de circulación del virus influenza (que en el hemisferio sur suele ocurrir entre los meses de junio y noviembre) se producen numerosas muertes y complicaciones cardiovasculares en poblaciones vulnerables.
La respuesta del huésped ante una infección aguda puede desencadenar o facilitar un evento CV debido a un proceso de inflamación generalizado, y también local, sobre el árbol coronario y las lesiones ateroscleróticas preexistentes 12,13.
Así, numerosas revisiones sistemáticas y metaanálisis de estudios epidemiológicos han confirmado la asociación entre infecciones respiratorias (ya sea cuadros de influenza o neumonía neumocócica) y la incidencia de infarto agudo de miocardio (IAM), ACV y muerte por evento CV 12-15.
Si bien la neumonía neumocócica tiene un patrón estacional similar al de la gripe, algunos datos locales en una ciudad de Argentina, sugieren que solo el 38% de las mismas ocurrió en la época invernal16. Asimismo, se ha postulado que la incorporación de la vacuna con las recomendaciones actuales, especialmente por los agentes incluidos en ella, ha determinado una disminución de las infecciones neumocócicas 17.
En lo que a insuficiencia cardíaca crónica (ICC) respecta, las infecciones respiratorias tienen una doble vinculación con esta entidad: por un lado son responsables de un número considerable de descompensaciones, las cuales se asocian a elevada morbimortalidad 18. Por otro lado, a medida que progresa la enfermedad, los individuos se vuelven más propensos a las infecciones 19.
Vacuna contra el virus de influenza
La vacunación antigripal debe ser oportuna; si bien idealmente se promueve su aplicación en la época otoñal (antes del comienzo del invierno, etapa de mayor circulación del virus influenza) los individuos de riesgo pueden recibirla en cualquier momento del año, siempre que esté circulando el virus de la gripe. La vacunación deberá continuar luego según las recomendaciones vigentes.
Esta vacuna ha demostrado ser efectiva para reducir los eventos isquémicos y el desarrollo/empeoramiento de ICC. Un metaanálisis de 5 estudios aleatorizados 20 encontró un 36% de reducción de riesgo relativo (RR) de eventos cardiovasculares mayores en aquellos pacientes con enfermedad coronaria que recibieron la vacuna antigripal, comparado con los controles (RR 0.64, IC95% 0.48 a 0.86, p = 0.003). Este efecto fue aún más evidente en aquellos con historia de SCA, con una reducción significativa del RR de eventos cardiovasculares mayores comparado con los pacientes con enfermedad coronaria estable (RR 0.45, IC95% 0.32 a 0.63, p < 0.01).
En cuanto a ICC, un registro inglés en 52 202 pacientes con ICC, seguidos entre los años 1990 y 2013, encontró que la vacuna para influenza se asoció con menor tasa de hospitalizaciones debidas a causas cardiovasculares (RR 0.73 IC95% 0.77 a 0.90, p < 0.05) con un efecto más modesto para hospitalización debida a infecciones respiratorias (RR 0.83 IC95% 0.77 a 0.90, p < 0.05) 21.
Esta observación se ha repetido en otros registros 22 y en estudios con diferentes diseños 23, 24.
Recomendaciones actuales de vacunación antigripal
Cualquier persona a partir de los 6 meses de vida puede recibir la vacuna antigripal; existen muchas indicaciones para esta vacuna, las cuales exceden las enfermedades cardiovasculares. Esquemáticamente se pueden dividir en 2:
* en los extremos de la vida:
– niños entre 6 y 24 meses de edad, o adultos mayores de 65 años, independientemente de que sean sanos y no posean comorbilidades.
* individuos con edades intermedias (entre 2 y 64 años) cuando posean al menos un factor de riesgo.
Los grupos considerados de riesgo son: con enfermedades cardiovasculares y respiratorias crónicas, inmunodeficiencias congénitas o adquiridas (tanto oncohematológicas como no), infección por el virus de la inmunodeficiencia humana (HIV), utilización de medicación inmunosupresora o corticoides en altas dosis (por más de 14 días), embarazadas en cualquier trimestre de la gestación y puérperas hasta el egreso de la maternidad (máximo 10 días), obesos con índice de masa corporal ≥ 40 kg/m2, diabéticos, con insuficiencia renal crónica en diálisis o con expectativas de ingresar a diálisis en los siguientes seis meses, figuran entre los principales 25.
Eventos adversos vinculados a la vacunación antigripal
Son poco frecuentes y ocurren en menos del 15% de los sujetos vacunados. En su mayoría son leves y pueden ser locales (como dolor, induración o eritema) o generales (principalmente fiebre, malestar y mialgia); resuelven en pocos días y generalmente no requieren conductas adicionales.
Vacuna antineumocócica
La enfermedad neumocócica posee una distribución bimodal, afectando principalmente a niños pequeños y adultos mayores: los primeros por inmadurez del sistema inmune y los segundos por el fenómeno de inmunosenescencia 26, además de las comorbilidades que suelen existir en este grupo etario.
La mayor evidencia respecto al efecto del uso de la vacuna proviene del ensayo clínico conocido con el acrónimo CAPiTA 27, el cual fue aleatorizado y doble ciego e incluyó 84 496 adultos mayores de 65 años a recibir vacuna conjugada 13-valente o placebo, con un seguimiento medio de 3.97 años. La vacuna se asoció a una reducción del riesgo de neumonía neumocócica (OR 0.55 IC95% 0.39 a 0.77, p = 0.0006), a infecciones de cualquier tipo por cepas de neumococo cubiertas por la vacuna y a infecciones invasivas por este agente causal (OR 0.48 IC95% 0.31 a 0.76, p = 0.002). Sin embargo, no pudo demostrarse cambios en la mortalidad total; desafortunadamente no se recabó el efecto de esta intervención sobre eventos cardiovasculares.
Recomendaciones actuales de vacunación antineumocócica
Al igual que para la vacuna contra la influenza existen múltiples entidades y comorbilidades que aumentan el riesgo de infección por neumococo, y que constituyen una indicación formal para la vacunación. Esquemáticamente podríamos resumir las indicaciones en forma similar a la vacunación contra influenza:
* en los extremos de la vida:
– niños menores de 2 años de edad, o adultos mayores de 65 años, independientemente de que sean sanos y no posean comorbilidades.
* individuos con edades intermedias (entre 5 y 64 años) cuando posean al menos un factor de riesgo.
Los grupos considerados de riesgo son: con enfermedades cardiovasculares y respiratorias crónicas, inmunodeficiencias congénitas o adquiridas (tanto oncohematológicas como no), infección por HIV, utilización de medicación inmunosupresora o corticoides en altas dosis (por más de 14 días), diabéticos, insuficiencia renal y hepática crónica, alcoholismo, antecedentes de enfermedad neumocócica invasiva, tabaquismo activo con al menos 15 paquetes/año o ex tabaquistas de al menos 10 paquetes/año, si abandonaron hace menos de 10 años28, 29, asplenia funcional o anatómica, implante coclear entre los principales 30, 31.
Vacunas disponibles y esquema de vacunación
Las vacunas antineumocócicas disponibles comercialmente en el país son de dos tipos:
– Vacuna polisacáridos de 23 serotipos (VPN23)
– Vacuna conjugada de 13 serotipos (VCN13)
Si bien hay diferencias en la inmunogenicidad de ambas vacunas, estudios han demostrado que la utilización de ambas es superior al empleo de cada uno por separado (en términos de inmunogenicidad) 32, 33. Sin embargo, no hay hasta la fecha estudios que hayan demostrado superioridad clínica en puntos finales34, aunque es lógico suponer que aportan beneficio a las poblaciones de riesgo.
Basado en esto, el esquema actualmente recomendado es administrar una 1a dosis de VCN13 27 y luego una 2a dosis de VPN23 con un intervalo mínimo de 12 meses luego de la primera. Las personas vacunadas antes de los 65 años (es decir, por factores de riesgo) deben recibir un refuerzo luego de cumplir 65 años, pero respetando intervalo mínimo de 5 años de la dosis anterior de VPN23.
Una excepción lo constituyen los pacientes trasplantados cardíacos (y otros inmunocomprometidos) en quienes se recomienda administrar VCN13 y luego una dosis de VPN23 al menos 8 semanas posterior a la primera. Posteriormente a ello se recomienda administrar una nueva dosis de VPN23 luego de 5 años y, en caso de haber recibido el refuerzo antes de los 65 años, administrar un nuevo refuerzo pasada dicha edad 35.
Eventos adversos vinculados a la vacunación antineumocócica
Ambas vacunas (VPN23 y VCN13) tienen un excelente perfil de seguridad y los eventos adversos vinculados a éstas son poco frecuentes. El evento más frecuente es la reactogenicidad local, que se observa en alrededor del 30% de los vacunados y no requiere conducta activa. El desarrollo de fiebre es muy raro y ocurre en menos del 1% de los individuos que reciben la vacunación.
Vacuna contra tétanos y difteria
El tétanos es una enfermedad bacteriana aguda causada por un bacilo Gram positivo: el Clostridium tetani36. Es un germen ubicuo y puede ingresar al organismo a través de heridas contaminadas con tierra, estiércol o metales oxidados. Estas heridas suelen ser triviales por lo que, en general, no motivan una consulta médica. No existe inmunidad natural o adquirida luego de una infección excepto a través de la vacunación.
El tétanos continúa siendo una importante causa de muerte en países en vías de desarrollo, pero es muy raro en países desarrollados debido a las políticas de vacunación. Así, la mortalidad en personas que nunca han sido vacunadas supera el 50%, especialmente en individuos de mayor edad. Las cirugías de mayor riesgo para tétanos postquirúrgico son las abdómino-pelvianas.
Indicaciones
El esquema inicial consta de 5 dosis en la infancia (junto a otras vacunas bacterianas) y refuerzos a partir de los 16 años de edad, cada 10 años como vacuna doble adultos (-dT-), la cual contiene un componente contra el Corynebacterium diphtheriae. Por tanto, y siempre que esté disponible, la indicación de vacuna antitetánica debe reemplazarse por dT para mantener controlada la difteria en nuestro país. Respecto a los pacientes con cardiopatías no hay evidencia que sugiera que debieran recibir un esquema diferente al de la población general.
En relación con la profilaxis prequirúrgica se recomienda la vacunación con dT al menos una semana antes del procedimiento, solo en aquellas personas que recibieron la última dosis hace más de 10 años 37. Esta práctica no está basadas en evidencia, ya que de por sí la mayoría de los procedimientos quirúrgicos aun en el ámbito de la urgencia son heridas “limpias” y con bajo riesgo para contraer tétanos. Por otra parte, la respuesta inmune con la aplicación de la vacuna se alcanza alrededor de los 10 días post intervención. Sin embargo, las tasas de vacunación en adultos en nuestro medio son bajas, lo cual ha motivado esta recomendación.
En personas con vacunación incompleta (menos de 3 dosis en la vida), deberá completarse este número de dosis, y luego continuar con los refuerzos habituales.
Algunos aspectos a recordar de esta vacuna son:
– La administración reciente o concomitante de gammaglobulina no afecta la respuesta inmunitaria.
– El intervalo interdosis mínimo es de 4 semanas.
– En el caso de heridas o cirugías sucias se debe ad-ministrar una nueva dosis cuando hayan transcurrido más de 5 años desde la última dosis. Sin embargo, esto no aplica a los procedimientos cardiovasculares, sean programados o de urgencia.
Inmunoglobulina humana antitetánica (gammaglobulina)
La única indicación actual para su empleo es el caso de un paciente que haya recibido menos de 3 dosis de vacuna antitetánica en su vida y que presente una herida potencialmente tetanígena. En nuestro país desde el año 1971 los niños reciben 3 dosis de vacuna antitetánica en los primeros 6 meses de vida y 2 dosis adicionales antes del ingreso escolar. Por tanto, resulta improbable que una persona adulta nacida luego de dicha fecha haya recibido menos de 3 dosis en su vida.
Eventos adversos de la vacuna dT
Son infrecuentes y leves (eritema, induración y dolor en sitio de aplicación, fiebre moderada y malestar). Con la administración repetida y excesiva se pueden observar reacciones locales mediadas por inmunocomplejos con activación del complemento (reacción de hipersensibilidad tipo III o tipo Arthus), motivo por el cual no se recomienda la vacunación indiscriminada en intervalos menores a los estipulados 38.
Aspectos prácticos de la administración de las vacunas
– Todas las vacunas recomendadas en el Consenso se pueden administrar simultáneamente y con otras vacunas, pero deben ser aplicadas en sitios diferentes, y con diferentes jeringas 39.
– Por compartir gran parte de las indicaciones, la vacuna antigripal y antineumocócica se deberían administrar simultáneamente para aumentar las tasas de cobertura
– Una reacción anafiláctica verdadera constituye una contraindicación absoluta para volver a recibir dicha vacuna.
En cambio, una reacción cutánea aislada no constituye una contraindicación para administrar cualquier vacuna.
La anafilaxia constituye una reacción alérgica grave, potencialmente mortal. Si bien su abordaje excede estas breves líneas, resulta importante destacar que una verdadera reacción anafiláctica debe presentar síntomas graves, entre ellos: dificultad respiratoria grave (principalmente por angioedema) y/o hipotensión grave y sostenida, las cuales habitualmente requieren una intervención farmacológica para su resolución 40.
Vacuna antigripal:
– La seroprotección se obtiene 2 a 3 semanas luego de su administración (debido a lo cual se recomienda administrar al comienzo del otoño).
– La inmunidad conferida por la vacuna es variable de acuerdo a cada individuo, pero suele durar de 6 a 12 meses.
– Se trata de una vacuna de agentes inactivados (muertos): esto implica que los virus no se replican en el organismo. Dado que la inmunidad provista por la vacuna tiene una duración menor a los 12 meses y que existen cambios anuales en la circulación viral y por ende en la composición de la vacuna, la misma debe repetirse anualmente.
Vacuna antineumocócica:
– En el caso que una persona adulta (mayor a 18 años) con indicación de vacunación secuencial contra neumococo haya recibido inicialmente una dosis de vacuna VPN23 deberá esperar al menos 12 meses para administrarle la vacuna conjugada (VCN13).
Contraindicaciones señaladas por el Consenso para ciertas vacunas
Las vacunas antigripal y antineumocócica se encuentran contraindicadas cuando existe el antecedente de reacción alérgica grave (anafilaxia) posterior a una dosis previa de la vacuna o frente a alguno de sus componentes (especialmente la proteína del huevo).
La vacuna contra influenza se contraindica también ante la historia de un síndrome de Guillain Barré que se haya presentado dentro de las seis semanas luego de haberla recibido, y habiéndose descartado otras causas del mismo.
La vacuna dT no posee contraindicaciones.
Se debe tener precaución ante enfermedades agudas graves con fiebre y postergar la vacunación hasta la resolución de la misma. Sin embargo, los cuadros agudos benignos, como rinitis, tos, catarro o diarrea NO requieren que se postergue la vacunación 25.
Vacunación en pacientes anticoagulados
Un importante número de pacientes con cardiopatías se encuentran anticoagulados, lo cual puede generar dudas respecto a la seguridad de aplicar las vacunas de forma intramuscular o subcutánea y suscitar la contraindicación de las mismas.
Desde hace más de dos décadas se dispone de estudios, de pequeño número, que sugieren que la administración de vacuna antigripal de forma intramuscular en personas anticoaguladas es segura 41.
En 2008 se publicó un ensayo clínico multicéntrico simple ciego 42 en cuatro centros de atención primaria en Barcelona, donde incluyeron 229 pacientes con indicación de vacunación, aleatorizados a aplicación intramuscular (n = 100) o subcutánea (n = 129). No se comunicaron eventos adversos mayores ni hemorragias entre los participantes de ninguno de los grupos. La única diferencia encontrada fue una mayor incidencia de lesiones cutáneas menores en el grupo de vacuna subcutánea a las 24 horas de la administración (37.4% versus 17.4% IC95% 8.2% a 31.8%, p < 0.05). Una explicación propuesta para esto es el menor grado de entrenamiento y empleo de esta vía en la práctica cotidiana. Por tanto, la evidencia disponible refuerza el concepto de que la vacunación antigripal es segura en personas anticoaguladas, en rango terapéutico. Además, parece razonable recomendar la vía intramuscular en la región deltoidea, a excepción de que el personal de salud que va a administrar la vacuna presente mayor experiencia y prefiera la vía subcutánea.
Un aspecto a considerar a la hora de elegir la vía de administración de las vacunas es que no todas las presentaciones intramusculares son iguales. Tanto la vacuna antineumocócica VCN13 como la VPN23 poseen agujas similares a la de las vacunas antigripales, aunque levemente mayores. Debido a ello podrían extrapolarse los resultados de éstas. En cambio la vacuna dT utiliza una aguja de mayor tamaño, por lo cual podría resultar más seguro utilizar la vía subcutánea, o suspender transitoriamente la anticoagulación, en caso de que se opte por la vía intramuscular. Respecto a las agujas a emplear, importa tanto su largo como el diámetro de las mismas, ya que a mayores dimensiones, mayor daño tisular. Otro aspecto a considerar es el volumen de solución a administrar: evidencia indirecta sugiere que menores volúmenes resultan más seguros.
Independientemente de los antes mencionado, algunos aspectos a considerar en pacientes anticoagulados son:
-corroborar que la persona se encuentre en rango terapéutico, preferentemente en su límite inferior
-realizar hemostasia más prolongada (compresión durante 2 minutos)
-revisar la indicación de anticoagulación (riesgo tromboembólico) y la historia de sangrados
Una mención especial merecen los anticoagulantes orales directos (AOD), rivaroxabán, apixaban y dabigatrán.
Al momento de elaborar el Consenso no encontramos evidencia directa que guíe su empleo 43; sin embargo, sus propiedades farmacocinéticas y farmacodinámicas sugieren que su manejo podría ser más sencillo que el de los antagonistas de la vitamina K ([AVK] acenocumarol y warfarina). Un registro alemán con 2179 participantes (76% de los cuales empleaban rivaroxaban) mostró que el empleo de heparina como puente se asoció a mayor riesgo de sangrado; en cambio la discontinuación transitoria de los AOD por escasos días no se asoció a mayores eventos embólicos ni de sangrado 44. Debido a esto, en personas en tratamiento con AOD con bajo riesgo de sangrado sería razonable manejar la vacunación de igual forma que ante el empleo de AVK. En cambio, en personas con alto riesgo de sangrado se podría omitir una o más dosis del fármaco y administrar la vacuna en el lapso entre dosis. Un aspecto importante es que la vida media de los AOD se prolonga con la disminución de la función renal, especialmente con dabigatrán.
Respecto al control del rango de anticoagulación en pacientes que utilizan AVK la evidencia sugiere que la aplicación de la vacuna antigripal 45 o la vacuna contra el neumococo 46 no produce alteraciones relevantes en este.
Vacunación en pacientes con cardiopatías congénitas del adulto
Los pacientes con cardiopatías congénitas del adulto constituyen una población heterogénea; estas personas no son curadas de su enfermedad a pesar de un tratamiento exitoso en la infancia, y casi todos presentan secuelas por su cardiopatía nativa o por los procedimientos realizados. Por este motivo, la mayoría pertenece al grupo de huéspedes especiales con alteraciones específicas y se engloban dentro del grupo de riesgo que debe vacunarse contra gripe y neumococo. Asimismo, constituyen un subgrupo más propenso a recibir intervenciones, debido a lo cual resulta crucial la vacunación doble adultos (dT).
Existen diferentes clasificaciones, tanto considerando la complejidad anatómica como “fisiológica” 47 de la cardiopatía.
Si bien no se han desarrollado estudios específicos en este subgrupo de pacientes, es razonable inferir que a mayor gravedad anatómica y funcional, mayor será el beneficio que otorgará la inmunización contra neumococo e influenza. Sin embargo, aun en cardiopatías congénitas simples con un estadio A de la clasificación fisiológica (capacidad de ejercicio normal, sin secuelas hemodinámicas ni anatómicas, sin historia de arritmias, ni alteraciones de otros órganos) pueden esperarse beneficios con la intervención, aunque el impacto real de la misma será considerablemente menor. Una excepción a esto lo constituyen el foramen oval permeable (presente en 20-25% de la población general) y el aneurisma del septum interauricular (presente en 2.5% de la población), ya que si bien suelen incluirse dentro de las cardiopatías congénitas simples, no tienen repercusiones hemodinámicas ni riesgo de progresión en el tiempo y su impacto se vincula al incremento del riesgo de ACV en personas jóvenes.
Distintas series han comunicado una importante subindicación de todas las vacunas en esta población 48, y que educar al paciente respecto a los beneficios de la vacunación y advertir sobre la posibilidad de eventuales efectos adversos, habitualmente leves y transitorios, puede mejorar la tasa de vacunación en las poblaciones vulnerables. Las pautas de administración en este grupo son idénticas a las recomendadas para otras subpoblaciones de riesgo.
Vacunación en pacientes con alergia al huevo
Tradicionalmente se ha postulado que la alergia al huevo era una contraindicación mayor para recibir algunas vacunas. Evidencia disponible actualmente sugiere que la mayoría de las personas pueden ser vacunadas, aun con alergia documentada al huevo.
Se estima que solo el 0.2% de los adultos (y 1.3% de los niños) son alérgicos al huevo, y una pequeña proporción de estos desarrollará una reacción alérgica grave ante la exposición a la vacuna. Un registro encontró 33 casos de anafilaxia confirmada luego de 25173965 dosis de vacuna antigripal (1.31 casos por cada millón de dosis) 49 con hallazgos similares en otras series. Del total de casos de anafilaxia, 25% (n = 8) se produjeron en los primeros 30 minutos, otro 25% (n = 8) entre los 30 y 120 minutos, mientras que los restantes casos se produjeron en las siguientes horas, con un único registro al día siguiente de la vacunación 49. Debido a esto, se recomienda 25,30,50 que:
-las personas con alergia al huevo que experimentaron solamente urticaria (u otras lesiones cutáneas) deberían recibir la vacuna, con mínimos recaudos -luego de la vacunación las personas con alergia al huevo (o fuerte sospecha de la misma) deberían permanecer en observación por al menos 30 minutos, sin necesidad de medidas adicionales (dosis separadas, aplicación en dos etapas o pruebas cutáneas).
-personas que han experimentado reacciones alérgicas importantes pero no anafilácticas (por ejemplo angioedema, vómitos recurrentes, mareos o malestar general) no representan una contraindicación para la vacuna, aunque deberían recibir la misma en centros con capacidad de asistir cuadros graves.
La vacuna antineumocócica no utiliza proteínas de huevo para su elaboración, por lo cual es segura su administración en personas con alergia a este alimento. Sin embargo, otras vacunas no abordadas en el Consenso contienen mayores proporciones de proteína de huevo (ejemplo vacuna contra la fiebre amarilla) y por tanto no deberían extrapolarse estas recomendaciones a otras vacunas.
En la Tabla 1 se resumen las recomendaciones del consenso.
En conclusión, existe clara asociación entre enfermedades respiratorias y eventos cardiovasculares, lo cual genera una grave morbimortalidad, bien desencadenando eventos o descompensando a individuos estables. Por otra parte, la evidencia sugiere que la incorporación de una práctica simple y segura como las vacunas, reducirá no solo las enfermedades que pretenden proteger, sino también el riesgo de eventos cardiovasculares en población vulnerable, traduciéndose ello en un mejor pronóstico individual y colectivo.
La falta de convicción de los médicos respecto a la utilidad de las vacunas ha sido reconocida como una de las principales causas de la pérdida de oportunidad de vacunación. Por tanto, identificar las barreras regionales que limitan este accionar permitirá trasladar las recomendaciones en acciones concretas. Esto constituye un desafío insoslayable para la comunidad médica en general, y para la cardiológica en particular, por tratarse de una especialidad que promueve principalmente prácticas preventivas.
Agradecimientos: Los autores agradecen a los Dres. Ricardo Rüttimann, Ricardo Iglesias, Paula Monti, Oscar Rizzo, Andrés Rosende y Maximiliano de Abreu por haberse desempeñado como revisores externos del Consenso de Inmunizaciones en Adultos con Cardiopatías de la Sociedad Argentina de Cardiología
Conflicto de intereses: Francisco Nacinovich recibió fondos de Pfizer, Seqirus, MSD y Sanofi-Pasteur para realizar presentaciones educativas y como soporte para asistir a Congresos. El resto de los autores, ninguno para declarar

Bibliografía
1. Smeeth L, Thomas SL, Hall AJ, Hubbard R, Farrington P, Vallance P. Risk of myocardial infarction and stroke after acute infection or vaccination. N Engl J Med 2004; 351: 2611-8.
2. Clayton TC, Thompson M, Meade TW. Recent respiratory infection and risk of cardiovascular disease: case-control study through a general practice database. Eur Heart J 2008; 29: 96-103.
3. Spodick DH, Flessas AP, Johnson MM. Association of acute respiratory symptoms with onset of acute myocardial infarction: prospective investigation of 150 consecutive patients and matched control patients. Am J Cardiol 1984; 53: 481-2.
4. Saikku P, Leinonen M, Mattila K, Ekman MR, Nieminen MS, Mäkelä PH, et al. Serological evidence of an association of a novel Chlamydia, TWAR, with chronic coronary heart disease and acute myocardial infarction. Lancet 1988; 2: 983-6.
5. Ministerio de Salud A. Tercera encuesta Nacional de factores de riesgo para enfermedades no transmisibles. Ministerio de Salud de La Nación Argentina – Msal.gob.ar 2015. En: http: //www.msal.gob.ar/images/stories/bes/graficos/0000000544cnt-2015_09_04_encuesta_nacional_factores_riesgo.pdf; consultado marzo 2019.
6. Vizzotti C, Katz N, Stecher D, Aquino A, Juárez MDV, Urueña A. Evaluación del uso en adultos de cuatro vacunas: una encuesta poblacional en Argentina. Medicina (B Aires) 2018; 78: 76-82.
7. Madjid M, Aboshady I, Awan I, Litovsky S, Casscells SW. Influenza and cardiovascular disease: is there a causal relationship? Tex Heart Inst J 2004; 31: 4-13.
8. Spencer FA, Goldberg RJ, Becker RC, Gore JM. Seasonal distribution of acute myocardial infarction in the second National Registry of Myocardial Infarction. J Am Coll Cardiol 1998; 31: 1226-33.
9. Meier CR, Jick SS, Derby LE, Vasilakis C, Jick H. Acute respiratory-tract infections and risk of first-time acute myocardial infarction. Lancet 1998; 351: 1467-71.
10. Kwong JC, Schwartz KL, Campitelli MA, et al. Acute myocardial infarction after laboratory-confirmed influenza infection. N Engl J Med 2018; 378: 345-53.
11. González-Romo F, Picazo JJ, García Rojas A, et al. Consenso sobre la vacunación anti-neumocócica en el adulto con patología de base. Rev Esp Quimioter 2017; 30: 142-68.
12. Corrales-Medina VF, Madjid M, Musher DM. Role of acute infection in triggering acute coronary syndromes. Lancet Infect Dis 2010; 10: 83-92.
13. Warren-Gash C, Blackburn R, Whitaker H, McMenamin J, Hayward AC. Laboratory-confirmed respiratory infections as triggers for acute myocardial infarction and stroke: a self-controlled case series analysis of national linked datasets from Scotland. Eur Respir J 2018; 51: 1701794.
14. Warren-Gash C, Smeeth L, Hayward AC. Influenza as a trigger for acute myocardial infarction or death from cardiovascular disease: a systematic review. Lancet Infect Dis 2009; 9: 601-10.
15. Corrales-Medina VF, Suh KN, Rose G, et al. Cardiac complications in patients with community-acquired pneumonia: a systematic review and meta-analysis of observational studies. PLoS Med 2011; 8: e1001048.
16. Gentile JH, Hernandez C, Sparo MD, Rodriguez EM, Ceriani C, Bruggesser F. Bacteremic Pneumococcal Pneumonia: a longitudinal study in 279 adult patients from a single Center. University of Louisville J Resp Inf 2018; 2: 47-51.
17. Luna CM, Pulido L, Niederman MS, et al. Decreased relative risk of pneumococcal pneumonia during the last decade, a nested case-control study. Pneumonia (Nathan) 2018; 10: 9.
18. Chioncel O, Lainscak M, Seferovic PM, et al. Epidemiology and one-year outcomes in patients with chronic heart failure and preserved, mid-range and reduced ejection fraction: an analysis of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail 2017; 19: 1574-85.
19. Ahmed MB, Patel K, Fonarow GC, et al. Higher risk for incident heart failure and cardiovascular mortality among community-dwelling octogenarians without pneumococcal vaccination. ESC Heart Fail 2016; 3: 11-7.
20. Udell JA, Zawi R, Bhatt DL, et al. Association between influenza vaccination and cardiovascular outcomes in high-risk patients: a meta-analysis. JAMA 2013; 310: 1711-20.
21. Mohseni H, Kiran A, Khorshidi R, Rahimi K. Influenza vaccination and risk of hospitalization in patients with heart failure: a self-controlled case series study. Eur Heart J 2017; 38: 326-33.
22. Panhwar MS, Kalra A, Gupta T, et al. Effect of influenza on outcomes in patients with heart failure. JACC Heart Fail 2019; 7: 112-7.
23. de Diego C, Vila-Córcoles A, Ochoa O, et al. Effects of annual influenza vaccination on winter mortality in elderly people with chronic heart disease. Eur Heart J 2009; 30: 209-16.
24. Kopel E, Klempfner R, Goldenberg I. Influenza vaccine and survival in acute heart failure. Eur J Heart Fail 2014; 16: 264-70.
25. Guía operativa vacunación antigripal 2019. Ministerio de Salud y Desarrollo Social. En: http: //www.msal.gob.ar/images/
stories/bes/graficos/0000001437cnt-2019-04_guiaoperativa-vacunacion-antigripal.pdf n.d; consultado marzo 2020.
26. Weiskopf D, Weinberger B, Grubeck-Loebenstein B. The aging of the immune system. Transpl Int 2009; 22: 1041-50.
27. Bonten MJM, Huijts SM, Bolkenbaas M, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med 2015; 372: 1114-25.
28. Nuorti JP, Butler JC, Farley MM, et al. Cigarette smoking and invasive pneumococcal disease.Active Bacterial Core Surveillance Team. N Engl J Med 2000; 342: 681-9.
29. Jiménez Ruiz CA, Buljubasich D, Sansores R, et al. SEPAR-ALAT Consensus Document on Antipneumoccal Vaccination in Smokers. Arch Bronconeumol 2015; 51: 350-4.
30. Vacunacion contra neumococo. Estrategia Argentina 2017-2018. Lineamientos técnicos, Ministerio de Salud. En: http: //www.msal.gob.ar/images/stories/bes/graficos/0000000947cnt-lineamientos_neumo_adultos_WEB.pdf n.d; consultado marzo 2020.
31. WHO Publication. Pneumococcal vaccines WHO position paper – 2012 – recommendations. Vaccine 2012; 30: 4717-8.
32. Jackson LA, Gurtman A, Rice K, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 70 years of age and older previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine 2013; 31: 3585-93.
33. Jackson LA, El Sahly HM, George S, et al. Randomized clinical trial of a single versus a double dose of 13-valent pneumococcal conjugate vaccine in adults 55 through 74 years of age previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. Vaccine 2018; 36: 606-14.
34. Kobayashi M, Bennett NM, Gierke R, et al. Intervals between PCV13 and PPSV23 vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2015; 64: 944-7.
35. Centers for Disease Control and Prevention (CDC). Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2012; 61: 816-9.
36. Scheifer C, Rolland-Debord C, Badell E, et al. Re-emergence of Corynebacterium diphtheriae. Med Mal Infect 2018; 49: 463-6.
37. Kretsinger K, Broder KR, Cortese MM, et al. Preventing tetanus, diphtheria, and pertussis among adults: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine recommendations of the Advisory Committee on Immunization Practices (ACIP) and recommendation of ACIP, supported by the Healthcare Infection Control Practices Advisory Committee (HICPAC), for use of Tdap among health-care personnel. MMWR Recomm Rep 2006; 55: 1-37.
38. Jackson LA, Yu O, Belongia EA, et al. Frequency of medically attended adverse events following tetanus and diphtheria toxoid vaccine in adolescents and young adults: a Vaccine Safety Datalink study. BMC Infect Dis 2009; 9: 165.
39. Programa Nacional de Control de Enfermedades Inmunoprevenibles. Recomendaciones Nacionales de Vacunación Argentina. ProNaCEI – Programa Nacional de Control de Enfermedades Inmunoprevenibles 2013. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000451cnt-2013-06_recomendacionesvacunacion-argentina-2012.pdf; consultado marzo 2019.
40. Sampson HA, Muñoz-Furlong A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: summary report-Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol 2006; 117: 391-7.
41. Delafuente JC, Davis JA, Meuleman JR, Jones RA. Influenza vaccination and warfarin anticoagulation: a comparison of subcutaneous and intramuscular routes of administration in elderly men. Pharmacotherapy 1998; 18: 631-6.
42. Casajuana J, Iglesias B, Fábregas M, et al. Safety of intramuscular influenza vaccine in patients receiving oral anticoagulation therapy: a single blinded multi-centre randomized controlled clinical trial. BMC Blood Disord 2008; 8: 1.
43. Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018; 39: 1330-93.
44. Beyer-Westendorf J, Gelbricht V, Förster K, et al. Periinterventional management of novel oral anticoagulants in daily care: results from the prospective Dresden NOAC registry. Eur Heart J 2014; 35: 1888-96.
45. Carnovale C, Raschi E, Leonardi L, et al. No signal of interactions between influenza vaccines and drugs used for chronic diseases: a case-by-case analysis of the vaccine adverse event reporting system and vigibase. Expert Rev Vaccines 2018; 17: 363-81.
46. Farrow PR, Nicholson KG. Lack of effect of influenza and pneumococcal vaccines on anticoagulation by warfarin. J Infect 1984; 9: 157-60.
47. Stout KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC Guideline for the Management of Adults With Congenital Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol 2019; 73: 1494-563.
48. Harrison JL, Silversides CK, Oechslin EN, Kovacs AH. Healthcare needs of adults with congenital heart disease: study of the patient perspective. J Cardiovasc Nurs 2011; 26: 497-503.
49. McNeil MM, Weintraub ES, Duffy J, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol 2016; 137: 868-78.
50. Grohskopf LA, Sokolow LZ, Olsen SJ, Bresee JS, Broder KR, Karron RA. Prevention and Control of Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices, United States, 2015-16 Influenza Season. MMWR Morb Mortal Wkly Rep 2015; 64: 818-25.
51. Roses M, Bonvehí PE. Vacunas en adultos. Medicina (B Aires) 2019; 79: 552-8.
RECOMENDADAS EN EL CONSENSO
Vacuna antigripal
Aspectos prácticos de la administración de la vacuna.
– La vacuna antigripal se puede administrar simultáneamente con otras vacunas.
(ej: vacuna antineumocóccica, con la que comparte indicaciones) pero deben ser aplicadas en sitios diferentes.
– La seroprotección se obtiene 2 a 3 semanas luego de su administración (debido a lo cual se recomienda administrar al comienzo del otoño).
– Se trata de una vacuna de agentes inactivados (muertos): esto implica que los virus no se replican en el organismo, por lo cual se requiere de dosis de refuerzo para mantener una inmunidad duradera.
– La inmunidad conferida por la vacuna es variable de acuerdo a cada individuo, pero suele durar 6 a 12 meses.
– La vía de administración de la vacuna es intramuscular o subcutánea profunda. En pacientes anticoagulados la administración de la vacuna es segura cuando se emplea la región deltoidea; en base a la evidencia disponible parecería que la vía intramuscular posee menos efectos adversos. Sí resulta imprescindible asegurarse que los pacientes se encuentren en valores de anticoagulación recomendados. Además se deberá realizar compresión más prolongada para asegurar la hemostasia.
Contraindicaciones para la vacunación antigripal
Son muy raras, a saber:
– antecedentes de reacción alérgica grave (anafilaxia) posterior a una dosis previa de la vacuna, o a algún componente de la vacuna, especialmente la proteína del huevo- antecedente de un síndrome de Guillain Barré que se haya presentado dentro de las seis semanas luego de recibir una dosis de vacuna influenza y habiéndose descartado otras causas del mismo.
Eventos adversos vinculados a la vacunación antigripal
Son poco frecuentes (menos del 15% de los casos), siendo en su mayoría leves; pueden ser locales (como dolor, induración o eritema) o generales (principalmente fiebre, malestar y mialgia), los cuales resuelven en pocos días, y generalmente no requieren conductas adicionales.
Vacuna antineumocócica
Aspectos prácticos de la administración de la vacuna
– Ambas vacunas contra neumococo (VPN23 y VCN13) se pueden administrar simultáneamente con otras vacunas (ej: vacuna antigripal) pero deben ser aplicadas en sitios diferentes.
– En mayor a 18 años con indicación de vacunación secuencial contra neumococo haya recibido primero una dosis de vacuna polisacáridos (VPN23) deberá esperarse al menos 12 meses para administrársele la vacuna conjugada (VCN13). La vía de administración de ambas vacunas es INTRAMUSCULAR. En el caso de pacientes anticoagulados el fabricante sugiere que la vacuna conjugada (VCN13) se administre subcutánea; para la vacuna polisacáridos (VPN23) parece razonable emplear la vía Intramuscular.
Al igual que para cualquier vacuna en pacientes anticoagulados, se deberá corroborar que las personas que utilizan antagonistas de la vitamina K (acenocumarol o warfarina) no se encuentre en valores superiores a lo recomendado.
Además se deberá realizar compresión más prolongada para asegurar la hemostasia.
Contraindicaciones para la vacunación contra neumococo
La única contraindicación formal de la vacuna es el antecedentes de reacción alérgica grave (anafilaxia) posterior a
una dosis previa de la misma.
Eventos adversos vinculados a la vacunación antineumocócica
Ambas vacunas tienen poco frecuentes; el más constante es la reactogenicidad local (en alrededor del 30%) y no requiere
conducta activa. El desarrollo de fiebre es muy raro (menos del 1% de los individuos que reciben la intervención).
Recomendaciones para ambas vacunas
La sospecha de alergia al huevo no es una contraindicación para la vacunación contra influenza y/o neumococo, aunque si la sospecha es elevada puede ser recomendable observar al paciente un breve período posterior a la dosis.
Se debe tener precaución ante enfermedades agudas graves con fiebre, y postergar la vacunación hasta la resolución de la fiebre. Sin embargo los cuadros agudos benignos, como rinitis, tos, catarro o diarrea no requieren que se postergue la vacunación.
Vacuna antitetánica (doble adultos)
Aspectos prácticos de la administración de la vacuna
– La administración reciente o concomitante de gammaglobulina no afecta la respuesta inmunitaria lograda con la vacunación.
– En adultos se coloca de forma intramuscular en el músculo deltoides.
– En pacientes anticoagulados el fabricante sugiere su administración subcutánea, estando contraindicada su administración
endovenosa.
– El intervalo interdosis mínimo es de 4 semanas.
– Por tratarse de una vacuna inactivada, puede aplicarse concomitantemente con cualquiera de las vacunas incluidas en el calendario nacional de vacunación, pero se debe aplicar en sitios anatómicos distintos, con diferentes jeringas.
– En el caso de heridas o cirugías sucias (ej. apertura de órganos huecos, fracturas expuestas, etc.) se debe administrar
una nueva dosis de vacuna doble adultos (dT) o cualquier vacuna con componente antitetánico cuando hayan transcurrido más de 5 años desde la última dosis. Sin embargo esto no aplica a los procedimientos cardiovasculares, sean programados o de urgencia.
Contraindicaciones para la vacunación doble adultos (dT)
Son muy raras, a saber:
– Antecedentes de anafilaxia por alguno de los componentes de la vacuna, o cuadro de encefalopatía dentro de los 7 días de haber sido vacunados sin otra causa demostrable.
– Síndrome de Guillain Barré dentro de las 6 semanas de la administración de la vacuna.
– Ante enfermedad neurológica progresiva se deberá postergar la vacunación hasta la estabilización de la misma.
– Ante una reacción tipo Arthus la vacuna debe postergarse hasta cumplir 10 años de la última dosis de toxoide tetánico o diftérico.
– La inflamación extensa del miembro superior no es contraindicación para la vacunación.
Eventos adversos vinculados a la vacunación doble adultos (dT)
Son poco frecuentes (< 10% de los casos) y habitualmente se limitan a reacciones cutáneas leves.
Para todas las vacunas
Una reacción cutánea aislada no constituye una contraindicación para administrar cualquier vacuna.
Una verdadera reacción anafiláctica debe presentar síntomas graves, entre ellos: dificultad respiratoria grave (principalmente por angioedema) y/o hipotensión grave y sostenida, los cuales habitualmente requieren una intervención farmacológica para su resolución. Los cuadros de anafilaxia suelen presentarse pocas horas luego del contacto con la sustancia alergénica. Este es un evento infrecuente muy raro en el contexto de la vacunación (1 a 10 por cada 1 000 000 de dosis de vacuna antigripal).
