CARLOS WALDBAUM 1, FABIANA LÓPEZ 2, PABLO ANTELO 1, JUAN SORDA 1
1 División Gastroenterología, Hospital de Clínicas José de San Martin Universidad de Buenos Aires, 2 Departamento de Bioquímica Clínica, Instituto de Fisiopatología y Bioquímica Clínica (INFIBIOC), Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Argentina
Resumen La infección por Clostridioides difficile (iCD) es la causa más frecuente de diarrea nosocomial. La primera línea terapéutica es la vancomicina asociada o no al metronidazol. En los últimos años se incrementó el número de fracasos terapéuticos con una mayor frecuencia de formas refractarias o recurrentes. El trasplante de microbiota fecal (TMF) ha surgido como una opción terapéutica para estos casos. Se evaluó la seguridad y la tasa de resolución empleando el TMF en un estudio observacional abierto y prospectivo de 21 pacientes con iCD recurrentes o refractarias internados entre los años 2016 y 2019. La edad media fue de 76.5 años (33-92). Diez presentaron una forma recurrente y 11 una refractaria, 18 fueron graves y 3 fulminantes. En 20 casos el TMF se administró por la vía digestiva alta y en uno por presentar íleo se utilizó la vía baja. Se empleó TMF de heces frescas en un caso y el resto recibió muestras congeladas de un banco de microbiota. Veinte pacientes (95.2%) tuvieron respuesta terapéutica favorable sin presentar recurrencias. Un caso recurrente, con osteomielitis y falla multiorgánica, no tuvo resolución tras dos TMF. La respuesta fue similar en las formas recurrentes y refractarias. Siete pacientes (31%) tuvieron efectos adversos leves y autolimitados. El TMF ha demostrado una alta eficacia como tratamiento de rescate de las formas graves de iCD, con escasos y leves efectos adversos. Contar con un banco de microbiota fecal resulta fundamental para disponer de este recurso terapéutico oportunamente.
Palabras clave: trasplante de microbiota fecal, Clostridioides difficile
Abstract Clostridiodes difficile infection (CDi) is the most common cause of nosocomial diarrhea. Vancomycin, associated or not to metronidazol, is the treatment of choice. However, the rate of treatment failure has increased over the last years and fecal microbiota transplantation (FMT) has emerged as a therapeutic option. To evaluate safety and efficacy of FMT were enrolled 21 hospitalized patients with refractory or recurrent CDi between 2016 and 2019. Fourteen (66%) patients were men and the average age was 76.5 years (range 33-92). Ten had recurrent and 11 refractory CDi, and 18 presented severe and 3 fulminant clinical forms. In 20 cases the FMT was delivered through a nasojejunal tube and in one patient with ileo via enema infusion. Frozen fecal from a stool bank were administered in 20 and in the remaining was used fresh fecal matter. The rate of resolution was observed in 20 patients (95.2%) and none presented recurrence. The response rate was similar in recurrent or refractory forms (9/10 vs 11/11 respectively). One patient with osteomyelitis and multiple organ failure received 2 FMT without response and died. Seven patients (31%) presented mild and self-limited adverse effects. FMT has shown a high efficacy as rescue treatment in cases with refractory or recurrent CDi regardless of severity, with mild side effects. Availability of a stool banks provide reliable, timely and equitable access to FMT for CDi.
Key words: fecal microbiota transplantation, Clostridioides difficile
Dirección postal: Carlos Waldbaum, División Gastroenterología, Hospital de Clínicas José de San Martín, Universidad de Buenos Aires, Av. Córdoba 2351, 1120 Buenos Aires, Argentina
e-mail: carloswaldbaum@gmail.com
La infección por Clostridioides difficile (iCD), antes denominado Clostridium difficile, es la causa más frecuente de diarrea adquirida en pacientes hospitalizados. En los últimos años alcanzó el rango de epidemia, con una mayor incidencia, gravedad y recurrencia 1, 2.
Este incremento se explicaría por el envejecimiento de la población, el uso masivo e indiscriminado de antibióticos y de inhibidores de la bomba de protones, la aparición de cepas más virulentas y la baja adherencia del personal de salud a las prácticas de control de las infecciones, como el lavado de manos 3-7.
Según la magnitud del compromiso del tubo digestivo y de las manifestaciones sistémicas la iCD se clasifica como leves/moderadas, graves o fulminantes 5. La pérdida de la diversidad de la microbiota intestinal o disbiosis parece desempeñar un papel relevante en la patogénesis de la iCD y de su recurrencia 6.
El metronidazol y la vancomicina son los antibióticos considerados de elección 5, 7-10. Sin embargo, en los últimos años se ha observado un incremento de los fracasos terapéuticos por la presencia de comorbilidades y/o la continua necesidad del uso de antibióticos por otras infecciones, y por la aparición de cepas resistentes 11, 12.
Tanto la refractariedad al tratamiento como la recurrencia de la iCD se asocian con graves complicaciones y con una elevada mortalidad 13.
El trasplante de materia fecal (TMF) ha mostrado su eficacia en el tratamiento de la iCD 14-16. Resolver el cuadro clínico de la iCD sin producir un mayor compromiso de la microbiota debería ser considerado un objetivo prioritario.
Las guías más recientes sobre iCD y TMF, junto con la opinión de expertos, recomiendan al TMF como el tratamiento de primera elección en adultos o niños con recurrencias múltiples, independientemente de la gravedad, y como alternativa terapéutica de la iCD refractaria 7, 9, 17-22.
En este estudio el TMF fue realizado en pacientes con iCD recurrentes o refractarias grave y fulminante.
Materiales y métodos
Se realizó un estudio abierto observacional, prospectivo, longitudinal y descriptivo en una cohorte de pacientes hospitalizados con iCD grave o fulminante refractarias para evaluar la seguridad y la tasa de resolución con el TMF.
El diagnóstico de iCD fue basado por la combinación de diarrea ≥ 3 deposiciones acuosas diarias durante más de 24 h o ≥ 8 deposiciones en 48 horas (escala 5 -7 de Bristol, World Health Organization, http://www.who.int/topics/diarrhoea) asociado a una prueba positiva para la enzima glutamato deshidrogenasa y los antígenos de la Toxina A y B en materia fecal (Copro Strio C.diffocile – Savy on DIAGNOSTICS) de CD, y/o la presencia de características colonoscópicas y/o histopatológicas de colitis pseudomembranosa en ausencia de otras causas. La iCD fue clasificada como grave, cuando la leucocitosis era > 15 000/mm3 y/o una elevación de la creatina sérica > 1.5 mg/dl. La forma fulminante se definió cuando había compromiso hemodinámico, sepsis, requerimiento de internación en unidad de cuidados intensivos, presencia de megacolon o perforación intestinal.
La refractariedad fue considerada cuando los síntomas persistieron tras ≥ 5 días de tratamiento con metronidazol en dosis de 500 mg c/8 horas IV y vancomicina 500 mg c/6 h VO y la recurrencia fue definida cuando iCD recidivó dentro de las 8 semanas de un episodio previo resuelto.
Los objetivos fueron evaluar: I) la respuesta terapéutica definida por una disminución del número de deposiciones (< 3 deposiciones o mejoría de la consistencia), acompañadas de una mejoría de los parámetros bioquímicos, II) la tasa de recurrencia, III) seguridad definida por cualquier evento adverso relacionado con el TMF y IV) grado de aceptación de los pacientes a este tipo de tratamiento.
Se consideraron criterios de exclusión: ser menor de 18 años, embarazo o lactancia, evidencia o sospecha de perforación de víscera hueca, enfermedad inflamatoria intestinal asociada o incapacidad de otorgar el consentimiento informado.
Los donantes se seleccionaron entre familiares cercanos y voluntarios sanos no relacionados y no remunerados, mayores de 18 años, los que fueron evaluados previamente mediante un cuestionario y una entrevista clínica para pesquisar los riesgos de padecer enfermedades transmisibles y factores que podrían influenciar nocivamente sobre la microbiota intestinal.
Fueron excluidos aquellos que presentaban antecedentes de uso de drogas ilícitas, encarcelamiento, comportamientos sexuales de riesgo, uso de corticoides, inmunosupresores o quimioterapia, ingesta de antibióticos los 6 meses previos, tatuajes/piercings o viajes a áreas de diarrea endémica en los últimos 6 meses, malignidad digestiva o enfermedad inflamatoria intestinal, pólipos o poliposis colónica, obesidad mórbida o depresión grave.
Los donantes fueron evaluados con pruebas en sangre para identificar la presencia de anticuerpos frente al virus de inmunodeficiencia humana (HIV) tipo 1 y 2, hepatitis A (anti HAV IgM), B (anti HBc, HBsAg) y C (anti HCV), Treponema pallidum y HTLV1 y 2. Además se realizaron hemogramas, y se determinaron los niveles de transaminasas, albúmina y creatinina séricas. En las heces se investigó presencia de bacterias enteropatógenas mediante coprocultivo, toxinas A y B de Clostridioides difficile, antígenos de Giardia lamblia y Criptosporidium, tinción para Cyclospora e Isoospora y examen parasitológico en búsqueda de quistes y huevos.
Las heces fueron recolectadas por el donante en un contenedor fecal estéril y desechable para evitar la contaminación ambiental y fueron transportadas en un envase refrigerado al Banco de Microbiota Intestinal de la División de Gastroenterología del Hospital de Clínicas José de San Martin. Las heces fueron procesadas en una cabina de seguridad biológica de nivel 2, dentro de las 6 horas posteriores a su recolección, con el objetivo de preservar una alta viabilidad bacteriana.
Se utilizaron muestras no menores de 60 g de heces, que fueron diluidas y homogeneizadas con solución salina, tamizadas (tamiz metálico de malla de 300 μm) para eliminar los fragmentos de alimentos no digerido, se concentró luego por centrifugación y se agregó glicerol como crioprotector hasta una concentración final del 10% y se almacenó en un congelador específico de −80° C.
La ruta de administración se seleccionó teniendo en cuenta la situación clínica de cada paciente, de manera que en presencia de íleo se excluía la vía alta. A todos se les suspendió el tratamiento antibiótico 24-48 h previas. Si la vía de administración fue la vía digestiva alta se indicó omeprazol 20 mg 12 h previas y se suministró 50 ml de la suspensión por vía endoscopía o a través de una sonda naso duodenal.
En caso de realizar el TMF por colonoscopía se realizó una preparación previa habitual con 4 litros de solución con polietilenglicol y se administraron de los 200 ml de la suspensión.
Si la administración era por enema, previamente se efectuó un enema evacuante con 200 ml de solución salina isotónica.
En ausencia de mejoría clínica y bioquímica posterior a los 5 días del TMF se ofreció un segundo procedimiento. El seguimiento posterior fue de 8 semanas.
El estudio fue realizado en la División de Gastroenterología del Hospital de Clínicas José de San Martín, Universidad de Buenos Aires y fue aprobado por el Comité de Ética y de Investigación.
Resultados
Entre los años 2016 y 2019 fueron incluidos 21 pacientes, edad media de 76.5 años (rango: 33-92), con iCD grave o fulminante refractarias (Tabla 1).
Todos los participantes dieron su consentimiento luego de haber sido informados por el investigador sobre las potenciales opciones terapéuticas, riesgos y beneficios del procedimiento.
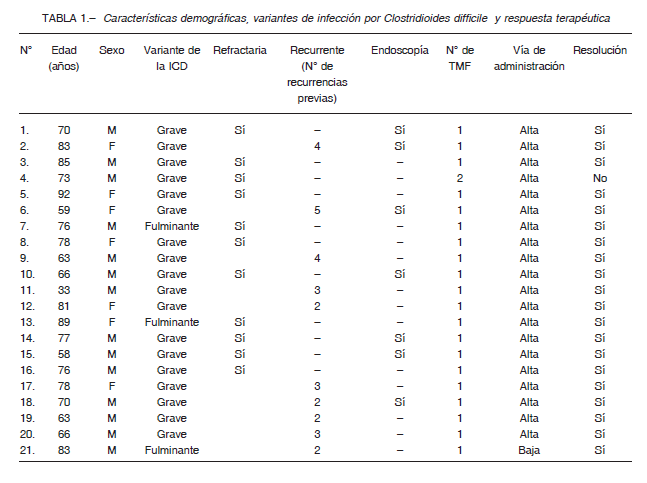
Todos los pacientes cumplieron los criterios para establecer el diagnóstico de iCD; presencia de diarrea asociada a una prueba positiva para la enzima glutamato dehidrogenasa más la detección en heces de las toxinas A y/o B. La endoscopía fue realizada en 7 casos observándose en todos ellos la presencia de pseudomembranas (Tabla 1).
A 20 pacientes se les efectuó el trasplante por vía alta y a uno por enema.
Presentaron respuesta terapéutica 20 de 21 pacientes (95.2%) luego de un único TMF y no se observaron recurrencias durante el periodo de seguimiento. Solo un paciente no resolvió el cuadro luego de recibir 2 TMF en el contexto de una osteomielitis grave, falla multiorgánica y necesidad de mantener el tratamiento con antibióticos.
Los pacientes respondieron de manera similar independientemente de haber presentado episodios previos de iCD o de ser su primer episodio (9/10 vs. 11/11 respectivamente).
En un solo caso se utilizó heces no congeladas de su esposa; mientras que en el resto de los pacientes se utilizaron muestras de donantes no relacionados de nuestro Banco de Microbiota.
Los efectos secundarios fueron observados en 7/21 (33%). Seis presentaron una diarrea auto limitada (≤ 72 h) y uno presentó dolor abdominal leve durante 3 horas posteriores al TMF.
Discusión
La iCD es una de las infecciones nosocomiales y de la comunidad asociadas al ámbito sanitario más frecuentes.
La exposición a antibióticos es el principal factor de riesgo al igual que el tiempo prolongado de internación, el uso de IBP y la edad del paciente 4, 23.
Otros factores incluyen: la enfermedad inflamatoria intestinal, los trasplantes de órganos, la quimioterapia y el estado de inmunodeficiencia 24-27. Recientemente se ha identificado a la malnutrición y a la hipoalbuminemia como factores que contribuyen a la severidad de la presentación clínica y de su recurrencia 28.
Desde la década del 70 el tratamiento de elección se basa en la suspensión, si fuera posible, del antibiótico que el paciente estuviera recibiendo y el empleo de vancomicina y/o metronidazol. La primera ha mostrado superioridad al metronidazol para las formas graves de la enfermedad 29. Actualmente se discute si las variantes leves pueden ser tratadas solamente con metronidazol.
Aunque estudios iníciales demostraban similar eficacia 29, recientes resultados muestran superioridad de la vancomicina sobre el metronidazol y avalarían su uso en las variantes menos graves de la infección 30, 31.
A pesar de los beneficios de la vancomicina en el tratamiento de la iCD, ocasiona una profunda alteración de la microbiota intestinal 32. Estudios recientes han revelado que la vancomicina produce una disminución de la diversidad de la microbiota y una depleción tanto del filo Bacteroidetes como del filo Protobacterias, las cuales han sido asociadas con un incremento de infecciones sistémicas posteriores al tratamiento (ej.: Klebsiella y Escherichia/Shigella). Por otra parte, ese efecto desfavorable sobrela microbiota podría ser responsable del elevado número de recurrencias.
Se estima que un 20 a un 30% de los pacientes con iCD resuelta con antibióticos experimentarán un episodio de recurrencia posterior al tratamiento inicial y del 65% tras la primera recurrencia 33, 34. Las recurrencias son complejas de tratar y las guías recomiendan varias opciones, incluyendo pulsos o una estrategia de disminución gradual de la dosis de vancomicina, tratamiento con fidaxomicina, rifaximina posterior al empleo de vancomicina, anticuerpos monoclonales contra las toxinas del CD35 o TMF 8, 14, 15, 36. Otra alternativa es la teicoplanina, antibiótico glicopeptido similar a la vancomicina, que podría tener resultados similares o superiores a ésta, principalmente en las recurrencia de la enfermedad 37.
El tratamiento de la infección refractaria constituye un desafío en la práctica clínica. En ausencia de respuesta al tratamiento antimicrobiano el TMF también surge como una alternativa terapéutica 18. En ambas condiciones,recurrencia o refractariedad de la iCD, el TMF corregiría la disbiosis, reconstruiría la resiliencia de la microbiota y probablemente induzca una respuesta inmunológica que facilitaría la erradicación 38-40.
En los pacientes con infección recurrente el TMF, comparado con el tratamiento estándar, ha mostrado excelentes resultados con una resolución cercana al 90% comparado con el 30% de los que recibieron vancomicina 15, 16, 31, 42.
Un reciente metaanálisis que incluyó 18 estudios con 611 pacientes mostró una curación del 91.2% con el TMF.
La recurrencia global fue del 5.5%, con una recurrencia temprana del 2.7% definida dentro de las 2 semanas y tardía del 1.7% 43.
Nuestros resultados muestran una tasa de resolución similar con el resultado adicional de no observarse recurrencias.
No hemos hallado diferencias en la respuesta al TMF independientemente del número de recurrencias que presentaba el paciente.
En nuestro estudio 11 pacientes presentaban una variante refractaria. En una revisión sistemática la eficacia general fue del 85% para la enfermedad recurrente y del 55% para la refractaria 44. Dos estudios aleatorizados sobre TMF en iCD que incluyeron pacientes con ambas variantes clínicas fueron recientemente publicados 45, 46, en ellos no se observaron diferencias significativas en la respuesta en ambos grupos.
Existe un bajo consenso en la manera de definir la variante refractaria, por tal motivo es de esperar que los resultados comunicados del TMF varíen sustancialmente 18.
En un metaanálisis que incluyó 37 estudios la resolución clínica se alcanzó en el 92% independientemente si la infección era recurrente o refractaria 36. Estos resultados son coincidentes con los obtenidos en nuestra serie de casos.
Otro aspecto de discusión en el tratamiento de la forma refractaria es el manejo de los antibióticos. Algunos consideran no suspenderlos e incluso mantenerlos posterior al TMF 47, 48. A todos nuestros pacientes con iCD refractaria se les suspendieron los antibióticos previamente y no se reiniciaron con posterioridad al TMF. Este hecho también podría influenciar sobre la tasa de respuesta.
Se estima que entre el 0.4 y el 3.6% de los pacientes con infección por CD precisarán una cirugía como alternativa terapéutica, y la mortalidad en este grupo es elevada (30-50%) 49. A pesar del incremento de los casos de iCD se ha observado una disminución de la indicación de la cirugía desde la implementación del TMF 50. En un reciente estudio que comparó el TMF con el tratamiento antibiótico estándar en pacientes con iCD grave o fulminante, el TMF mostró mayor eficacia en la resolución de la infección con una marcada disminución de la mortalidad 51.
Existen distintos tipos de donantes dependiendo de la relación que tenga con el receptor. La elección de un familiar conviviente con el receptor tendría la ventaja teórica de compartir idénticos factores ambientales, minimizar el riesgo de transmisión de agentes infecciosos y adaptarse mejor al sistema inmune del receptor al compartir una similar microbiota. No obstante, para la iCD la selección de donantes relacionados como no relacionados con el receptor parecería no influenciar sobre los resultados 52.
Del mismo modo el rendimiento del procesado fecal previamente congelado parecería no diferir de las muestras frescas 4, 36, y contar con un Banco de Microbiota permite realizar el tratamiento en forma inmediata y segura.
La vía de administración es otro aspecto de discusión, el TMF puede realizarse a través del tracto gastrointestinal superior (vía endoscópica, por sonda o con el empleo de cápsulas) o por vía baja mediante la instilación endoscópica o por enema. También se han realizado de manera combinada. La literatura describe ventajas y desventajas no significativas de cada una de las vías de administración 17, 36, 37, 40, 53. La decisión de la vía depende de la condición clínica del paciente y así fue seleccionada en nuestra experiencia.
La vía baja es la indicada en presencia de íleo, riesgo de aspiración o antecedentes de cirugía esofágica, gástrica o duodenal 54. La mayoría de los estudios comunican una única instilación, otros realizan varias dependiendo de la respuesta 16, 38, 52, 55.
Los estudios clínicos controlados con placebo no comunicaron eventos adversos graves o infecciones transmitidas por esta terapéutica, y en una revisión sistemática el TMF mostró similares respuestas y efectos adversos en receptores inmunocompetentes o inmunocomprometidos 56.
Se estima que los eventos adversos pueden variar entre 0% y 28% 57-59. Un tercio de los pacientes puede presentar alteraciones en el tránsito intestinal y/o flatulencias durante las 2 primeras semanas post procedimiento, los que suelen resolverse espontáneamente 15, 58.
Las complicaciones mayores están más vinculadas a los métodos de administración que al TMF por sí mismo.
En nuestra experiencia, al igual que lo informado en la literatura, los efectos adversos fueron leves, de corta duración, autolimitados y de fácil manejo clínico 59. No obstante de estas observaciones, recientemente fueron publicados 2 casos de infecciones graves por bacterias resistentes a antibióticos. Estos hallazgos alertan sobre el modo exhaustivo que deben evaluarse a los donantes 60.
En tiempos de pandemia por COVID-19 deberá pesquisarse la presencia de síntomas típicos o contacto cercano con personas con infección comprobada. Alternativamente, las heces de los donantes deben almacenarse durante 40 días antes de su uso, y liberarse solo si el donante no ha desarrollado síntomas y eventualmente realizar PCR para el SARS-CoV-2 en la materia fecal 61, 62.
Por el contrario, la iCD puede ocasionar bacteriemia a partir de gérmenes intestinales a través de la traslocación bacteriana en más del 50% de los pacientes. Algunas evidencias sugieren que esta complicación podría contribuir con la severidad en la evolución de la iCD, el tiempo de internación hospitalaria y con la mortalidad 63, 64. En una reciente publicación que incluyó 290 pacientes con iCD recurrente se mostró que el TMF se asociaba con menor probabilidad en desarrollar bacteriemia, comparado con el grupo que recibió antibioticoterapia 64.
A pesar que inicialmente se presumía una baja aceptabilidad del TMF por parte de los enfermos, no se han observado un rechazo a este procedimiento, a través de los años 65, 66. El 97% de los pacientes tratados por iCD estarían dispuestos a recibir nuevamente un TMF en el futuro si lo volviesen a necesitar y hasta el 53% lo elegirían como primera opción de tratamiento antes que los antibióticos 67.
Todos nuestros casos aceptaron la propuesta del TMF como alternativa terapéutica. Los resultados del TMF en otras entidades como en la enfermedad inflamatoria intestinal avalan también este concepto. En estos se ha observado que a mayor severidad del cuadro clínico mayor fue la aceptación e interés por el trasplante 68.
También debemos considerar la limitada experiencia e información que los médicos en general tienen sobre el TMF, su rol en el tratamiento de la iCD y la manera en que se comunica esta metodología al paciente. En una reciente publicación se determinó que menos del 10% de los médicos consideraban que el TMF sería aceptado por sus enfermos, mientras que en el mismo estudio se demostró que el 94% de los pacientes aceptaban el TMF cuando se les comunicaba correctamente sobre su seguridad y eficacia66.
La iCD es una de las infecciones más frecuentes en los pacientes hospitalizados y se asocia con una elevada morbilidad y mortalidad. A pesar de que la antibioticoterapia es el tratamiento de elección, la pérdida de la eficacia por la generación de resistencias, las características que presentan los pacientes infectados y las comorbilidades asociadas son habituales la falla al tratamiento y las recurrencias.
En los últimos años el TMF se ha posicionado como una alternativa terapéutica de mayor interés por su eficacia y seguridad. En la actualidad esta modalidad terapéutica ocupa su lugar como de primera elección en casos de recurrencias y en la iCD refractaria.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Khanna S, Pardi DS. The growing incidence and severity of Clostridium difficile infection in inpatient and outpatient settings. Expert Rev Gastroenterol Hepatol 2010; 4: 409-16.
2. McDonald LC, Owings M, Jernigan DB. Clostridium difficile infection in patients discharged from US short-stay hospitals, 1996-2003. Emerg Infect Dis 2006; 12: 409-15.
3. MacCannell DR, Louie TJ, Gregson DB, et al. Molecular analysis of Clostridium difficile PCR ribotype 027 isolates from Eastern and Western Canada. J Clin Microbiol 2006; 44: 2147-52.
4. Janarthanan S, Ditah I, M Phil, Adler DG, Ehrinpreis MN. Clostridium difficile-associated diarrhea and proton pump inhibitor therapy: a meta-analysis. Am J Gastroenterol 2012; 107: 1001-10.
5. Guh AY, Kutty PK. Clostridioides difficile Infection. Ann Intern Med 2018; 169: ITC49-ITC64.
6. Leffler DA, Lamont JT. Clostridium difficile infection. N Engl J Med 2015; 372: 1539-48.
7. Guery B, Galperine T, Barbut F. Clostridioides difficile: diagnosis and treatments. BMJ 2019; 366: l4609-28.
8. McDonald LC, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis 2018; 66: e1-48.
9. Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol 2013; 108: 478-98.
10. Martin LT, Vincent S, Gillian S, Moore K, Ratermann D, et al. Pharmacologic approach to management of Clostridium difficile infection. Crit Care Nurs Q 2019; 42: 2-11.
11. Petrella LA, Sambol SP, Cheknis A, et al. Decreased cure and increased recurrence rates for Clostridium difficile infection caused by the epidemic C. difficile BI strain. Clin Infect Dis 2012; 55: 351-7.
12. Walker AS, Eyre DW, Wyllie DH, et al. Relationship between bacterial strain type, host biomarkers, and mortality in Clostridium difficile infection. Clin Infect Dis 2013; 56: 1589-600.
13. Olsen MA, Yan Y, Reske KA, Zilberberg MD, Dubberke ER. Recurrent Clostridium difficile infection is associated with increased mortality. Clin Microbiol Infect 2015; 21: 164-70.
14. Ng SC, Kamm MA, Yeoh YK, et al. Scientific frontiers in faecal microbiota transplantation: joint document of Asia- Pacific Association of Gastroenterology (APAGE) and Asia Pacific Society for Digestive Endoscopy (APSDE). Gut 2020; 69: 83-91.
15. Cammarota G, Ianiro G, Kelly CR, et al. International consensus conference on stool banking for faecal microbiota transplantation in clinical practice. Gut 2019; 68: 2111-21.
16. van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368: 407-15.
17. Kump PK, Krause R, Steininger C, et al. Recommendations for the use of faecal microbiota transplantation stool transplantation: consensus of the Austrian Society of Gastroenterology and Hepatology (ÖGGH) in cooperation with the Austrian Society of Infectious Diseases and Tropical Medicine. Z Gastroenterol 2014; 52: 1485-92.
18. Mullish B, Quraishi MN, Segal JP, et al. The use of faecal microbiota transplant as treatment for recurrent or refractory Clostridium difficile infection and other potential indications: joint British Society of Gastroenterology (BSG) and Healthcare Infection Society (HIS) guidelines. Gut 2018; 67: 1920-41.
19. Allegretti JR, Mullish BH, Kelly C, Fischer M. The evolution of the use of faecal microbiota transplantation and emerging therapeutic indications. Lancet 2019; 394: 420-31.
20. Barcán L, Ducatenzeiler L, Bangher MC, et al. Recomendaciones intersociedades para diagnóstico, tratamiento y prevención de las infecciones por Clostridoides Difficile. Medicina (B Aires) 2020; 80 (Supl. I): 1-32.
21. Martinez JV, Raush A, Efrón ED, et al. Colitis refractaria por Clostridium difficile tratada con trasplante de microbiota fecal. Medicina (B Aires) 2019; 79: 291-4.
22. Waldbaum C, Antelo P, Sordá JA. Infección severa y complicada por Clostridium difficile resuelta con trasplante de microbiota. Acta Gastroenterol Latinoam 2017; 47: 211-5.
23. Johnson S. Recurrent Clostridium difficile infection: a review of risk factors, treatments, and outcomes. J Infect 2009; 58: 403-10.
24. Keddis MT, Khanna S, Noheria A, Baddour LM, Pardi DS, Qian Q. Clostridium difficile infection in patients with chronic kidney disease. Mayo Clin Proc 2012; 87: 1046-53.
25. Mullane KM, Cornely OA, Crook DW, et al. Renal impairment and clinical outcomes of Clostridium difficile infection in two randomized trials. Am J Nephrol 2013; 38: 1-11.
26. Albright JB, Bonatti H, Mendez J, et al. Early and late onset Clostridium difficile-associated colitis following liver transplantation. Transpl Int 2007; 20: 856-66.
27. Anders HJ, Andersen K, Stecher B. The intestinal microbiota, a leaky gut, and abnormal immunity in kidney disease. Kidney Int 2013; 83: 1010-6.
28. Curtis L. More Nutritional Research Needed to Prevent and Treat Clostridium difficile Infections. Am J Gastroenterol 2013; 108: 1813-4.
29. Zar FA, Bakkanagari SR, Moorthi KM, Davis MB. A comparison of vancomycin and metronidazole for the treatment of Clostridium difficile associated diarrhea, stratified by disease severity. Clin Infect Dis 2007; 45: 302-7.
30. Johnson S, Louie TJ, Gerding DN, et al. Polymer Alternative for CDI Treatment (PACT) investigators. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis 2014; 59: 345-54.
31. Siegfried J, Dubrovskaya Y, Flagiello T, et al. Initial therapy for mild to moderate Clostridium difficile infection: exploring the role of oral metronidazole versus vancomycin in 168 hospitalized patients. Infect Dis Clin Pract 2016; 24: 210- 6.
32. Issac S, Scher J, DjukovicA et al. Short- and long-term effects of oral vancomycin on the human intestinal microbiota. J Antimicrob Chemother 2017; 72: 128-36.
33. Musher DM, Aslam S, Logan N, et al. Relatively poor outcome after treatment of Clostridium difficile colitis with metronidazole. Clin Infect Dis 2005; 40: 1586-90.
34. Huebner ES, Surawicz CM. Treatment of recurrent Clostrium difficile diarrrhea. Gastroenterol Hepatol 2006; 2: 203-8.
35. Wilcox M, Gerding DN, Poxton IR, et al. Bezlotoxumab for prevention of recurrent clostridium difficile infection. N Engl J Med 2017; 376: 305-17.
36. Quraishi MN, Widlak M, Bhala N, et al. Systematic review with meta analysis: the efficacy of faecal microbiota transplantation for the treatment of recurrent and refractory Clostridium difficile infection. Aliment Pharmacol Ther 2017; 46: 479-93.
37. Wenisch C, Parschalk B, Hasenhiindl M, Hirschi AM, Graninger W. Comparison of vancomycin, teicoplanin, metronidazole, and fusidic acid for the treatment of clostridium difficile-associated diarrhea. Clini Infect Dis 1996; 22: 813-8.
38. Kelly C, Kahn S, Kashyap P, et al. Update on fecal microbiota transplantation 2015: indications, methodologies, mechanisms, and outlook. Gastroenterology 2015; 149: 223-37.
39. Brandt LJ, Aroniadis OC, Mellow M, et al. Long-term followup of colonoscopic fecal microbiota transplant for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107: 1079-87.
40. Bakken JS, Borody T, Brandt LJ, et al. Treating Clostridium difficile infection with fecal microbiota transplantation. Clin Gastroenterol Hepatol 2011; 9: 1044-9.
41. Garborg K, Waagsbo B, Stallemo A, Matre J, Sundoy A. Results of faecal donor instillation therapy for recurrent Clostridium difficile-associated diarrhoea. Scand J Infect Dis 2010; 42: 857-61.
42. Ooijevaar RE, van Beurden YH, Terveer EM, et al. Update of treatment algorithms for Clostridium difficile infection. Clin Microbiol Infec 2018; 24: 452-62.
43. Li YT, Cai HF, Wang ZH, Xu J,Fang JY. Systematic review with meta-analysis: long-term outcomes of faecal microbiota transplantation for clostridium difficile infection. Aliment Pharmacol Ther 2016; 43: 445-57.
44. Drekonja D, Reich J, Gezahegn S, et al. Fecal microbiota transplantation for Clostridium difficile infection: a systematic review. Ann Intern Med 2015; 162: 630-8.
45. Youngster I, Sauk J, Pindar C, et al. Fecal microbiota transplant for relapsing Clostridium difficile infection using a frozen inoculum from unrelated donors: a randomized, open-label, controlled pilot study. Clin Infect Dis 2014; 58: 1515-22.
46. Lee CH, Steiner T, Petrof EO, et al. Frozen vs fresh fecal microbiota transplantation and clinical resolution of diarrhea in patients with recurrent Clostridium difficile infection: a randomized clinical trial. JAMA 2016; 315: 142-9.
47. Ianiro G, Masucci L, Quaranta G et al. Randomised clinical trial: faecal microbiota transplantation by colonoscopy plus vancomycin for the treatment of severe refractory Clostridium difficile infection—single versus multiple infusions. Aliment Pharmacol Ther 2018; 48: 152-9.
48. van Beurden YH, Nieuwdorp M, van de Berg PJE, Mulder CJJ, Goorhuis A. Current challenges in the treatment of severe Clostridium difficile infection: early treatment potential of fecal microbiota transplantation. Ther Adv Gastroenterol 2017; 10: 373-81.
49. Freeman J, Bauer MP, Baines SD, et al. The changing epidemiology of Clostridium difficile infections. Clin Microbiol Rev 2010; 23: 529-49.
50. Cammarota G, Ianiro G, Magalini S, Gasbarrini A, Gui D. Decrease in surgery for clostridium difficile infection after starting a program to transplant fecal microbiota. Ann Intern Med 2015; 163: 487-8.
51. Tixier EN, Verheyen E, Ungaro RC, Grinspan AM. Faecal microbiota transplant decreases mortality in severe and fulminant Clostridioides difficile infection in critically ill patients. Aliment Pharmacol Ther 2019; 50: 1094-9.
52. Kassam Z, Lee CH, Yuan Y, Hunt RH. Fecal microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. Am J Gastroenterol 2013; 108: 500-8.
53. Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol 2014; 48: 693-702.
54. Link A, Lachmund T, Schulz C, Weigt J, Malfertheiner P. Endoscopic peroral jejunal fecal microbiota transplantation. Dig Liv Dis 2016; 48: 1336-9.
55. Guo B, Harstall C, Louie T, Veldhuyzen van Zanten S, Dieleman LA. Systematic review: faecal transplantation for the treatment of Clostridium difficile-associated disease. Aliment Pharmacol Ther 2012; 35: 865-75.
56. Kelly CR, Ihunnah C, Fischer M et al. Fecal microbiota transplant for treatment of Clostridium difficile infection in immunocompromised patients. Am J Gastroenterol 2014; 109: 1065-71.
57. Cheng Y, Phelps E, Ganapini V, et al. Fecal microbiota transplantation for the treatment of recurrent and severe Clostridium difficile infection in solid organ transplant recipients: a multicenter experience. Am J Transplant 2019; 19: 501-11.
58. Fischer M, Sipe B, Cheng YW, et al. Fecal microbiota transplant in severe and severe-complicated Clostridium difficile: a promising treatment approach. Gut Microbes 2017; 8: 289-302.
59. Agrawal M, Aroniadis OC, Brandt LJ, et al. The Long‐term efficacy and safety of fecal microbiota transplant for recurrent, severe, and complicated Clostridium difficile infection in 146 elderly individuals. J Clin Gastroenterol 2016; 50: 403-7.
60. DeFilipp Z, Bloom PP, Torres Soto M, et al. Drug-Resistant E. coli Bacteremia Transmitted by Fecal Microbiota Transplant. N Engl J Med 2019; 381: 2043-50.
61. Ianiro G, Mullish BJ, Kelly CR, et al. Screening of faecal microbiota transplant donors during theCOVID-19 outbreak: suggestions for urgent updates from an international expert panel. Lancet 2020; 5: 430-2.
62. Wu Y, Guo C, Tang L, et al. Prolonged presence of SARSCoV-2 viral RNA in faecal samples. Lancet 2020; 5: 434-5.
63. Falcone M, Russo A, Iraci F, et al. Risk factors and outcomes for bloodstream infections secondary to Clostridium difficile infection. Antimicrob Agents Chemother 2015; 60:252-7.
64. Ianiro G, Murri R, Desirè Sciumè G, et. Incidence of bloodstream infections, length of hospital stay, and survival
in patients with recurrent Clostridioides difficile infection treated with fecal microbiota transplantation or antibiotics. A prospective cohort study. Ann Intern Med 2019; 171: 695-702.
65. Park L, Mone A, Price JC, et al. Perceptions of fecal microbiota transplantation for Clostridium difficile infection: factors that predict acceptance. Ann Gastroenterol 2017; 30: 83-8.
66. Zipursky JS, Sidorsky TI, Freedman CA, et al. Patient attitudes toward the use of fecal microbiota transplantation in the treatment of recurrent Clostridium difficile infection. Can J Gastroenterol Hepatol 2014; 28: 319-24.
67. Sha S, Liang J, Chen M, et al. Systematic review: faecal microbiota transplantation therapy for digestive and nondigestive disorders in adults and children. Aliment Pharmacol Ther 2014; 39: 1003-32.
68. Kahn S, Vachon A, Rodriquez D, et al. Patient perceptions of fecal microbiota transplantation for ulcerative colitis. Inflamm Bowel Dis 2013; 19: 1506-13.
