RICARDO VALENTINI 1, JOSÉ FERNÁNDEZ 2, DARDO RIVEROS 3, FERNANDO PÁLIZAS 4, JORGE SOLIMANO 3, PABLO SAÚL 5, JUAN MEDINA 6, VIVIANA FALASCO 7, MARÍA LAURA DUPONT 8, JULIA LAVIANO 3, FLORENCIA FORNILLO 3, DANIELA MAYMÓ 3, DANIEL GOTTA 3, ALFREDO MARTÍNEZ 9, PABLO BONVEHÍ 10, JUAN DUPONT 3
1 Departamento de Medicina, CEMIC, 2 Medicina Transfusional, CEMIC, 3 Sección Hematología, CEMIC, 4 Terapia Intensiva, Sanatorio Güemes, 5 Servicio de Infectología, Policlínico de Unión Obrera Metalúrgica, 6 Terapia Intensiva, Sanatorio Itoiz, 7 Servicio de Clínica Médica, Hospital Pedro Fiorito, 8 Instituto Universitario, CEMIC, 9 Departamento de Análisis Clínicos, CEMIC, 10 Sección Infectología, CEMIC, Buenos Aires, Argentina
Resumen La pandemia de COVID-19, presentó desde su inicio elevada mortalidad, sin tratamiento efectivo para pacientes graves. Basados en experiencia previa con plasma de convaleciente en fiebre hemorrágica Argentina, incorporamos a un estudio multicéntrico 90 pacientes con COVID-19 de los que 87 fueron evaluables. Colectamos 397 donaciones de plasma de 278 convalecientes. El plasma fue suministrado con una concentración de IgG de 0.7-0.8 (medidos por quimioluminiscencia Abbott) por cada 10 kg/ peso. La supervivencia a 28 días fue la variable de resultado primario. El 77% fueron varones, edad 54 ± 15.6 años (rango: 27-85); índice de masa corporal de 29.7 ± 4.4; tenían hipertensión 39%, diabetes 20.7%; 19.5% tenían alguna condición de inmunosupresión, y el 23% era personal de salud. Se administró plasma a 55 (63%) en respiración espontánea con oxígeno (con máscara reservorio en 80%), y a 32 (37%) en ventilación mecánica. La supervivencia global a 28 días fue del 80%; 91% en quienes recibían oxígeno suplementario y 63% en los que permanecían en ventilación mecánica (p = 0.0002). Hubo mejora significativa en la escala clínica de neumonía de la OMS a los 7 y a los 14 días. La ferritina, LDH y PaO2/FiO2, mejoraron en la semana post-infusión. Observamos un episodio de sobrecarga de volumen circulatorio y una reacción febril, leves. Las infusiones de plasma de convaleciente son factibles, seguras y potencialmente efectivas, especialmente antes de requerir ventilación mecánica. Constituyen una opción clínica atractiva para tratar formas graves de COVID-19 hasta que estén disponibles otras terapias eficaces.
Palabras clave: tratamiento con plasma de convaleciente COVID-19, síndrome respiratorio agudo grave coronavirus 2, pandemia COVID-19
Abstract The COVID-19 pandemic presented high mortality from its beginning, without effective treatment for seriously ill patients. Build on the experience in Argentine hemorrhagic fever with convalescent plasma, we incorporated 90 patients with COVID-19, of which 87 were evaluable, into a multicenter study. We collected 397 plasma donations from 278 convalescent donors. Patients received plasma with an IgG concentration of 0.7-0.8 (measured by Abbott chemiluminescence) for every 10 kg of body weight. Survival during the first 28 days was the primary objective; 77% were male, age 54 ± 15.6 y/o (range 27-85), body mass index 29.7 ± 4.4; hypertension 39% and diabetes 20.7%; 19.5% had an immunosuppressive condition, 23% were health workers. Plasma was administered to 55 (63%) on spontaneous breathing with oxygen supplementation (mainly oxygen mask with reservoir bag in 80%), and to 32 patients (37%) on mechanical ventilation. The 28-day survival rate was 80%; 91% in patients infused on spontaneous breathing and 63% in those on mechanical ventilation (p = 0.0002). There was a significant
improvement in the WHO pneumonia clinical scale at 7 and 14 days, and in PaO2 / FiO2, ferritin and LDH, in the week post-infusion. We observed an episode of circulatory volume overload and a febrile reaction, both mild. Convalescent plasma infusions are feasible, safe, and potentially effective, especially before requiring mechanical ventilation. They are an attractive clinical option for treating severe forms of COVID-19 until other effective therapies become available.
Key words: COVID-19 convalescent plasma treatment, severe acute respiratory syndrome coronavirus 2,
COVID-19 pandemic
Dirección postal: Ricardo Valentini, Departamento de Medicina, CEMIC, Las Heras 2981, 1425 Buenos Aires, Argentina
e-mail: rvalentini@cemic.edu.ar
Conocimiento actual
• La mortalidad en las formas graves de la neumonía por COVID-19 puede ser muy elevada y no se dispone de terapia probada, excepto, según un estudio reciente, la administración de dexametasona especialmente en ventilación mecánica. Antecedentes con infusión de plasma de convaleciente en enfermedades virales, incluyendo otros coronavirus, constituyen el fundamento de terapia plasmática.
Contribución del artículo al conocimiento actual
• Este estudio con infusión de plasma de convaleciente en pacientes con formas graves de la enfermedad agrega evidencia sobre la factibilidad y seguridad de la terapia y muestra en comparación con datos bibliográficos, una potencial eficacia clínica especialmente en pacientes infundidos previo a la intubación y ventilación mecánica.
El brote del síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2) se originó en Wuhan, China y se ha convertido en una pandemia de alcance mundial1.
La neumonía inducida por SARS-CoV-2 es actualmente una de las principales causas de muerte de pacientes gravemente enfermos. A pesar de la investigación intensiva, aún no se ha descrito ninguna terapia probada para la enfermedad respiratoria grave que supere al soporte convencional 2. Los antibióticos, antivirales, antiparasitarios y una variedad de fármacos antiinflamatorios y biológicos, se incluyen en la terapia de apoyo, aunque con efectos adversos y efectividad dudosa. Recientemente un estudio mostró que 6 mg de dexametasona durante 10 días redujo la letalidad en aquellos con insuficiencia respiratoria grave 3.
El plasma de convaleciente se ha usado para transferir inmunidad pasiva en enfermedades virales. Entre 1974 y 1978 se estudió el efecto de la infusión de plasma inmune en la fiebre hemorrágica argentina, comparando con el del plasma normal, durante la primera semana desde el inicio de los síntomas. La tasa de letalidad entre 188 sujetos tratados con plasma normal fue del 16.5%, mientras que con plasma inmune fue del 1.1% 4.
Se ha usado plasma de convaleciente en otras epidemias, como las de gripe “española”, SARS, ébola, sarampión y H1N1, lo que llevó a diseñar ensayos en infectados con SARS-CoV-2. Varias series de casos, a principios de 2020, sugirieron que es una estrategia potencialmente eficaz para pacientes gravemente enfermos 5.
La seguridad de plasma de convaleciente fue analizada en 20 000 infusiones, mostrando menos del 1% de efectos secundarios adversos graves 6. El Programa de Acceso Ampliado de la red, patrocinado por el gobierno de EE.UU. anunció que 57 630 pacientes con COVID-19 habían recibido infusiones de plasma de convaleciente con similar perfil de seguridad 7.
Realizamos el presente estudio en pacientes con enfermedad grave COVID-19 para proporcionar datos sobre las características clínicas y el resultado después de recibir terapia con plasma de convaleciente. Conformamos una red entre veinticinco hospitales públicos y privados del área urbana y suburbana de Buenos Aires, y evaluamos la viabilidad, seguridad y eficacia potencial de la infusión de plasma de convaleciente.
Materiales y métodos
El presente estudio se realizó en el CEMIC (Centro de Educación Médica e Investigaciones Clínicas), un hospital universitario del área metropolitana de Buenos Aires. En respuesta al brote de COVID-19 en Argentina, diseñamos un ensayo multicéntrico abierto. Veinticinco hospitales públicos y privados ingresaron enfermos para el estudio. El protocolo de donación e infusión fue diseñado por investigadores del CEMIC y aprobado por el Comité de Ética en Investigación Institucional. El estudio también fue registrado y autorizado por la Autoridad Nacional de Sangre (Ministerio de Salud de la Nación) y registrado bajo PRIISA.BA (Plataforma de Registro Informatizado de Investigaciones en Salud de Buenos Aires).
Las instituciones de la red compartieron el protocolo y lo enviaron al comité de ética local o a las autoridades propias de cada hospital, para aprobar y autorizar las infusiones de plasma. Los pacientes de todas las instituciones recibieron unidades de plasma de donantes de CEMIC y no tuvieron ningún cargo financiero.
Las donaciones de plasma se obtuvieron de voluntarios de la comunidad que habían tenido COVID-19 probado, y a quienes se les realizaba una prueba de ARN viral en hisopados nasofaríngeos, que resultara negativa, previo al momento de la donación. Un centro de llamados a cargo de médicos docentes y estudiantes avanzados de la carrera médica en el Instituto Universitario CEMIC, estuvo a cargo de la selección, calificación y programación de la toma de sangre de los donantes en la Unidad de Medicina Transfusional. Un médico autorizado del estudio obtuvo el consentimiento informado por escrito de cada donante.
En todos los casos se siguió el método convencional de donación de sangre, centrifugación y posterior reinfusión de los glóbulos rojos autólogos. Se obtuvo un promedio de 300 ml de plasma de cada donante. Se obtuvo un total de 397 unidades, de 278 donantes (media: 1.4 unidades por donante). Se estudiaron los anticuerpos anti-HLA en mujeres con gestas previas. El programa de donaciones comenzó el 8 de abril de 2020, y el corte de la información se hizo el 27 de julio de 2020.
El análisis de anticuerpos IgG SARS-COV-2 se realizó en muestras de suero de donantes, utilizando el Analizador Architect Plus i2000sr, y el kit CMIA de IgG (Abbott, Illinois, EE.UU), un inmunoensayo automático que detecta anticuerpos IgG dirigidos a un antígeno recombinante de nucleocápside SARS-CoV-2 en suero o plasma. El índice numérico del Abbott Architect SARS-CoV-2 IgG se utilizó para inferir la concentración útil de anticuerpos en este estudio. Los índices obtenidos de los plasmas recolectados oscilaron entre 0 y 10 (media 5.7), los superiores a 3 fueron arbitrariamente considerados útiles, basados en las observaciones de estudios de Jääskeläinen AJ y col, en que esa titulación se acompañaba de concentraciones superiores a 1:320, con potencial capacidad neutralizante in vivo 8. Los pacientes recibieron el volumen necesario de plasma para lograr una dosis/índice de anticuerpos de 0.7-0.8/10 kg de peso.
Los adultos (≥ 18 años) y mujeres no embarazadas eran elegibles si tenían una enfermedad COVID-19 grave o crítica con ≤ 10 días desde el inicio de los síntomas o ≤ 7 días con ventilación mecánica (VM). La enfermedad grave se definió por lo siguiente: infiltrados pulmonares bilaterales en la radiografía de tórax o la tomografía computarizada, y saturación de oxígeno en sangre arterial ≤ 94%, con oxígeno suplementario por cánula nasal con al menos 3 l/min, máscara con bolsa reservorio (máscara-NRO2) o con ventilación no invasiva (VNI). La enfermedad crítica se definió como una o más de las siguientes: insuficiencia respiratoria con VM y PaO2/FiO2 inferior a 300 mm Hg, shock o disfunción multiorgánica.
El protocolo de plasma COVID-19 fue aprobado por el Comité de Ética en Investigación Institucional. La inclusión de los pacientes fue solicitada por los médicos de las unidades de cuidados críticos o intermedios del CEMIC o de los hospitales de la red. En este último caso se compartieron los datos clínicos y los resultados de los estudios de laboratorio y de imágenes. Se obtuvo un consentimiento informado escrito y firmado por el paciente o un representante legalmente autorizado. Se obtuvieron rutinariamente la tipificación de ABO y Rh y el peso corporal. Se suministró la/las unidades de plasma ABO compatible. La velocidad de infusión fue de 150 ml/h o más lenta si se sospechaba riesgo de sobrecarga circulatoria. Los datos clínicos de los pacientes se obtuvieron de los registros médicos electrónicos del hospital o de una hoja de cálculo compartida por las instituciones de la red. La primera infusión se realizó el 18 de abril de 2020.
Los datos recopilados incluyeron: características demográficas, comorbilidades, síntomas desde el inicio hasta la infusión de plasma, duración de la estadía hospitalaria y de la VM antes de la infusión de plasma; parámetros ventilatorios si estaban en VM, y biomarcadores séricos al inicio del estudio y luego a los 3, 5 y 7 días después de la infusión (proteína C reactiva, dímero D, ferritina y LDH).
El objetivo primario de resultado fue la tasa de supervivencia a los 28 días después de la infusión de plasma. Se evaluó la eficacia clínica según la escala de la OMS antes de la infusión de plasma, y a 7 y 14 días después de la misma.
Se consideró como eficacia al descenso de al menos 1 punto en la escala a 7 días y de al menos 2 puntos a los 14 días respecto al basal. La escala de progresión clínica de la OMS contiene 10 variables: 0: no infectado, no se detecta ARN viral; 1: asintomático, ARN viral detectado; 2: sintomático, independiente de asistencia; 3: sintomático, asistencia necesaria; 4: hospitalizado, sin oxigenoterapia; 5: hospitalizado, oxígeno por máscara o cánula nasal; 6: hospitalizado, oxígeno por VNI o alto flujo; 7: intubación y VM, PaO2/FiO2 ≥ 150 o SaO2/FiO2 ≥ 200; 8: VM, PaO2/FiO2 <150 (SaO2/FiO2 < 200) o vasopresores; 9: VM, PaO2/FiO2 < 150 y vasopresores, diálisis o ECMO; 10: muerte 9.
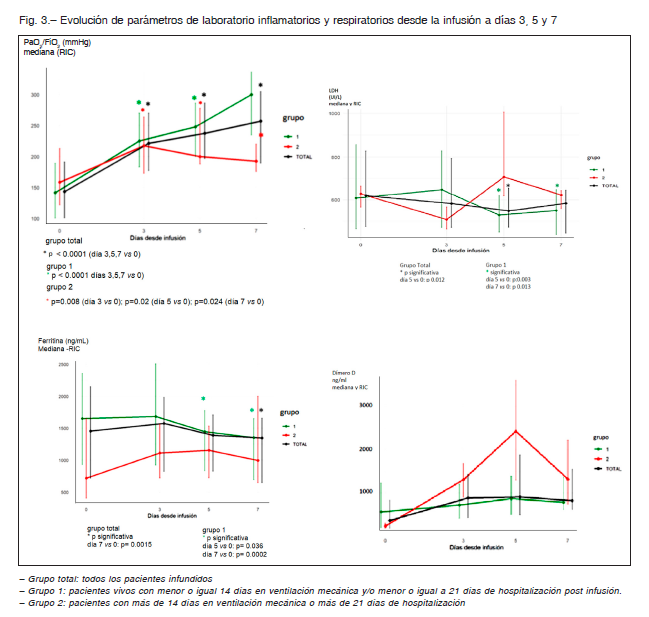
También, para determinar la potencial eficacia clínica se consideró como posible respuesta a la infusión plasmática, estar vivo a 28 días con un tiempo de hospitalización menor o igual a 21 días o un tiempo en VM menor o igual a 14 días, y se evaluó la evolución de parámetros de inflamación (ferritina, LDH y Dímero D) y de oxigenación arterial dentro de la primer semana post-infusión, comparándolos con los pacientes que murieron o que, aunque hayan vivido presentaran más de 21 días de hospitalización o más de 14 días de VM.
Las variables descriptivas se expresan como medias ± DE y rango. Las variables continuas de distribución normal y no normal se expresan como medianas y rangos intercuartilos (RIC). Se realizaron comparaciones pareadas utilizando la prueba de rango con signo de Wilcoxon. Para comparar proporciones se aplicó la prueba de χ2 o exacta de Fisher y se utilizó la prueba de Friedman para la comparación pareada entre grupos con variables no paramétricas y posterior corrección de Bonferroni. Se consideró significativo un valor de p inferior a 0.05. Se utilizó el método de Kaplan-Meier para la estimación de la supervivencia.
Resultados
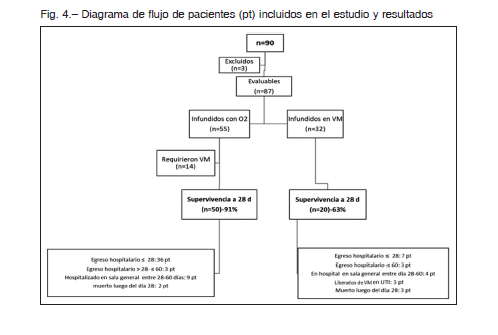
Desde el 18 de abril hasta el 27 de julio, se infundió plasma de convaleciente a 90 pacientes. Tres de ellos tenían condiciones comórbidas que impedían avanzar en esfuerzos terapéuticos inmediatamente después de la infusión y fueron por ese motivo excluidos, quedando 87 pacientes para el análisis.
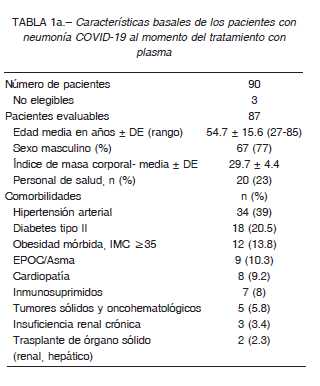
En los datos demográficos hubo predominio de varones, 77% con una razón varón/mujer de 3.4/1; la edad media fue 54 años (± 15.6, rango 27-85). El índice de masa corporal (IMC) medio fue de 29.7 (± 4.4, rango 25-37).
Las comorbilidades más frecuentes fueron hipertensión arterial (34 casos, 39%), diabetes tipo II (18 casos, 20.7%) y obesidad mórbida (IMC ≥ 35) en 12 (13.8%) pacientes. El 19.5% (17) tenían alguna condición considerada como inmunosupresión (enfermedades autoinmunes, enfermedad oncológica, oncohematológica, trasplante de órgano sólido).
La enfermedad cardiopulmonar estuvo presente en el 19.5% (EPOC, asma, insuficiencia cardíaca y enfermedad coronaria), 20 (23%) eran personal de la salud (Tabla 1a).
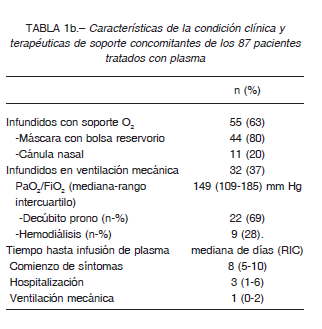
La mayoría se encontraba en la unidad de cuidados intensivos en el momento de la infusión de plasma (71, 82%) y en 16 casos la decisión de la terapéutica se tomó en la sala de cuidados generales o unidad de terapia intermedia. Treinta y dos (37%) fueron transfundidos en VM invasiva, y 55 (63%) recibieron plasma mientras estaban con suplemento de O2 (por cánula nasal en el 20% de los sujetos o por máscara-NRO2 en el 80%). En aquellos con VM, la mediana de PaO2/FiO2 en el momento de la inclusión fue de 149 mm Hg (RIC 109-185), con 25% de los pacientes con criterios de síndrome de dificultad respiratoria aguda grave. Se requirió VM en decúbito prono en 22 pacientes (69%) y hemodiálisis en 9 (10% de la población global y 28% de los pacientes en VM).
Los enfermos recibieron tratamientos según las recomendaciones que surgieron durante la pandemia; al principio, la mayoría recibió lopinavir-ritonavir (22 pacientes); 7 hidroxicloroquina con o sin azitromicina y ninguno de los últimos 32 incluidos recibió alguno de estos fármacos.
En 42 casos se utilizaron corticosteroides, en su mayoría dexametasona. Se realizó profilaxis antitrombótica con enoxaparina según las recomendaciones institucionales. El plasma se administró a una mediana de tres días del ingreso hospitalario, correspondiente a ocho días desde el inicio de los síntomas. En los que recibieron la infusión con VM, el tiempo desde la intubación hasta la infusión tuvo una mediana de 1 día (Tabla 1b). Todos recibieron 300-600 ml de plasma con valores de IgG CMIA entre 0.7 y 0.8 cada 10 kg de peso. La mediana de IgG de las bolsas infundidas fue de 6.5 (RIC 4-11.5). No disponíamos en las primeras 5 infusiones determinación de anticuerpos.
Retrospectivamente 2 de ellas tuvieron valores de 0 y 15, consideradas fuera del rango prefijado. En 29 pacientes (33.3%) la infusión de similar dosis fue reiterada a las 48-72 h de acuerdo evolución clínica y/o la persistencia de ARN viral. No se produjeron eventos adversos graves (grado 3-4) atribuidos a la transfusión de plasma en las 24 horas posteriores a la transfusión. Hubo un episodio febril relacionado y uno probablemente relacionado, con sobrecarga circulatoria. Estos dos eventos adversos fueron leves y no fue necesario detener la infusión de plasma.
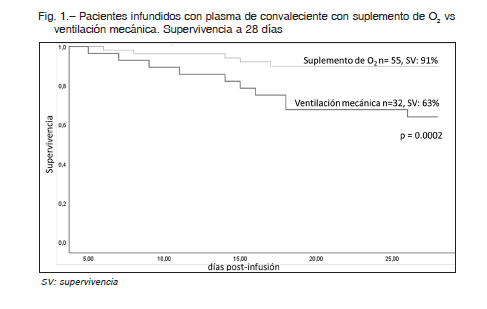
La supervivencia a los 28 días después de la infusión fue del 80% para todos los pacientes; del 91% para los pacientes que fueron infundidos con soporte de O2 y 63% para los tratados con VM invasiva (p = 0.0002) (Fig. 1).
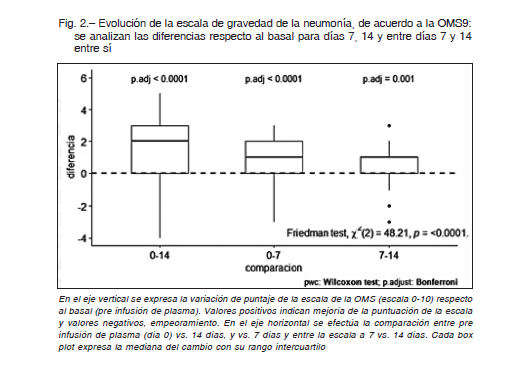
La tasa de intubación para pacientes con insuficiencia respiratoria y soporte de O2 fue del 25%. La puntuación de la escala clínica ordinal de la OMS mejoró significativamente a los 7 y 14 días después de la infusión en al menos 1 y 2 puntos respectivamente (Fig. 2). En 63 pacientes (72%) se observó una mejor puntuación en la evaluación al día 7 y en 56, (64%) al
día 14 (p < 0.001). En el 60% de la población, los pacientes vivieron a 28 días y tuvieron un tiempo en VM ≤ 14 días y/o un tiempo de hospitalización ≤ 21 días. Se observó una mejoría durante la primera semana después de la infusión de plasma en los parámetros respiratorios evaluados por PaO2/FiO2 y también en los parámetros inflamatorios (LDH y ferritina), sin diferencias significativas en el Dímero D, en este grupo versus los pacientes que murieron o vivieron a 28 días, pero con tiempo de hospitalización superior a 21 días o tiempo en ventilación mecánica superior a 14 días (Fig. 3).
Al momento de este informe, a 90 días de la primera infusión y a 30 días de la última, de los 87 pacientes, 22 fallecieron, 17 antes de los 28 días post infusión y 5 posteriormente. De los 65 supervivientes, 49 habían sido dados de alta hospitalaria, 16 permanecían hospitalizados luego del día 28 (13 de ellos en recuperación en sala general, 3 en terapia intensiva liberados de la VM) (Fig. 4).
Discusión
Informamos aquí las observaciones de 87 pacientes evaluables con neumonías graves y/o críticas por COVID-19, tratados con plasma de convaleciente.
En sus características basales predominaron los varones y la presencia de comorbilidades, particularmente diabetes, hipertensión arterial y obesidad mórbida al igual que lo reportado en varias series 10, 11. La obesidad registrada en nuestra población fue comparable a pacientes de terapias intensivas de EE.UU. Es un factor de riesgo para desarrollar formas graves de la enfermedad y afecta a más personas jóvenes que lo inicialmente informado 12. El 23% de los infundidos con plasma fue personal de la salud, remarcando su alto grado de exposición. La tasa de infección del personal de salud afectada por COVID-19 en Europa varió entre 6 y 44%, dependiendo de múltiples factores tales como la región, grado de exposición y la disponibilidad de elementos de protección personal 13.
En las 112 infusiones de nuestra serie se comprobaron un episodio de sobrecarga circulatoria y una reacción febril, sin necesidad de suspender la infusión. La seguridad de la infusión plasmática se ha comunicado recientemente en 20 000 pacientes en los que los efectos adversos inmediatos previsibles (sobrecarga circulatoria, injuria pulmonar aguda y reacciones alérgicas) fueron observados en menos del 1% de los casos 6.
La mortalidad global observada fue de 20% a 28 días, siendo significativamente menor en quienes recibieron la infusión plasmática en respiración espontánea con suplemento de O2, respecto de los que recibieron la infusión durante VM (9% vs. 37% respectivamente, p = 0.0002). En el estudio Recovery, la mortalidad a 28 días de los pacientes incluidos, con suplemento de O2, fue del 26% en la rama control y del 23% en la rama de dexametasona, con 32% y 28% respectivamente de los que requirieron intubación o murieron en ese período de análisis 3. El informe de ICNARC, describe la evolución de 10 228 pacientes con neumonía por COVID. En 2591 con soporte respiratorio básico, que incluye máscara de O2 con igual o mayor a 50% de FiO2, CPAP o VNI, la mortalidad fue del 19.5% 14.
Los infundidos con suplementos de O2, a pesar de altos requerimientos aportados con máscara de reservorio en la mayoría de los casos, progresaron a intubación en el 25% en nuestra serie. En estudios de pacientes con COVID-19 y neumonías con insuficiencia respiratoria con elevados suplementos de O2, la probabilidad de requerir VM es elevada. En dos Hospitales de Nueva York, con 1150 adultos hospitalizados, 62% de los individuos con requerimiento elevado de O2 (la mayoría con máscara-NRO2) necesitaron intubación y VM10.
En nuestro estudio, la mortalidad de los pacientes en VM fue de 37%. La mayoría de ellos estaban críticamente enfermos, con criterios de síndrome de dificultad respiratoria aguda grave en 25%, con ventilación en posición prona en 67%, y con fallo renal agudo con requerimientos de hemodiálisis en un 28%. La tasa de muerte en pacientes en VM por neumonía por COVID-19 ha sido elevada en otras series, alcanzando el 88% en hospitales de un área de Nueva York 15. En nuestro país aún no se disponen suficientes datos, pero en un informe preliminar de un grupo multicéntrico argentino, la mortalidad en 47 ventilados mecánicamente alcanzó el 62% y si solo se consideraran a aquellos en que la evolución fue conocida, (ya que 8 permanecían vivos, pero en VM), la tasa de muerte alcanzó el 78% 16.
El plasma de convaleciente se ha usado como tratamiento en numerosas infecciones virales. La experiencia paradigmática fue la eficacia en la fiebre hemorrágica argentina 4. En la infección por COVID-19, luego del primer reporte de 5 pacientes de un hospital de China 5, se sumaron datos de series de varios países. En Seattle, en 20 pacientes infundidos versus 20 controles, el resultado fue informado a 14 días, y solo se incluyeron 6 pacientes en VM, con 4 de ellos que permanecían ventilados al momento del informe17. En Irán, en 115 casos infundidos con plasma comparados con 74 controles, se comunicó una tasa de egreso del hospital de 98% vs. 78% respectivamente.
Se excluyeron pacientes en VM y los de alto requerimiento de O2 18. En otro estudio de China, 103 pacientes fueron asignados a plasma vs. grupo control; no se observaron diferencias en supervivencia a 28 días, pero sí hubo diferencia significativa en los que tenían enfermedad grave (hipoxemia sin VM), con mejoría clínica en la escala de la OMS en 91% de los tratados vs. 68%
del grupo control (p = 0.03). También se observó mayor negativización del ARN viral de las secreciones respiratorias (87 vs. 37% a 72 horas). Como dato para mencionar, la mediana a la infusión desde el inicio de los síntomas fue de 30 días19. En otro estudio chino de 39 casos y 156 controles, se reportó mejoría en los requerimientos de oxigenoterapia, y mayor probabilidad de supervivencia.
Ambos datos fueron obtenidos de pacientes con respiración espontánea con O2. Solo 4 casos con VM fueron incluidos, y la observación se limitó a 14 días 20. Un estudio multicéntrico holandés fue suspendido luego de enrolar 86 pacientes al observar que, en 53 de 66 testeados, se detectaron anticuerpos anti-SARS-CoV-2 antes de la infusión plasmática, incluyendo anticuerpos neutralizantes en 44 de 56 individuos. La evaluación de variables pronósticas, estadía hospitalaria o escala de severidad clínica a 15 días entre ambos grupos, no mostró diferencias en la mortalidad 21. Finalmente, en un estudio en Houston con 32 pacientes infundidos bajo respiración espontánea, la tasa de intubación fue del 15.6% y la mortalidad a 30 días de 22.5% vs. un 34% observado de registros de pacientes de la misma institución que no recibieron la terapia plasmática. Para el grupo de sujetos en VM, la tasa de mortalidad en los que recibieron plasma fue de 46.7% y el grupo comparativo del 68.5% 22.
Una de las maneras de evaluar los resultados de la intervención en nuestra serie fue la evolución del score clínico de la OMS y de variables de ferritina y PaO2/FiO2.
La mayoría de los enfermos infundidos (70%), mejoraron al menos 1 punto del score a 7 días y un 62% al menos 2 puntos a los 14 días. Asimismo, a los 7 días de la terapia plasmática se observó mejoría significativa del PaO2/FiO2, LDH y de la ferritina en los clasificados como respondedores.
Podría considerarse que la mejoría de parámetros clínicos y de laboratorio sea secundario a otras intervenciones, en especial los corticoides, ya que el estudio Recovery señala una mejoría de la supervivencia con dexametasona administrada luego de 7 días de evolución de los síntomas3, especialmente en los graves o con VM, precisamente el caso de los analizados en nuestro estudio. Sin embargo, 49% de los enfermos de nuestra población con neumonías graves no recibieron corticoides y tuvieron buena evolución en 68% de los casos.
Varias son las limitaciones de este estudio. La primera de ellas es que no contamos con una rama control sin plasma de convaleciente. Cuando lo diseñamos, no había terapia efectiva demostrada para esta enfermedad. La mortalidad que se reportaba al comienzo de la pandemia en las formas más graves era elevada, y el plasma de convaleciente era una posible estrategia para aplicar en esa situación (“tanto como se pueda, sin detenerse” 23).
La segunda limitación para considerar es nuestro desconocimiento del poder neutralizante del plasma infundido.
Evaluamos los plasmas de los donantes mediante Ac IgG contra la nucleocápside, que no establece capacidad neutralizante, y en los primeros donantes esta evaluación fue retrospectiva. Cuando dispusimos de esta prueba, se seleccionaron los plasmas por la lectura de ese método y la mayoría de los valores fueron superiores a 4 y nunca menores de 3. Según algunos estudios la concordancia entre esta respuesta serológica y la neutralización viral sugiere que una fuerte respuesta humoral puede ser
predictiva de actividad neutralizante, independientemente del antígeno blanco seleccionado8. Además, los valores superiores a 4 tuvieron una correlación con una titulación neutralizante de al menos 1/320 24.
La tercera limitante a considerar es el tiempo a la infusión desde el inicio de los síntomas. La insuficiencia respiratoria fue el parámetro básico de nuestro estudio para considerar la infusión, que en la mayoría de los casos se manifestó luego de varios días de iniciado el cuadro clínico, y en ocasiones superando la primera semana de la enfermedad. En un informe de 4209
pacientes con requerimiento de admisión a cuidados intensivos, la mediana de tiempo del inicio de los síntomas fue de 10 días 25. Si bien no es conocido aún el momento más oportuno para la infusión y si la principal acción del plasma es la neutralización viral, se puede suponer que cuanto más precoz, mejores resultados podrían obtenerse 26.
Como conclusión, este informe señala la factibilidad y seguridad de la terapia con plasma de convaleciente, observándose una mejoría de la escala de gravedad clínica luego de la infusión. Describimos un potencial efecto beneficioso en la supervivencia, particularmente en el grupo de pacientes con neumonías por COVID-19 severas con requerimiento de O2, en los que comprobamos tasas de mortalidad y de progresión a intubación inferiores a las referidas en otras series que no utilizaron la infusión de plasma. Reconociendo las limitaciones que tiene el análisis comparativo con datos de la bibliografía, estas observaciones permiten especular que el plasma de convaleciente podría reducir la necesidad de progresar a intubación y de esa manera impactar positivamente en la supervivencia. Por otro lado, observamos una menor eficacia en los pacientes infundidos bajo VM, aunque no podemos descartar, aún en estos casos críticos, alguna acción positiva en la reducción de las tasas de mortalidad, por el momento muy elevadas. Estas presunciones requieren confirmación a través de ensayos aleatorizados
o ser inferidas por cuidadosos estudios con análisis caso-control. Entre tanto, la administración de plasma de convaleciente es una opción válida y atractiva para el tratamiento de los pacientes graves y críticamente enfermos, hasta que se demuestre que otras terapéuticas sean eficaces y estén disponibles.
Agradecimientos: Dr. Roberto Cacchione, Dra. Guadalupe Carballal y Ac. Dr. Roberto Arana (CEMIC), por el asesoramiento. Servicio de Hemoterapia de CEMIC, Técnicos: Sergio Fridman, Analía Brest, Carla Farfán, Melody García Paredes, Natalia Goya, Lourdes Ilacqua, Carmen Kruppa, Roxana León Ruiz, Nidia López, Marcela Parrella, Claudia Quiroz, Marta Quiroz Fernández, Margarita Reta, Alejandra Sosa y Mariano Vázquez, por su diligente acción en la recolección, procesamiento del plasma y cuidado de los donantes. Instituto Universitario CEMIC; Dra. Jimena Rey, Alumnos, Mariano Wini, Tomás Rasines, por la colaboración en la convocatoria a los donantes, la selección y la organización de las donaciones. Unidad de Investigación CEMIC: Dra. Mónica Lombardo, Sra. Victoria Marroquín, Sra. Stella Zarza, por el soporte técnico y regulatorio de la investigación
Conflicto de intereses: Ninguno para declarar
Instituciones participantes y responsables locales: CEMIC, Sanatorio Güemes (Ignacio Romero), Hospital Fiorito (Viviana Falasco), Unión Obrera Metalúrgica (Fabián Romano), Sanatorio Itoiz (Mariana Chamadoira), Sanatorio Modelo de Caseros (Ana Cantillo), Sanatorio Franchín (Eleno Aquino), Sanatorio Monte Grande (Adrián Nuñez), Clínica Boedo (Orlando Campo), Sanatorio Bernal (Gonzalo Cortés), Hospital Abete de Malvinas Argentinas (Liliana Kumar), Clínica Modelo de Morón (Natalia Rondinelli), Clínica Calchaquí (Carlos Cremaschi), Hospital Iriarte de Quilmes (Gustavo Cañete), Hospital Argerich (Margarita Torres Boden), Clínica Bazterrica (Fernando Pálizas(h)), Cruz Blanca de Lanús (Marta Catalán), Sanatorio Adventista (Yael Pere), Hospital Eurnekián de Ezeiza (Luis Taco), Clínica Berazategui (Marilin Cavallín), Clínica Ranelagh (Nancy Soruco), Sanatorio Modelo de Quilmes (Omar Ada), Hospital HIGA Eva Perón de San Martín (María Carolina Salazar), Hospital Balestrini de la Matanza (Nydia Funes)
Bibliografía
1. WHO. Coronavirus disease (COVID-19) Situation Report – 202. En: https://www.who.int/docs/default-source/coronaviruse/
situation-reports/20200809-covid-19-sitrep-202.pdf?sfvrsn=2c7459f6_2; consultado agosto 2020.
2. Berlin DA, Gulick RM, Martinez FJ. Severe Covid-19. N Engl J Med 2020. doi: 10.1056/NEJMcp2009575. Online ahead of print.
3. RECOVERY Collaborative Group, Horby P, Lim WS, et al. Dexamethasone in hospitalized patients with Covid-19 – Preliminary report. N Engl J Med 2020; NEJMoa2021436.doi: 10.1056/NEJMoa2021436. Online ahead of print.
4. Maiztegui JI, Fernandez NJ, de Damilano AJ. Efficacy of immune plasma in treatment of Argentine haemorrhagic fever and association between treatment and a late neurological syndrome. Lancet 1979; 2:1216-7.
5. Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically Ill patients with COVID-19 with convalescent plasma. JAMA 2020; 323:1582-9.
6. Joyner MJ, Bruno KA, Klassen SA, et al. Safety update: COVID-19 convalescent plasma in 20,000 hospitalized patients. Mayo Clin Proc 2020; 95: 1888-97.
7. Expanded access program for convalescent plasma discontinues enrollment, as FDA authorizes its emergency use. En: https://www.uscovidplasma.org/; consultado agosto 2020.
8. Jääskeläinen AJ, Kuivanen S, Kekäläinen E, et al. Performance of six SARS-CoV-2 immunoassays in comparison with microneutralization. J Clin Virol 2020; 129: 104512.
9. WHO Working Group on the Clinical Characterisation and Management of COVID-19 infection. A minimal common outcome measure set for COVID-19 clinical research. Lancet Infect Dis 2020; 20: e192-7.
10. Cummings MJ, Baldwin MR, Abrams D, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet 2020; 395:1763-70.
11. Docherty AB, Harrison EM, Green CA, et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterization Protocol: prospective observational cohort study BMJ 2020; 369:m1985.doi: 10.1136/bmj.m1985.
12. Kass DA, Duggal P, Cingolani O. Obesity could shift severe COVID-19 disease to younger ages. Lancet 2020; 395:1544-5.
13. Kursumovic E, Lennane S, Cook T M. Deaths in healthcare workers due to COVID-19: the need for robust data and analysis. Anaesthesia 2020; 75:989-92.
14. Intensive Care National Audit & Research Centre (ICNARC). En: https://www.icnarc.org/Our-Audit/Audits/Cmp/Reports; consultado agosto 2020.
15. Richardson S, Hirsch JS, Narasimhan M, et al. Presenting Characteristics, Comorbidities, and Outcomes Among 5700 Patients Hospitalized With COVID-19 in the New York City Area [published online ahead of print, 2020 Apr 22] [published correction appears in doi: 10.1001/jama.2020.7681]. JAMA 2020;323(20):2052-2059.
16. Plotnikov GA, Matesa A, Nadur JM, et al. Características y resultados de los pacientes infectados con nCoV19 con requerimiento de ventilación mecánica invasiva en la Argentina (Published ahead of print). En: http://rbti.org.br/imagebank/pdf/RBTI-0197-20-23.07.pdf; consultado agosto 2020.
17. Hegerova L, Gooley T, Sweerus KA, et al. Use of convalescent plasma in hospitalized patients with Covid-19 – Case Series. Blood 2020; 136:759-62.
18. Abolghasemi H, Eshghi P, Cheraghali AM, et al. Clinical efficacy of convalescent plasma for treatment of COVID-19 infections: Results of a multicenter clinical study. Transfus Apher Sci 2020; 102875. doi: 10.1016/j.transci.2020.102875. Online ahead of print.
19. Li L, Zhang W, Hu Y, et al. Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and life-threatening COVID-19: A randomized clinical trial JAMA 2020; 324:1-11.
20. Liu STH, Lin H-M, Baine I, et al. Convalescent plasma treatment of severe COVID-19: A matched control study. medRxiv 2020. 05. 20. 2020 102236; doi: https: //doi.org/10. 1101/2020.05.20.20102236
21. Gharbharan A, Jordans CE, Geurtsvankessel C, et al. Convalescent plasma for COVID-19. A randomized clinical trial. medRxiv 2020.07.01.20139857; doi: https://doi.org/10.1101/2020.07.01.20139857
22. Donato Mi, Park S, Baker M, et al. Clinical and laboratory evaluation of patients with SARS-CoV-2 pneumonia treated with high-titer convalescent plasma: a prospective study. 2020. doi: https://doi.org/10.1101/2020.07.20.20156398
23. Rubin R. Testing an old therapy against a new disease: Convalescent plasma for COVID-19. JAMA 2020; 323: 2114-7.
24. Meschi S, Colavita F, Bordi L, et al. Performance evaluation of Abbott ARCHITECT SARS-CoV-2 IgG immunoassay in comparison with indirect immunofluorescence and virus microneutralization test. J Clin Virol 2020; 129:104539.
25. Grasselli G, Greco M, Zanella A, et al. Risk factors associated with mortality among patients with COVID-19 in intensive care Units in Lombardy, Italy. JAMA Intern Med 2020; e203539.
26. Joyner MJ, Senefeld JW, Klassen SA, et al. Effect of convalescent plasma on mortality among hospitalized patients with COVID-19: Initial Three-Month Experience. medRxiv 2020. 08.12. 20169359; doi: https://doi.org/10.1101/2020.08.12.20169359.
Los cuatro sentidos fundamentales de la convivencia humana son el sentido del humor, el sentido común y el sentido crítico.
Jorge Wagensberg (1948-2018)
El humor en aforismos. El País [Madrid]. Tribuna libre.17 de noviembre de 2017.
